|
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 19(4); 2019 > Article |
|
Abstract
Addressing the increasing antibiotic resistance, including clarithromycin resistance, which affects Helicobacter pylori (H. pylori) eradication therapy, is a challenge for clinicians. Antibiotic resistance is the main reason for H. pylori eradication failure and the resistance rate for clarithromycin may drastically increase, up to 38.5%, due to 23S ribosomal RNA point mutations. Therefore, the standard triple regimen is no longer suitable as the first-line treatment in most regions. However, there is a growing interest in personalized care for patients. Increased eradication rates of tailored therapy based on antibiotic susceptibility have been reported using nucleic acid-based techniques for clarithromycin resistance with a focus on the first-line eradication therapy of H. pylori infection. Herein, we discuss the eradication therapy for H. pylori, with a diagnostic test and appropriate treatment for clarithromycin resistance.
ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼(Helicobacter pylori, H. pylori) ņĀ£ĻĘĀņØĆ ĻČżņ¢æ ņ╣śļŻīļź╝ Ē¢źņāüņŗ£ĒéżĻ│Ā ĻČżņ¢æņØś ņ×¼ļ░£ņØä Ļ░Éņåīņŗ£Ēé©ļŗż. ļśÉĒĢ£ ņ£äņĢöņØś ņśłļ░® ĒÜ©Ļ│╝ņÖĆ ņĢäņÜĖļ¤¼ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņøÉņØĖņ£╝ļĪ£ņä£ Ļ░ÉņŚ╝ņŚÉ ļīĆĒĢ£ Ļ▓Ćņé¼ņÖĆ ņĀ£ĻĘĀņØä ņØ╝ņ░©ņĀüņ£╝ļĪ£ ņČöņ▓£ĒĢśĻ│Ā ņ׳ļŗż[1,2]. ĻĄŁļé┤ņØś Ļ▓ĮņÜ░ņŚÉņä£ļÅä 2018ļģä 1ņøö ņØ┤Ēøä H. pylori ņĀ£ĻĘĀņŚÉ ļīĆĒĢ£ ļ│┤ĒŚśĻĖēņŚ¼ņØś ĒÖĢļīĆļĪ£ ņĀ£ĻĘĀ ņ╣śļŻīļŖö ņĢ×ņ£╝ļĪ£ ĒÅŁļ░£ņĀüņ£╝ļĪ£ ļŖśņ¢┤ļéĀ Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗż. Ēśäņ×¼ ņØ╝ņ░© ņ╣śļŻīļĪ£ļŖö 1998ļģä ļīĆĒĢ£ņāüļČĆņ£äņןĻ┤Ć┬ĘĒŚ¼ļ”¼ņĮöļ░ĢĒä░ĒĢÖĒÜīņŚÉņä£ ņĀ£ņŗ£ĒĢ£ amoxicillin 2.0 g, proton pump inhibitor (PPI) ĻĘĖļ”¼Ļ│Ā clarithromycin 1.0 gņØ┤ļéś metronidazole 1.0 gņØä ņØ┤ņÜ®ĒĢ£ ņé╝ņĀ£ņÜöļ▓ĢņØä ņé¼ņÜ®ĒĢśĻ│Ā ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ņĄ£ĻĘ╝ ĒĢŁņāØņĀ£ ļé┤ņä▒ņŚÉ ņØśĒĢ£ ņĀ£ĻĘĀņ£© Ļ░Éņåī ņČöņäĖņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļōżļÅä ļ¦ÄņØ┤ ļ│┤Ļ│ĀļÉśņŚłĻ│Ā, ļŹöņÜ▒ņØ┤ ņØ╝ņ░© ņĀ£ĻĘĀ ņ╣śļŻī ņŗżĒī© Ēøä ņØ┤ņ░© ņĀ£ĻĘĀ ņ╣śļŻīļĪ£ ņé¼ņÜ®ļÉśļŖö PPI, bismuth, tetracycline, metronidazoleņØś ņé¼ņĀ£ņÜöļ▓ĢņŚÉ ļīĆĒĢ£ ņĀ£ĻĘĀņ£©ļ¦łņĀĆļÅä 2000ļģä ņ┤łļ░śņŚÉ 90% ņØ┤ņāüņØ┤ņŚłļŹś Ļ▓āņØ┤ 2000ļģäļīĆ ņżæļ░ś ņØ┤Ēøä ņĀÉņĀÉ ņĀĆĒĢśļÉśĻ│Ā ņ׳ļŖö ņŗżņĀĢņØ┤ļŗż[3-5]. ņØ┤ļ¤¼ĒĢ£ ņĀäļ░śņĀüņØĖ ņĀ£ĻĘĀņ£© Ļ░ÉņåīņØś ņøÉņØĖņ£╝ļĪ£ļŖö ĒĢŁņāØņĀ£ ļé┤ņä▒, ĒÖśņ×ÉņØś ļéśņØ┤, ĒØĪņŚ░ ņŚ¼ļČĆ, ņłÖņŻ╝ ļ®┤ņŚŁņØś ņ░©ņØ┤, ĻĖ░ņĀĆņ¦łĒÖś, ņł£ņØæļÅä Ļ░Éņåī ļō▒ņØ┤ ņ׳ņ¦Ćļ¦ī ņØ┤ ņżæ ĒĢŁņāØņĀ£ ļé┤ņä▒ņØ┤ Ļ░Ćņן ņżæņÜöĒĢ£ ņØĖņ×ÉļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[5-7].
1997ļģä ņĢäņŗ£ņĢä-Ēā£ĒÅēņ¢æ ĒĢ®ņØś ļ│┤Ļ│Āņä£ņŚÉņä£ ņØ┤ņāüņĀüņØĖ ņĀ£ĻĘĀ ņ╣śļŻīļŖö ņĀ£ĻĘĀņ£©ņØ┤ intention-to-treat ļČäņäØņ£╝ļĪ£ 80% ņØ┤ņāü, per-protocol ļČäņäØņ£╝ļĪ£ 90% ņØ┤ņāü ļÉśņ¢┤ņĢ╝ ĒĢ£ļŗżĻ│Ā ĒĢśņśĆņ£╝ļéś[8], ņŗżņĀ£ ĻĄŁļé┤ņŚÉņä£ ĻĘ╝ļל ļ│┤Ļ│ĀļÉśļŖö ņĀ£ĻĘĀ ņ╣śļŻīņØś ņĀ£ĻĘĀņ£©ņØĆ ņØ┤ņŚÉ ļ»Ėņ╣śņ¦Ć ļ¬╗ĒĢśĻ│Ā ņ׳ļŗż. ņāłļĪ£ņÜ┤ ĒĢŁņāØņĀ£ņØś ņĪ░ĒĢ®ņ£╝ļĪ£ ņØ┤ņĀäļ│┤ļŗżļŖö ņóŗņØĆ ņĀ£ĻĘĀņ£©ņØä ļ│┤ņØ╝ ņłśļŖö ņ׳ņ¦Ćļ¦ī Ļ▓ĮņÜ░ņŚÉ ļö░ļØ╝ņä£ļŖö ņāłļĪ£ņÜ┤ ĒĢŁņāØņĀ£ņØś ļé┤ņä▒ņØä ņØ╝ņ£╝ĒéżļŖö Ļ│äĻĖ░Ļ░Ć ļÉ£ļŗżļŖö Ļ▓āņØä ņśłņāüĒĢśĻ│Ā ņ׳ļŗż. ņŗżņĀ£ļĪ£ ļīĆļ¦īņØś Ļ▓ĮņÜ░ņŚÉņä£ ĻĘĖ ņśłļź╝ ļ│╝ ņłś ņ׳ļŖöļŹ░[9], ņĀ£ĒĢ£ņĀüņØ┤ļ®┤ņä£ ņĀüņĀłĒĢ£ ĒĢŁņāØņĀ£ ņé¼ņÜ®ņØ┤ Ēśäņ×¼ļĪ£ļŖö Ļ░Ćņן ņØ┤ņāüņĀüņØ┤ļØ╝ ņāØĻ░üĒĢśļ®░ ņØ┤ņŚÉ ņØ╝ņ░© ņĀ£ĻĘĀ ņÜöļ▓ĢņØä ņŗżņŗ£ĒĢśĻĖ░ ņĀäņŚÉ ņĀ£ņØ╝ ļ¼ĖņĀ£Ļ░Ć ļÉśļŖö clarithromycinņØś ļé┤ņä▒ Ļ▓Ćņé¼ļź╝ ņŗżņŗ£ĒĢśĻ│Ā ņØ┤ņŚÉ ļö░ļØ╝ ņĀüņĀłĒĢ£ ņ╣śļŻī ņĢĮņĀ£ļź╝ ņäĀĒāØĒĢśļ®┤ ņĀ£ĻĘĀņ£©ņØä 90% ņØ┤ņāüņ£╝ļĪ£ ļåÆņØ╝ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆĒĢśĻ│Ā ņ׳ļŗż. ņĄ£ĻĘ╝ Ļ░£ņĀĢļÉ£ Ļ│Āņŗ£ņŚÉ ļö░ļØ╝ H. pylori ņĀ£ĻĘĀ ņĀäņŚÉ ļ»Ėļ”¼ clarithromycin ļé┤ņä▒ņØä ĒīÉļŗ©ĒĢĀ ņłś ņ׳Ļ▓ī ļÉśņŚłĻ│Ā, ņĀüņĀłĒĢ£ ĒĢŁņāØņĀ£ļź╝ ņé¼ņÜ®ĒĢ©ņ£╝ļĪ£ņŹ© ĒĢŁņāØņĀ£ ļé©ņÜ®ņØä ņżäņØ╝ ņłś ņ׳ņ£╝ļ®┤ņä£ ņØ┤ņāüņĀüņØĖ ņĀ£ĻĘĀņ£©ņŚÉ ņĀæĻĘ╝ĒĢĀ ņłś ņ׳ļŖö Ļ░ĆļŖźņä▒ņØä ņŚ┤Ļ▓ī ļÉśņŚłļŗż.
ClarithromycinņØĆ macrolide Ļ│äņŚ┤ņØś ĒĢŁņāØņĀ£ļĪ£ erythromycinņØś 6ļ▓ł hydroxylĻĖ░ļź╝ methylation ņŗ£Ēé© ļ░śĒĢ®ņä▒ ĒĢŁņāØņĀ£ņØ┤ļŗż. ņäĖĻĘĀņØś ļ”¼ļ│┤ņå£(ribosome)ņŚÉ Ļ▓░ĒĢ®ĒĢśņŚ¼ ļŗ©ļ░▒ņ¦ł ņāØņä▒ņØä ņ¢ĄņĀ£ĒĢśĻ▓ī ļÉśļŖöļŹ░, ņØ┤ Ļ│äņŚ┤ņØś ļŗżļźĖ ĒĢŁņāØņĀ£ņŚÉ ļ╣äĒĢśņŚ¼ ņé░ņä▒ ĒÖśĻ▓ĮņŚÉņä£ļÅä ņĢłņĀĢņä▒ņØ┤ ļåÆĻ│Ā ĒØĪņłśņ£©ņØ┤ ļåÆņØĆ ņןņĀÉņØ┤ ņ׳ļŗż. ĒĢ£ĒÄĖ, ņĀ£ĻĘĀņŚÉ ņé¼ņÜ®ĒĢśĻ│Ā ņ׳ļŖö ĒĢŁņāØņĀ£ļōżņØś Ļ░üĻ░üņØś ļé┤ņä▒ļźĀņØä ļ│┤ļ®┤ 2000ļģä ņØ┤ņĀäņŚÉļŖö metronidazole, clarithromycin, amoxicillinņŚÉ ļīĆĒĢ£ ļé┤ņä▒ļźĀņØ┤ Ļ░üĻ░ü 40.6%, 5.9%, 0%ņśĆņ£╝ļéś[10,11], 2003ļģäņŚÉļŖö 66.2%, 13.8%, 18.5%ļĪ£ ņ”ØĻ░ĆĒĢśņśĆĻ│Ā[12], 2007~2009ļģäņŚÉļŖö 27.6%, 38.5%, 4.8%ļĪ£ metronidazole, amoxicillinņŚÉ ļīĆĒĢ£ ļé┤ņä▒ņØĆ Ļ░ÉņåīĒĢśņśĆņ£╝ļéś clarithromycinņŚÉ ļīĆĒĢ£ ļé┤ņä▒ļźĀņØĆ ĻŠĖņżĆĒ׳ ņ”ØĻ░ĆĒĢśļŖö ņČöņäĖņŚÉ ņ׳ļŗż[13]. ņĄ£ĻĘ╝ 10ļģä ņØ┤ļé┤ņŚÉ ņłśĒ¢ēļÉ£ ņŚ░ĻĄ¼ņØś clarithromycinņŚÉ ļīĆĒĢ£ ļé┤ņä▒ļźĀ(2007Ōł╝2009ļģä)ņØ┤ 38.5%ļĪ£ ĻĖēĻ▓®Ē׳ ņ”ØĻ░ĆĒĢśņśĆļŗżļŖö ņĀÉņØĆ ļåĆļØ╝ņÜ┤ ņØ╝ņØ┤ļŗż. ļŗżļ¦ī ņŚ░ĻĄ¼ņ×ÉņŚÉ ļö░ļØ╝ ļŗżņåī ņ░©ņØ┤ļŖö ņ׳ņ£╝ļéś clarithromycin ļé┤ņä▒ņØĆ ļīĆņ▓┤ņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ņ£╝ļ®░, 2011ļģä ņŗ£Ē¢ēļÉ£ ļŗżĻĖ░Ļ┤Ć ņŚ░ĻĄ¼ņŚÉņä£ļÅä clarithromycin ļé┤ņä▒ļźĀņØä 26.3%ļĪ£ ļ│┤Ļ│ĀĒĢśņśĆļŖöļŹ░[14], ņØ┤ļ¤¼ĒĢ£ ņĀÉņØä Ļ░ÉņĢłĒĢśļ®┤ ņĄ£ĻĘ╝ Ēæ£ņżĆ ņé╝ņĀ£ņÜöļ▓Ģ ņ╣śļŻī ņŗżĒī©ņØś ņŻ╝ņÜöĒĢ£ ņøÉņØĖņØ┤ clarithromycinņŚÉ ļīĆĒĢ£ ļé┤ņä▒ņ×äņØä ņĢī ņłś ņ׳ļŗż. ņŻ╝ļ¬®ĒĢĀ Ļ▓āņØĆ amoxicillinĻ│╝ clarithromycinņŚÉ ļ¬©ļæÉ ļé┤ņä▒ņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ņŚÉļŖö Ēæ£ņżĆ ņé╝ņĀ£ņÜöļ▓ĢņØś ņĀ£ĻĘĀņ£©ņØĆ 95% ļé┤ņÖĖņØĖ ļ░śļ®┤, clarithromycinņŚÉ ļé┤ņä▒ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉņä£ ņĀ£ĻĘĀņ£©ņØĆ 43Ōł╝65% ņĀĢļÅäļĪ£ ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ņ¢┤ clarithromycinņØś ļé┤ņä▒ņØ┤ ņĀ£ĻĘĀ ņ╣śļŻī ņŗżĒī©ņŚÉ Ļ░Ćņן Ēü░ ņśüĒ¢źņ×äņØä ņ”Øļ¬ģĒĢśņśĆļŗż[13,15].
ļæÉ Ļ░Ćņ¦Ć ņØ┤ņāüņØś ĒĢŁņāØņĀ£ņŚÉ ļé┤ņä▒ņØä ļ│┤ņØ┤ļŖö ļŗżņĢĮņĀ£ ļé┤ņä▒ H. pylori ĻĘĀņŻ╝ļÅä ņ¦ĆņåŹņĀüņ£╝ļĪ£ ĻŠĖņżĆĒ׳ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż. ļŗżņĢĮņĀ£ ļé┤ņä▒ĻĘĀņØĆ 1987ļģä 24%, 1994ļģä 33%, 2003ļģä 47.7%ļĪ£ ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░[16], ņØ┤Ēøä ņŚ░ĻĄ¼ņŚÉņä£ļÅä 2007Ōł╝2009ļģä 40.3%ļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż[13]. ņĄ£ĻĘ╝ņØś ņŚ░ĻĄ¼ņŚÉņä£ļÅä 2011Ōł╝2012ļģä 23.4%ļĪ£ ļéśĒāĆļé¼ļŗż[17]. ļŗżņĢĮņĀ£ ļé┤ņä▒ņØä ļ│┤ņØ┤ļŖö ĒĢŁņāØņĀ£ņØś ņĪ░ĒĢ®ņØĆ ļ¦żņÜ░ ļŗżņ¢æĒĢ£ļŹ░, ĒŖ╣Ē׳ ņĀ£ĻĘĀ ņ╣śļŻīņØś ņØ╝ņ░© ņĢĮņĀ£ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŖö amoxicillinĻ│╝ clarithromycinņŚÉ ļÅÖņŗ£ ļé┤ņä▒ņØä ļéśĒāĆļéĖ ĻĘĀņŻ╝ļŖö 2011ļģä ņŚ░ĻĄ¼ņŚÉņä£ 4.0%ņśĆļŗż[14]. ClarithromycinĻ│╝ metronidazoleņŚÉ ĒĢ©Ļ╗ś ļé┤ņä▒ņØä ļ│┤ņØ┤ļŖö ĻĘĀņŻ╝ ļśÉĒĢ£ 2013ļģä ņŚ░ĻĄ¼ņŚÉņä£ 6.1%ļĪ£ ļéśĒāĆļé¼ļŗż[17].
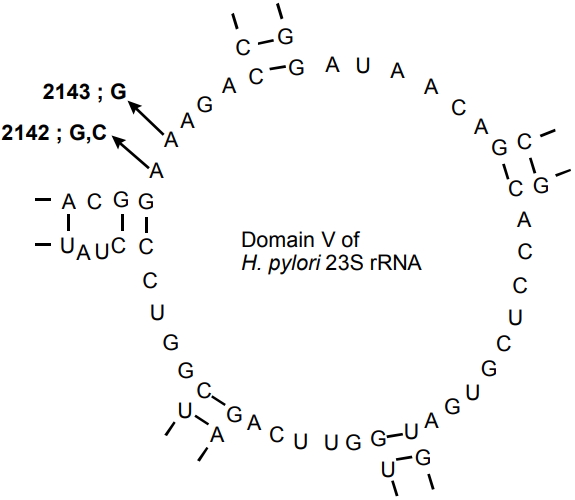
ClarithromycinņØĆ H. pyloriņŚÉ ļīĆĒĢśņŚ¼ ņé¼ņÜ® Ļ░ĆļŖźĒĢ£ Ļ░Ćņן Ļ░ĢļĀźĒĢ£ ĒĢŁņāØņĀ£ļĪ£ ļé©ņĢä ņ׳ņ£╝ļ®░ ņĀĢĻĘĀ ĒÖ£ņä▒ņØĆ 23S ribosomal RNA (rRNA) geneņŚÉ Ļ▓░ĒĢ®, ņ×æņÜ®ņØä ĒĢśņŚ¼ ļŗ©ļ░▒ņ¦ł ĒĢ®ņä▒ņØä ļ░®ĒĢ┤ĒĢśļŖö ĻĖ░ņĀäņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö ņĢĮņĀ£ņØ┤ļŗż. ņżæĒĢ®ĒÜ©ņåīņŚ░ņćäļ░śņØæĻ▓Ćņé¼(polymerase chain reaction, PCR) ĻĖ░ļ░ś Ļ┤æļ▓öņ£ä ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤, 23S rRNAņØś V ņśüņŚŁņŚÉ ņĮöļō£ ņśüņŚŁņØś ņĀÉ ļÅīņŚ░ļ│ĆņØ┤(point mutation)Ļ░Ć ņäĖĻĘĀ ļé┤ņä▒ņØä ņØ╝ņ£╝ĒéżļŖö Ļ▓āņ£╝ļĪ£ ļ░ØĒśĆņĪīļŗż(Fig. 1) [18]. ņØ┤ļ¤¼ĒĢ£ ļÅīņŚ░ļ│ĆņØ┤ļŖö clarithromycinĻ│╝ ĒŖ╣ņĀĢ ĒĢŁņāØņĀ£ Ļ┤ĆļĀ© ļŗ©ļ░▒ņ¦ł ĒĢ®ņä▒ņŚÉ ņé¼ņÜ®ļÉśļŖö ribosomal subunit ņé¼ņØ┤ņØś Ļ▓░ĒĢ®ņØä ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳ļŗż. ļśÉĒĢ£ H. pyloriļŖö ņ£ĀņČ£ ņ▒äļäÉ(efflux channel)ņØä ĒåĄĒĢśņŚ¼ ĒĢŁņāØņĀ£ļź╝ ņäĖĻĘĀ ļ░¢ņ£╝ļĪ£ ļ╣Āļź┤Ļ▓ī ņØ┤ļÅÖņŗ£ņ╝£ ĒĢŁņāØņĀ£Ļ░Ć ļ”¼ļ│┤ņå£ņŚÉ Ļ▓░ĒĢ®ĒĢśļŖö Ļ▓āņØä ļ░®ĒĢ┤ĒĢ£ļŗż[19]. ļö░ļØ╝ņä£ Ēæ£ņżĆ ņé╝ņĀ£ņÜöļ▓ĢņØ┤ļéś ņł£ņ░© ņ╣śļŻī(sequential therapy)ņŚÉņä£ ņ▓śņØī ņé¼ņÜ®ļÉśļŖö amoxicillinņØĆ ņ£ĀņČ£ ņ▒äļäÉņØä ņĢĮĒÖöņŗ£ņ╝£ ņØ┤ĒøäņŚÉ Ēł¼ņŚ¼ļÉśļŖö clarithromycinņØś ĒÜ©Ļ│╝ļź╝ Ē¢źņāüņŗ£ĒéżĻ│Ā ļé┤ņä▒ņØä ņ¢ĄņĀ£ĒĢśĻ▓ī ļÉ£ļŗż[20,21].
PCR ĻĖ░ļ░ś Ļ▓Ćņé¼Ļ░Ć ļ│┤ĒÄĖĒÖöļÉśĻĖ░ ņĀäņŚÉļŖö ņŻ╝ļĪ£ clarithromycinņŚÉ ļīĆĒĢ£ ļé┤ņä▒ņØä ņ¦äļŗ©ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ļ░░ņ¢æ ļ░Å ļööņŖżĒü¼ ĒÖĢņé░ļ▓Ģ(disk diffusion method), E-test ļō▒ņØś ļ░®ļ▓ĢņØ┤ ņØ┤ņÜ®ļÉśņ¢┤ ņÖöļŗż. ņĄ£ņåī ņ¢ĄņĀ£ ļåŹļÅä(minimal inhibitory concentration)ļŖö ĒĢŁĻĘĀļĀźņØä ņĖĪņĀĢĒĢśļŖö ņ¦ĆĒæ£ļĪ£ņä£ ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ Ļ▓Ćņé¼ņŚÉņä£ ļ»ĖņāØļ¼╝ņØś ļ▓łņŗØņØä ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳ļŖö ĒĢŁņāØņĀ£ņØś ņĄ£ņĀĆ ļåŹļÅäļĪ£ ņĀĢņØśĒĢ£ļŗż[16]. ĻĘĖļ¤¼ļéś H. pyloriņØś ĒĢŁņāØņĀ£ņŚÉ ļīĆĒĢ£ ņĄ£ņåī ņ¢ĄņĀ£ ļåŹļÅäļŖö ļ│┤Ļ│Āņ×ÉņŚÉ ļö░ļØ╝ ļ¦ÄņØĆ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ļŖöļŹ░, ņ¦ĆņŚŁļ¦łļŗż ĻĘĀņŻ╝ņØś ņ░©ņØ┤Ļ░Ć ņĪ┤ņ×¼ĒĢśĻ│Ā ĻĘĀņŻ╝ņØś ļ░░ņ¢æĒĢśļŖö ņĪ░Ļ▒┤ņØ┤ Ļ╣īļŗżļĪ£ņÜĖ ļ┐É ņĢäļŗłļØ╝ Ļ▓Ćņé¼ļ▓ĢņØ┤ ĒåĄņØ╝ļÉśņ¦Ć ņĢŖļŖö ņĀÉņŚÉņä£ ĻĖ░ņØĖĒĢ£ļŗż[22,23]. ņĀĢĒÖĢĒĢ£ ĻĘĀņŻ╝ņØś ļ░░ņ¢æņØä ņ£äĒĢśņŚ¼ Ļ▓Ćņé¼ ņĀä ņĀüņ¢┤ļÅä 2ņŻ╝Ļ░äņØś PPI ļ│ĄņÜ® ļ░Å 4ņŻ╝Ļ░äņØś ĒĢŁņāØņĀ£ ļ│ĄņÜ®ņØ┤ ņĀ£ĒĢ£ļÉśļ®░, ņ▒äņĘ©ĒĢ£ ņĪ░ņ¦üņØĆ Ļ░ĆļŖźĒĢ£ ļ╣Āļź┤Ļ▓ī ņ▓śļ”¼ļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż. ļśÉĒĢ£ ļ░░ņ¢æĻ▓Ćņé¼ļŖö ļ»╝Ļ░ÉļÅäļŖö 73% ņØ┤ĒĢśļĪ£ ļé«ļŗżļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŖö ļ░śļ®┤ clarithromycin ļé┤ņä▒ ņĀäļ░śņØä ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ļŗżļŖö ņןņĀÉņØ┤ ņ׳ļŗż[24,25].
PCR ļ░®ļ▓ĢņØ┤ H. pylori Ļ░ÉņŚ╝ņØä ĒīÉļŗ©ĒĢśļŖö Ļ▓Ćņé¼ļĪ£ņä£ ņÜöņ¢æĻĖēņŚ¼Ļ░Ć ĒÖĢļīĆļÉśļ®┤ņä£ ļ│┤ĒÄĖĒÖöļÉśņŚłļŖöļŹ░, ņØ┤ļĪ£ņŹ© Ļ▓Ćņé¼ņØś ļ»╝Ļ░ÉļÅä ļ░Å ņ¦äļŗ©ņØś ņĀĢĒÖĢļÅäļŖö ļłłļČĆņŗ£Ļ▓ī ņāüņŖ╣ĒĢśņśĆļŗż. ļŹöņÜ▒ņØ┤ clarithromycinņŚÉ ļīĆĒĢ£ ļé┤ņä▒ņØĆ ļīĆļČĆļČä 23S rRNA geneņØś 2142 Ēś╣ņØĆ 2143 ņ£äņ╣śņØś ņĀÉ ļÅīņŚ░ļ│ĆņØ┤ņŚÉ ņØśĒĢśņŚ¼ ņØ╝ņ¢┤ļéśļŖöļŹ░, PCR ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢ£ Ļ▓Ćņé¼ļĪ£ ĒĢŁņāØņĀ£ ļé┤ņä▒ļÅä ņśłņĖĪĒĢĀ ņłś ņ׳Ļ▓ī ļÉśņŚłļŗż. ņŻ╝ļĪ£ ņĀÉ ļÅīņŚ░ļ│ĆņØ┤ņØś ņ£äņ╣śļŖö ņŻ╝ļĪ£ ņŚ╝ĻĖ░ņä£ņŚ┤ 2142ņÖĆ 2143 ņ£äņ╣śņŚÉ adenineņØ┤ guanineņ£╝ļĪ£ ņ╣śĒÖśļÉśļŖö Ļ▓ĮņÜ░(A2142G, A2143G)ņØ┤ļ®░, ļō£ļ¼╝Ļ▓ī 2142 ņ£äņ╣śņŚÉ adenineņØ┤ cytosineņ£╝ļĪ£ ņ╣śĒÖśļÉśļŖö Ļ▓ĮņÜ░(A2142C)ņÖĆ ĻĘĖ ņÖĖņŚÉļÅä A2115G, G2141A, A2142T, T2182Cļź╝ ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż[26,27]. ņ¦ĆņŚŁļ¦łļŗż ļÅīņŚ░ļ│ĆņØ┤ņØś ļČäĒżļŖö ļŗżņåī ņ░©ņØ┤Ļ░Ć ņ׳ļŖöļŹ░, ļ»ĖĻĄŁņŚÉņä£ A2142G, A2143G ļ│ĆņØ┤ļŖö Ļ░üĻ░ü 48~53%ņÖĆ 39~45%ņØ┤ļ®┤ņä£ A2142C ļ│ĆņØ┤ļŖö 0~7%ņØ┤Ļ│Ā, ņ£Āļ¤ĮņØĆ A2142G, A2143G ļ│ĆņØ┤Ļ░Ć Ļ░üĻ░ü 23~33%ņÖĆ 44~67%ņØ┤ļ®┤ņä£ A2142C ļ│ĆņØ┤ļŖö 2~10%ļĪ£ ļ│┤Ļ│ĀĒĢśņŚ¼ ļ»ĖĻĄŁĻ│╝ ņ£Āļ¤ĮņØś clarithromycin ļé┤ņä▒ņØś ņŻ╝ņÜö ļ│ĆņóģņØś ļČäĒżļŖö ņ£Āņé¼ĒĢśļŗż[28-30]. ĒĢśņ¦Ćļ¦ī ņØ╝ļ│ĖņŚÉņä£ļŖö A2143GņØś Ļ▓ĮņÜ░Ļ░Ć 90% ņØ┤ņāüņØ┤ļ®┤ņä£ A2142CļŖö ļ░£Ļ▓¼ļÉśņ¦Ć ņĢŖņĢśĻ│Ā[31,32], ņżæĻĄŁņØś ņŚ░ĻĄ¼ņŚÉņä£ļÅä ļ╣äļĪØ ņĀüņØĆ ņłśņØś ņŚ░ĻĄ¼ņØ┤ņ¦Ćļ¦ī A2143G ļ│ĆņØ┤Ļ░Ć Ļ▒░ņØś 100%ļØ╝Ļ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[33]. ĒÖŹņĮ®ņŚÉņä£ļŖö A2144G ļ│ĆņØ┤ ļ╣łļÅäĻ░Ć ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳Ļ│Ā[34], ĒĢ£ĻĄŁņØĆ 2004ļģä clarithromycin ļé┤ņä▒ņØĖ 10ĻĘĀņŻ╝ ņżæ 7ĻĘĀņŻ╝ņŚÉņä£ A2143G ļ│ĆņØ┤ļź╝ ļ│┤Ļ│ĀĒĢśņśĆļŖöļŹ░[16], 2005ļģäņŚÉ ņŗżņŗ£ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö clarithromycin ļé┤ņä▒ņØ┤ 20.2%ņØ┤ļ®┤ņä£ ļīĆļČĆļČäņØ┤ A2142GļØ╝Ļ│Ā ĒĢśņŚ¼ ņØ┤ņĀä Ļ▓░Ļ│╝ņÖĆļŖö ļŗżņåī ļŗżļź┤Ļ▓ī ļ│┤Ļ│ĀĒĢśņśĆļŗż[35]. ĻĘĖļ¤¼ļéś ņØ┤Ēøä ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ļīĆļČĆļČäņØś clarithromycin ļé┤ņä▒ņØĆ ļīĆļČĆļČäņØ┤ A2143G ļ│ĆņØ┤ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż[36-38]. ņØ┤ļ¤¼ĒĢ£ PCR ļ░®ļ▓ĢņØĆ 82~90% ņØ┤ņāüņ£╝ļĪ£ ņāüļīĆņĀüņ£╝ļĪ£ ļåÆņØĆ ļ»╝Ļ░ÉļÅä ļ░Å 95% ņØ┤ņāüņØś ĒŖ╣ņØ┤ļÅäļź╝ ļéśĒāĆļé┤ļŖö ņÜ░ņłśņä▒ņØ┤ ņ׳ļŖö Ļ▓Ćņé¼ņØ┤Ļ│Ā[39-41], ļŹöĻĄ░ļŗżļéś ļ░░ņ¢æĻ▓Ćņé¼ņŚÉņä£ ņĀ£ĒĢ£ļÉśļŖö clarithromycinņÖĆ quinoloneņØś ļÅÖņŗ£ ļé┤ņä▒ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŖö ņןņĀÉņØ┤ ņ׳ļŗż[42].
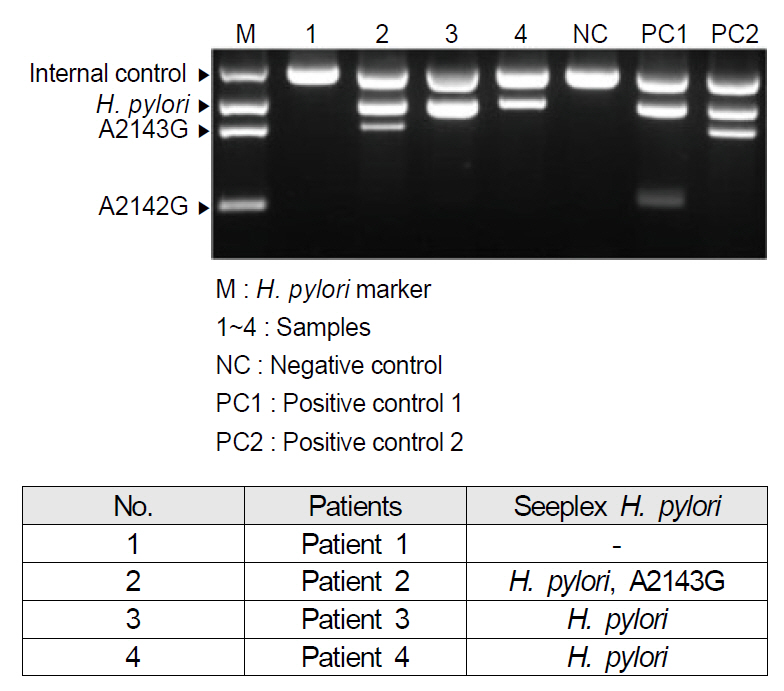
ĻĘĖļ¤¼ļéś ĻĖ░ļīĆņÖĆļŖö ļŗ¼ļ”¼ ņ£äņ¢æņä▒ ļ░Å ņ£äņØīņä▒ļźĀņØ┤ ļŗżņåī ĻĖ░ļīĆņŚÉ ļ»Ėņ╣śņ¦Ć ļ¬╗ĒĢśĻ│Ā ļśÉĒĢ£ ĒśäņŗżņĀüņ£╝ļĪ£ Ļ▓Ćņé¼ņØś ļ▓łĻ▒░ļĪ£ņøĆĻ│╝ Ļ│ĀĻ░ĆņØś ņןļ╣ä ĻĘĖļ”¼Ļ│Ā Ļ▓Ćņé¼ ņØĖļĀźņØä ņČöĻ░ĆļĪ£ ĒĢäņÜöĒĢśĻ▓ī ĒĢśņŚ¼ ļīĆĒśĢ ļ│æņøÉņØ┤ ņĢäļŗłļ®┤ Ļ░ÉĒ׳ Ļ▓Ćņé¼ļź╝ ĒĢśĻĖ░ ĒלļōĀ ņŗżņĀĢņØ┤ņŚłļŗż. ņØ┤ņÖĖņŚÉļÅä MutaREAL H. pylori kit, ClariRes realtime PCR assay, Seeplex ClaR-H. pylori ACE detection system ļō▒ņØ┤ clarithromycin ļé┤ņä▒ ņ¦äļŗ©ņØä ņ£äĒĢśņŚ¼ Ļ│ĀņĢłļÉśņŚłņ£╝ļ®░[43], ĒŖ╣Ē׳ ņĄ£ĻĘ╝ņŚÉ ņåīĻ░£ļÉ£ DPO-based multiplex PCR (Seegene Inc., Seoul, Korea)ņØĆ ĻĖ░ņĪ┤ņØś PCR Ļ▓Ćņé¼ņŚÉ ļ╣äĒĢśņŚ¼ polydeoxynosine linkerļĪ£ ņŚ░Ļ▓░ļÉ£ ĻĖĖņØ┤Ļ░Ć ļŗżļźĖ ļæÉ Ļ░£ņØś primerļź╝ ņé¼ņÜ®ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ļ╣äĒŖ╣ņØ┤ņĀüņØĖ PCR ņé░ļ¼╝ņØä ņāØņä▒ĒĢśņ¦Ć ņĢŖņĢä ĻĖ░ņĪ┤ PCRļ│┤ļŗż ņ£äņ¢æņä▒ļźĀņØä ļé«ņČöņŚłļŗż[38,44]. ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ DPO-PCRņØś ļ»╝Ļ░ÉļÅäņÖĆ ĒŖ╣ņØ┤ļÅäļŖö Ļ░üĻ░ü 87.5%, 91.3%ņśĆĻ│Ā ņ¢æņä▒ ņśłņĖĪļźĀ ļ░Å ņØīņä▒ ņśłņĖĪļźĀ, ņĀĢĒÖĢļÅäļŖö Ļ░üĻ░ü 84.0%, 93.3%, 90.0%ņśĆļŗż[45]. ļśÉĒĢ£ ĻĘ£Ļ▓®ĒÖöļÉśņ¢┤ Ļ▓Ćņé¼ļź╝ Ļ░äļŗ©ĒĢśĻ▓ī ĒĢśņśĆĻ│Ā Ļ▓Ćņé¼ļ╣äņÜ®ņØś ņĀłĻ░ÉņØä Ļ░ĆņĀĖņśżĻ▓ī ĒĢśņśĆļŗż. DPO-PCRņŚÉņä£ļŖö ņ¦äļŗ©ļ┐Éļ¦ī ņĢäļŗłļØ╝ clarithromycin ļé┤ņä▒ļÅä ļŹöļČłņ¢┤ ĒīīņĢģĒĢĀ ņłś ņ׳Ļ▓ī ņäżĻ│äļÉśņ¢┤ ņ׳ļŖöļŹ░, clarithromycin ļé┤ņä▒ņØś 80% ņØ┤ņāüņØä ņ░©ņ¦ĆĒĢśņŚ¼ ņŻ╝ņÜö ņøÉņØĖņ£╝ļĪ£ ņĢīļĀżņ¦ä A2142GņÖĆ A2143G ļ│ĆņØ┤ļź╝ ņĖĪņĀĢĒĢĀ ņłś ņ׳Ļ▓ī Ļ│ĀņĢłļÉśņŚłļŗż[46,47]. PCR ņé░ļ¼╝Ļ│╝ ClaR-HP markerļź╝ Ļ░üĻ░ü ņĀäĻĖ░ ņśüļÅÖĒĢ£ Ēøä ņ×ÉņÖĖņäĀ Ēł¼Ļ│╝ ņĪ░ļ¬ģĻĖ░ņŚÉņä£ ņ”ØĒÅŁļÉ£ ņ£ĀņĀäņ×Éļź╝ ĒÖĢņØĖĒĢ©ņ£╝ļĪ£ņŹ© ļé┤ņä▒ņØä ņśłņāüĒĢśĻ▓ī ļÉśļŖöļŹ░, ņ”ØĒÅŁļÉ£ DNA ņé░ļ¼╝ņŚÉņä£ 621 bp ņé░ļ¼╝ļ¦ī Ļ┤Ćņ░░ļÉśļ®┤ H. pylori wild-typeņ£╝ļĪ£ Ļ░ÉņŚ╝ņØä ņ¦äļŗ©ĒĢśĻ│Ā, 475 bpĻ░Ć ĒĢ©Ļ╗ś Ļ┤Ćņ░░ļÉśļ®┤ A2143G ļ│ĆņØ┤ĒśĢ, 194 bpĻ░Ć ĒĢ©Ļ╗ś Ļ┤Ćņ░░ļÉśļ®┤ A2142G ļ│ĆņØ┤ĒśĢņ£╝ļĪ£ ĒĢ┤ņäØĒĢĀ ņłś ņ׳ļŗż(Fig. 2).
ļśÉĒĢ£ ļö░ļĪ£ Ļ▓Ćņ▓┤ļź╝ ņĪ░ņ¦üĻ▓Ćņé¼ļź╝ ĒåĄĒĢśņŚ¼ ņĀ£Ļ│ĄĒĢĀ ĒĢäņÜöĻ░Ć ņŚåĻ│Ā, ņŗĀņåŹ ņÜöņåīļČäĒĢ┤ĒÜ©ņåī Ļ▓Ćņé¼(rapid urease test) kitņŚÉ ļŗ┤Ļ▓© ņ׳ļŖö ņĪ░ņ¦üņØä ĻĘĖļīĆļĪ£ Ļ▓Ćņé¼ņŗżņŚÉ ļ│┤ļāäņ£╝ļĪ£ņŹ© ļ▓łĻ▒░ļĪ£ņøĆņØä ļŹ£Ļ▓ī ņäżĻ│äļÉśņŚłļŗż[38,48]. DPO-PCRņØĆ ņŗĀņåŹ ņÜöņåīļČäĒĢ┤ĒÜ©ņåī Ļ▓Ćņé¼ ņØīņä▒ņØś ņĪ░ņ¦üņŚÉņä£ļÅä Ļ▓ĆņČ£ļÉśĻĖ░ļÅä ĒĢśņŚ¼ ņ£äņØīņä▒ņØä ņżäņØ┤Ļ│Ā ņ×¼ņĪ░ņ¦üĻ▓Ćņé¼ņØś ĒĢäņÜöņä▒ņØä Ļ░Éņåīņŗ£ņ╝░ļŗż. Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ DPO-PCR testļŖö ņ¦äļŗ©ļ┐É ņĢäļŗłļØ╝ H. pylori 23S rRNA geneņŚÉņä£ņØś ļ│ĆņØ┤ļź╝ ļ╣Āļź┤Ļ▓ī sequencingĒĢ©ņ£╝ļĪ£ņŹ© ĒÖśņ×ÉņØś ņØ╝ņ░© ņ╣śļŻī ņĢĮņĀ£ļź╝ ņäĀĒāØĒĢśļŖöļŹ░ ļÅäņøĆņØä ņŻ╝Ļ▓ī ļÉ£ļŗż.
ClarithromycinņŚÉ ļīĆĒĢ£ ļåÆņØĆ ņłśņżĆņØś ļé┤ņä▒ņØĖ Ļ▓ĮņÜ░ļŖö H. pylori Ļ░ÉņŚ╝ņØä ņ╣śļŻīĒĢśĻ│Ā ņ¢ĄņĀ£ĒĢśļŖö ļäōņØĆ ņØśļ»ĖņØś ņāłļĪ£ņÜ┤ ņ╣śļŻīļ▓ĢņØä ņ░ŠņĢäļé┤ļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļŗż. Maastricht V/Florence ņ¦äļŻīņ¦Ćņ╣©ņŚÉņä£ļŖö clarithromycin ļé┤ņä▒ļźĀņØ┤ 15% ņØ┤ņāüņ£╝ļĪ£ ļåÆņØĆ ņ¦ĆņŚŁņŚÉņä£ļŖö bismuth ņé¼ņĀ£ņÜöļ▓ĢņØ┤ļéś ļÅÖņŗ£ ņ╣śļŻīļ▓ĢņØä ņäĀĒāØĒĢĀ Ļ▓āņØä ņČöņ▓£ĒĢśĻ│Ā ņ׳ļŖöļŹ░[49], ņĄ£ĻĘ╝ ņÜ░ļ”¼ļéśļØ╝ņØś clarithromycin ļé┤ņä▒ņØ┤ ņĢĮ 30%ļØ╝ļŖö ļ│┤Ļ│Āļź╝ ņ░ĖĻ│ĀĒĢ£ļŗżļ®┤[50] clarithromycinņØä ĻĖ░ļ│Ėņ£╝ļĪ£ ĒĢ£ ĻĖ░ņĪ┤ņØś ņé╝ņĀ£ņÜöļ▓ĢņØä ņØ╝ņ░© ņ╣śļŻīļĪ£ ņ£Āņ¦ĆĒĢśĻĖ░ļ│┤ļŗżļŖö ĒĢŁņāØņĀ£ Ļ░Éņłśņä▒ Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļź╝ ĒåĀļīĆļĪ£ ĒĢ£ ņ╣śļŻī Ļ│äĒÜŹ ņłśļ”ĮņØ┤ ĒĢäņÜöĒĢśļŗż.
ņĄ£ĻĘ╝ ĻĄŁļé┤ņØś ļ│┤Ļ│ĀņŚÉ ļö░ļź┤ļ®┤ ņĀ£ĻĘĀ ņĀä DPO-PCR Ļ▓Ćņé¼ļź╝ ĒåĄĒĢśņŚ¼ clarithromycin ļé┤ņä▒ņŚÉ ļīĆĒĢ£ ņĀÉ ļÅīņŚ░ļ│ĆņØ┤ļź╝ ļ»Ėļ”¼ ņĢīĻ│Ā ļ¦×ņČżņĀ£ĻĘĀņØä ĒĢśņśĆņØä ļĢī, per-protocol ļČäņäØ Ļ▓░Ļ│╝ 91.0%ņØś ņĀ£ĻĘĀ ņä▒Ļ│ĄļźĀņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż[51]. ĒĢśņ¦Ćļ¦ī Ēśäņ×¼Ļ╣īņ¦Ć ĻĄŁļé┤ņŚÉņä£ clarithromycin ļé┤ņä▒ņØ┤ ĒÖĢņØĖļÉ£ ĒÖśņ×ÉņŚÉņä£ ņØ╝ņ░© ņ╣śļŻī ņĢĮņĀ£ņŚÉ ļīĆĒĢ£ Ēæ£ņżĆ Ļ░ĆņØ┤ļō£ļØ╝ņØĖņØĆ ņĀĢļ”ĮļÉśņ¦Ć ņĢŖņĢśļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ļŖö ņĀ£ĻĘĀ ņĀä clarithromycin ļé┤ņä▒ņØä ĒÖĢņØĖĒĢ£ Ļ▓ĮņÜ░ņŚÉ ņäĀĒāØĒĢĀ ņłś ņ׳ļŖö ņĢĮņĀ£ļŖö metronidazoleņØä ĻĘ╝Ļ░äņ£╝ļĪ£ ĒĢśļŖö ņé╝ņĀ£ņÜöļ▓ĢņØä ņäĀĒāØĒĢĀ ņłś ņ׳ņ£╝ļéś ļÅÖņŗ£ņŚÉ ņĪ┤ņ×¼ĒĢĀ ņłś ņ׳ļŖö ļŗżņĀ£ ļé┤ņä▒ ĻĘĀņŻ╝, ĒŖ╣Ē׳ metronidazoleņØś ļé┤ņä▒ņØä ļÅÖņŗ£ņŚÉ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć ļåÆņØĆ ņ¦ĆņŚŁņŚÉņä£ļŖö 14ņØ╝ ļÅÖņĢłņØś bismuthļź╝ ĻĘ╝Ļ░äņ£╝ļĪ£ ĒĢśļŖö Ļ│ĀņĀäņĀüņØĖ ņé¼ņĀ£ņÜöļ▓ĢņØä ņØ╝ņ░© ņĀ£ĻĘĀ ņÜöļ▓Ģņ£╝ļĪ£ ņäĀĒāØĒĢĀ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņØ┤ ņÜöļ▓ĢņØĆ ļ│ĄņÜ®ļ▓ĢņØ┤ ļ│Ąņ×ĪĒĢĀ ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņĢĮņĀ£ ļČĆņ×æņÜ®ļÅä ļ¦ÄņĢäņä£ ĒÖśņ×ÉņØś ņł£ņØæļÅäĻ░Ć ļé«ļŗżļŖö ļŗ©ņĀÉņØ┤ ņ׳Ļ│Ā, ņØ╝ņ░© ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ņŗżĒī©ĒĢśņśĆņØä ļĢīņŚÉ ņØ┤ņ░© ņ╣śļŻī ņĢĮņĀ£ļź╝ ņäĀņĀĢĒĢśļŖö ļŹ░ ņ¢┤ļĀżņøĆņØ┤ ņ׳ļŗż. ĻĄŁļé┤ņØś ņŚ░ĻĄ¼ņŚÉņä£ clarithromycin ļé┤ņä▒ņØ┤ ĒÖĢņØĖļÉ£ ņØ╝ņ░© ņ╣śļŻīļĪ£ metronidazole ĒżĒĢ© ņé╝ņĀ£ņÜöļ▓ĢņØĆ ĻĖ░ņĪ┤ņØś bismuth ĒżĒĢ© ņé¼ņĀ£ņÜöļ▓ĢņŚÉ ļ╣äĒĢśņŚ¼ ņĀ£ĻĘĀņŚÉņä£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ░©ņØ┤Ļ░Ć ņŚåĻ│Ā ļČĆņ×æņÜ® ņĖĪļ®┤ņŚÉņä£ļÅä ņÜ░ņøöĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[52]. ĻĘĖļ¤¼ļéś ņØ┤ņŚÉ ļīĆĒĢ┤ņä£ļŖö Ē¢źĒøä ņČöĻ░ĆņĀüņØĖ ļīĆĻĘ£ļ¬© ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļ®░ ĒĢÖĒÜī ņ░©ņøÉņŚÉņä£ ņ¢┤ļ¢ż ņĢĮņĀ£ņØś ņĪ░ĒĢ®ņØä ņé¼ņÜ®ĒĢĀ Ļ▓āņØĖĻ░ĆņŚÉ ļīĆĒĢ£ ĻĄ¼ņ▓┤ņĀüņØĖ Ļ░ĆņØ┤ļō£ļØ╝ņØĖņØä ņĀ£ņŗ£ĒĢĀ ĒĢäņÜöĻ░Ć ņ׳Ļ▓Āļŗż.
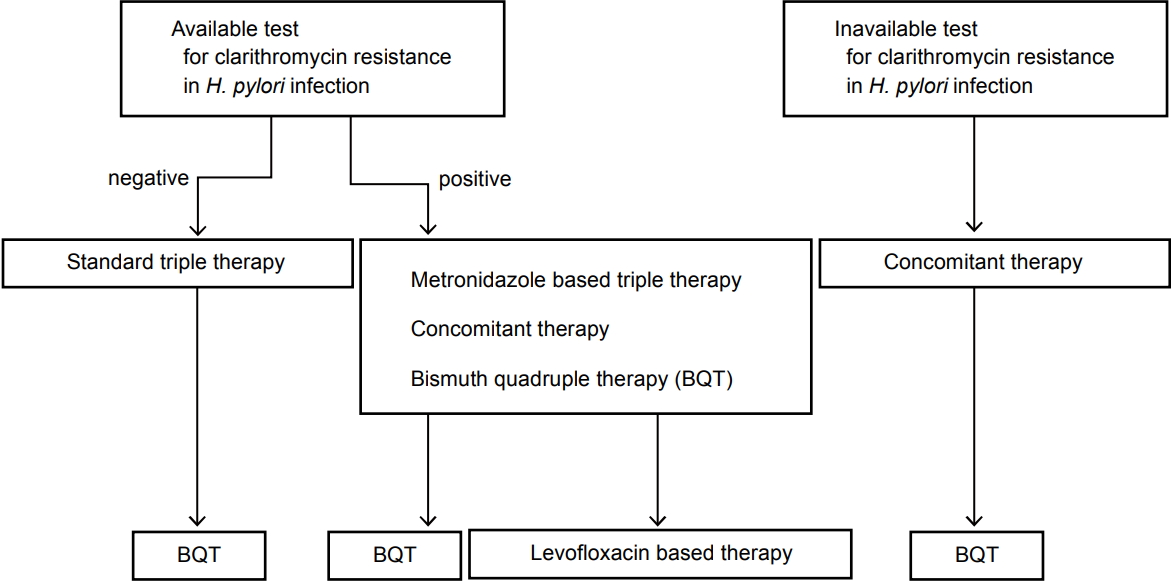
ļÅÖņŗ£ ņ╣śļŻīļŖö PPI, amoxicillin, clarithromycinĻ│╝ metronidazoleņØś 4Ļ░Ćņ¦Ć ņĢĮņĀ£ļź╝ ļÅÖņŗ£ņŚÉ Ēł¼ņĢĮĒĢśļŖö ļ░®ļ▓Ģņ£╝ļĪ£ņä£, Maastricht V/Florence ņ¦äļŻīņ¦Ćņ╣© ļ░Å Toronto ņ¦Ćņ╣©, ļ»ĖĻĄŁ ņåīĒÖöĻĖ░ĒĢÖĒÜī Ļ░ĆņØ┤ļō£ļØ╝ņØĖ ļō▒ņŚÉ ļö░ļź┤ļ®┤ ņØ╝ņ░© ņ╣śļŻīļĪ£ņä£ ņÜ░ņłśĒĢśĻ│Ā, ĒŖ╣Ē׳ clarithromycin ļé┤ņä▒ļźĀņØ┤ ļåÆņØĆ ņ¦ĆņŚŁņŚÉņä£ ņČöņ▓£ļÉĀ ļ¦īĒĢ£ ņ╣śļŻīļĪ£ ņĢīļĀżņĀĖ ņ׳ņ¢┤ņä£ Ļ│ĀļĀżĒĢĀ ņłś ņ׳ļŖö ņ╣śļŻīļ▓ĢņØ┤ļŗż[53-55]. ņØ╝ņ░© ņ╣śļŻīļĪ£ ņä▒Ļ│ĄņĀüņØĖ ņĀ£ĻĘĀ ņ╣śļŻīĻ░Ć ļÉśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ ņØ┤ņ░© ņ╣śļŻīļĪ£ņä£ bismuth ņé¼ņĀ£ņÜöļ▓Ģ ļ░Å levofloxacin ĻĖ░ļ░śņØś ņé╝ņĀ£ņÜöļ▓ĢņØ┤ Ļ│ĀļĀżļÉĀ ņłś ņ׳ņ£╝ļ®░, ļ╣ĀļźĖ ņŗ£Ļ░ä ļé┤ņŚÉ levofloxacin ĻĖ░ļ░śņØś ņé╝ņĀ£ņÜöļ▓ĢņØ┤ ņé╝ņ░© ņĀ£ĻĘĀ ņÜöļ▓Ģņ£╝ļĪ£ ĻĄŁļé┤ņØś ņÜöņ¢æĻĖēņŚ¼ Ļ│Āņŗ£ņŚÉ ĒżĒĢ©ļÉśņ¢┤ņĢ╝ ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż(Fig. 3) [53-55].
ĻĄŁļé┤ņŚÉņä£ H. pylori ĻĘĀņØś ņĀ£ĻĘĀņ£©ņØ┤ Ļ░ÉņåīĒĢśļŖö ņżæņÜöĒĢ£ ņøÉņØĖņ£╝ļĪ£ clarithromycinņŚÉ ļé┤ņä▒ ņ”ØĻ░Ćļź╝ ņāØĻ░üĒĢĀ ņłś ņ׳ļŗż. ĻĖ░ņĪ┤ņØś ļ░░ņ¢æĻ▓Ćņé¼ļŖö Ļ╣īļŗżļĪ£ņÜ┤ ņĪ░Ļ▒┤Ļ│╝ ņŚ░ĻĄ¼ņ×Éļ¦łļŗż ļŗżļźĖ Ļ▓░Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢśņŚ¼ ņ×äņāüņŚÉ ņĀüņÜ®ĒĢśĻĖ░ ņ¢┤ļĀżņÜ┤ ļ®┤ņØ┤ ņ׳ņŚłĻ│Ā, ļ░śļ®┤ PCR Ļ▓Ćņé¼ļŖö ļ▓łĻ▒░ļĪ£ņÜ┤ ļ®┤ņØ┤ ņ׳ņŚłļŗż. ņĄ£ĻĘ╝ DPO-PCR Ļ▓Ćņé¼ļŖö ņŚ¼ļ¤¼ ļ▓łņØś Ļ▓Ćņé¼ļź╝ ĒĢ┤ņĢ╝ĒĢĀ ĒĢäņÜöļź╝ ņżäņ×äņ£╝ļĪ£ņŹ© ņŗ£Ļ░äĻ│╝ ļ╣äņÜ®ņØä ļŗ©ņČĢĒĢĀ ņłś ņ׳Ļ▓ī ļÉśņŚłĻ│Ā, ļŹöņÜ▒ņØ┤ ņŗĀņåŹ ņÜöņåīļČäĒĢ┤ĒÜ©ņåī Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ£ DPO-PCR testļŖö PCRņØś ļČłĒÄĖĒĢ©ļÅä ĒĢ┤Ļ▓░ĒĢ┤ ņŻ╝ņŚłļŗż. ĒĢśņ¦Ćļ¦ī ņØ┤ļ¤¼ĒĢ£ ņŗ£ņŖżĒģ£ņØä ĒåĄĒĢśņŚ¼ clarithromycin ļé┤ņä▒ņØä ņÖäņĀäĒ׳ ļŗż ĒīīņĢģĒĢĀ ņłś ņ׳ļŖöĻ░ĆņŚÉ ļīĆĒĢ£ ņØśļ¼ĖņØä Ļ░Ćņ¦ł ņłś ņ׳Ļ│Ā, ņ¢┤ļ¢ż ĒÜ©Ļ│╝ņĀüņØĖ ņĢĮņĀ£ļź╝ ņäĀĒāØĒĢ┤ņĢ╝ ĒĢśļŖöĻ░ĆņŚÉ ļīĆĒĢ£ ļ¼ĖņĀ£ļŖö ņŚ¼ņĀäĒ׳ ļé©ņĢä ņ׳ļŗż. Ē¢źĒøä ņØ┤ļ¤░ ņĀÉļōżņØä ļ│┤ņÖäĒĢśņŚ¼ ņĀ£ĻĘĀ ņĀä ņØ┤ļ¤¼ĒĢ£ ņŗ£ņŖżĒģ£ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĀüņĀłĒĢ£ ņĀ£ĻĘĀ ņÜöļ▓ĢņØä ņäĀĒāØĒĢĀ ņłś ņ׳Ļ▓ī ĒĢśņŚ¼ ņØ┤ņāüņĀüņØĖ ņĀ£ĻĘĀņ£©ņØä ņØ┤ļŻ░ ņłś ņ׳ņ¢┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż.
Fig.┬Ā1.
Mutations arising in domain V of H. pylori 23S rRNA. H. pylori, Helicobacter pylori; rRNA, ribosomal RNA.
REFERENCES
1. Stanghellini V, Chan FK, Hasler WL, et al. Gastroduodenal disorders. Gastroenterology 2016;150:1380ŌĆō1392.


2. Sugano K, Tack J, Kuipers EJ, et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut 2015;64:1353ŌĆō1367.



3. Ahn JY, Jung HY. Current status of second-line and third-line therapy for Helicobacter pylori eradication in Korea. Korean J Helicobacter Up Gastrointest Res 2010;10:1ŌĆō5.
4. Marin AC, McNicholl AG, Gisbert JP. A review of rescue regimens after clarithromycin-containing triple therapy failure (for Helicobacter pylori eradication). Expert Opin Pharmacother 2013;14:843ŌĆō861.


5. Song M, Ang TL. Second and third line treatment options for Helicobacter pylori eradication. World J Gastroenterol 2014;20:1517ŌĆō1528.



6. Byun YH, Jo YJ, Kim SC, et al. Clinical factors that predicts successful eradication of Helicobacter pylori. Korean J Gastroenterol 2006;48:172ŌĆō179.

7. Nam TM, Lee DH, Kang KP, et al. Clinical factors that potentially affect the treatment outcome of Helicobacter pylori eradication therapy with using a standard triple regimen in peptic ulcer patients. Korean J Gastrointest Endosc 2008;36:200ŌĆō205.
8. Lam SK, Talley NJ. Report of the 1997 Asia Pacific consensus conference on the management of Helicobacter pylori infection. J Gastroenterol Hepatol 1998;13:1ŌĆō12.


9. Liou JM, Chang CY, Chen MJ, et al. The primary resistance of Helicobacter pylori in Taiwan after the national policy to restrict antibiotic consumption and its relation to virulence factors-a nationwide study. PLoS One 2015;10:e0124199.



10. Eun CS, Han DS, Park JY, et al. Changing pattern of antimicrobial resistance of Helicobacter pylori in Korean patients with peptic ulcer diseases. J Gastroenterol 2003;38:436ŌĆō441.



11. Bang SY, Han DS, Eun CS, et al. Changing patterns of antibiotic resistance of Helicobacter pylori in patients with peptic ulcer disease. Korean J Gastroenterol 2007;50:356ŌĆō362.

12. Kim JM, Kim JS, Jung HC, Kim N, Kim YJ, Song IS. Distribution of antibiotic MICs for Helicobacter pylori strains over a 16-year period in patients from Seoul, South Korea. Antimicrob Agents Chemother 2004;48:4843ŌĆō4847.



13. Hwang TJ, Kim N, Kim HB, et al. Change in antibiotic resistance of Helicobacter pylori strains and the effect of A2143G point mutation of 23S rRNA on the eradication of H. pylori in a single center of Korea. J Clin Gastroenterol 2010;44:536ŌĆō543.


14. Kim JY, Kim NY, Kim SJ, et al. Regional difference of antibiotic resistance of Helicobacter pylori strains in Korea. Korean J Gastroenterol 2011;57:221ŌĆō229.


15. Kim N, Kim JM, Kim CH, et al. Institutional difference of antibiotic resistance of Helicobacter pylori strains in Korea. J Clin Gastroenterol 2006;40:683ŌĆō687.


16. Kim JM, Kim JS, Jung HC, Kim N, Song IS. Antibiotic resistance of Helicobacter pylori isolated from Korean patients in 2003. Korean J Gastroenterol 2004;44:126ŌĆō135.

17. An B, Moon BS, Kim H, et al. Antibiotic resistance in Helicobacter pylori strains and its effect on H. pylori eradication rates in a single center in Korea. Ann Lab Med 2013;33:415ŌĆō419.



18. Versalovic J, Shortridge D, Kibler K, et al. Mutations in 23S rRNA are associated with clarithromycin resistance in Helicobacter pylori. Antimicrob Agents Chemother 1996;40:477ŌĆō480.



19. Webber MA, Piddock LJ. The importance of efflux pumps in bacterial antibiotic resistance. J Antimicrob Chemother 2003;51:9ŌĆō11.



20. Murakami K, Fujioka T, Okimoto T, Sato R, Kodama M, Nasu M. Drug combinations with amoxycillin reduce selection of clarithromycin resistance during Helicobacter pylori eradication therapy. Int J Antimicrob Agents 2002;19:67ŌĆō70.


21. So S, Ahn JY, Na HK, et al. Efficacy of ecabet sodium for Helicobacter pylori eradication with sequential therapy. Korean J Helicobacter Up Gastrointest Res 2018;18:180ŌĆō185.

22. Kim JG, Kim BJ. Antibiotic resistance in Helicobacter pylori infection. Korean J Helicobacter Up Gastrointest Res 2011;11:13ŌĆō20.

23. Gong EJ, Ahn JY. Antimicrobial resistance of Helicobacter pylori isolates in Korea. Korean J Helicobacter Up Gastrointest Res 2018;18:82ŌĆō88.

24. Zullo A, Hassan C, Lorenzetti R, Winn S, Morini S. A clinical practice viewpoint: to culture or not to culture Helicobacter pylori? Dig Liver Dis 2003;35:357ŌĆō361.


25. McNulty CA, Lasseter G, Shaw I, et al. Is Helicobacter pylori antibiotic resistance surveillance needed and how can it be delivered? Aliment Pharmacol Ther 2012;35:1221ŌĆō1230.


26. M├®graud F. H pylori antibiotic resistance: prevalence, importance, and advances in testing. Gut 2004;53:1374ŌĆō1384.



27. Hult├®n K, Gibreel A, Sk├Čld O, Engstrand L. Macrolide resistance in Helicobacter pylori : mechanism and stability in strains from clarithromycin-treated patients. Antimicrob Agents Chemother 1997;41:2550ŌĆō2553.



28. Stone GG, Shortridge D, Versalovic J, et al. A PCR-oligonucleotide ligation assay to determine the prevalence of 23S rRNA gene mutations in clarithromycin-resistant Helicobacter pylori. Antimicrob Agents Chemother 1997;41:712ŌĆō714.



29. Alarc├│n T, Domingo D, Prieto N, L├│pez-Brea M. Clarithromycin resistance stability in Helicobacter pylori : influence of the MIC and type of mutation in the 23S rRNA. J Antimicrob Chemother 2000;46:613ŌĆō616.



30. van Doorn LJ, Glupczynski Y, Kusters JG, et al. Accurate prediction of macrolide resistance in Helicobacter pylori by a PCR line probe assay for detection of mutations in the 23S rRNA gene: multicenter validation study. Antimicrob Agents Chemother 2001;45:1500ŌĆō1504.



31. Maeda S, Yoshida H, Matsunaga H, et al. Detection of clarithromycin-resistant Helicobacter pylori strains by a preferential homoduplex formation assay. J Clin Microbiol 2000;38:210ŌĆō214.




32. Kato S, Fujimura S, Udagawa H, et al. Antibiotic resistance of Helicobacter pylori strains in Japanese children. J Clin Microbiol 2002;40:649ŌĆō653.



33. Pan ZJ, Su WW, Tytgat GN, Dankert J, van der Ende A. Assessment of clarithromycin-resistant Helicobacter pylori among patients in Shanghai and Guangzhou, China, by primer-mismatch PCR. J Clin Microbiol 2002;40:259ŌĆō261.



34. Wang WH, Wong BC, Mukhopadhyay AK, et al. High prevalence of Helicobacter pylori infection with dual resistance to metronidazole and clarithromycin in Hong Kong. Aliment Pharmacol Ther 2000;14:901ŌĆō910.


35. Lee JH, Shin JH, Roe IH, et al. Impact of clarithromycin resistance on eradication of Helicobacter pylori in infected adults. Antimicrob Agents Chemother 2005;49:1600ŌĆō1603.



36. An B, Moon BS, Kim H, et al. Antibiotic resistance in Helicobacter pylori strains and its effect on H. pylori eradication rates in a single center in Korea. Ann Lab Med 2013;33:415ŌĆō419.



37. Lee JH, Sung IK, Kim JH, et al. Impact of clarithromycin resistance on the outcome of standard triple Helicobacter pylori eradication therapy. Korean J Helicobacter Up Gastrointest Res 2010;10:14ŌĆō20.
38. Chung WC, Jung SH, Oh JH, et al. Dual-priming oligonucleotide-based multiplex PCR using tissue samples in rapid urease test in the detection of Helicobacter pylori infection. World J Gastroenterol 2014;20:6547ŌĆō6553.



39. Schabereiter-Gurtner C, Hirschl AM, Dragosics B, et al. Novel real-time PCR assay for detection of Helicobacter pylori infection and simultaneous clarithromycin susceptibility testing of stool and biopsy specimens. J Clin Microbiol 2004;42:4512ŌĆō4518.



40. Agudo S, Alarc├│n T, Urruzuno P, Mart├Łnez MJ, L├│pez-Brea M. Detection of Helicobacter pylori and clarithromycin resistance in gastric biopsies of pediatric patients by using a commercially available real-time polymerase chain reaction after NucliSens semiautomated DNA extraction. Diagn Microbiol Infect Dis 2010;67:213ŌĆō219.


41. V├®csei A, Innerhofer A, Binder C, et al. Stool polymerase chain reaction for Helicobacter pylori detection and clarithromycin susceptibility testing in children. Clin Gastroenterol Hepatol 2010;8:309ŌĆō312.


42. Malfertheiner P, Megraud F, O'Morain CA, et al. Management of Helicobacter pylori infection--the Maastricht IV/Florence consensus report. Gut 2012;61:646ŌĆō664.


43. Smith SM, O'Morain C, McNamara D. Antimicrobial susceptibility testing for Helicobacter pylori in times of increasing antibiotic resistance. World J Gastroenterol 2014;20:9912ŌĆō9921.



44. Shin SY, Kwon KC, Park JW, Kim JM, Shin SY, Koo SH. Evaluation of the Seeplex┬« Meningitis ACE Detection kit for the detection of 12 common bacterial and viral pathogens of acute meningitis. Ann Lab Med 2012;32:44ŌĆō49.


45. Lee HJ, Kim JI, Cheung DY, et al. Eradication of Helicobacter pylori according to 23S ribosomal RNA point mutations associated with clarithromycin resistance. J Infect Dis 2013;208:1123ŌĆō1130.



46. Kargar M, Ghorbani-Dalini S, Doosti A, Souod N. Real-time PCR for Helicobacter pylori quantification and detection of clarithromycin resistance in gastric tissue from patients with gastrointestinal disorders. Res Microbiol 2012;163:109ŌĆō113.


47. Kuo CH, Kuo FC, Hu HM, et al. The optimal first-line therapy of Helicobacter pylori infection in year 2012. Gastroenterol Res Pract 2012;2012:168361.




48. Chung WC, Jeon EJ, Oh JH, et al. Dual-priming oligonucleotide-based multiplex PCR using tissue samples from the rapid urease test kit for the detection of Helicobacter pylori in bleeding peptic ulcers. Dig Liver Dis 2016;48:899ŌĆō903.


49. Malfertheiner P, Megraud F, O'Morain CA, et al. Management of Helicobacter pylori infection-the Maastricht V/Florence consensus report. Gut 2017;66:6ŌĆō30.


50. Hwang TJ, Kim N, Kim HB, et al. Change in antibiotic resistance of Helicobacter pylori strains and the effect of A2143G point mutation of 23S rRNA on the eradication of H. pylori in a single center of Korea. J Clin Gastroenterol 2010;44:536ŌĆō543.


51. Jung YD, Kim YJ, Chung WC, et al. A pilot study of Helicobacter pylori eradication using a polymerase chain reaction-based test for clarithromycin resistance. Korean J Helicobacter Up Gastrointest Res 2017;17:200ŌĆō207.

52. Seo MW, Jeong YJ, Kim JS, Kim BW. Optimal first-line eradication regimens for Helicobacter pylori infection in patients with clarithromycin resistance: a pilot study. Korean J Helicobacter Up Gastrointest Res 2018;18:242ŌĆō246.

53. Fallone CA, Chiba N, van Zanten SV, et al. The Toronto consensus for the treatment of Helicobacter pylori infection in adults. Gastroenterology 2016;151:51ŌĆō69; e14.


-
METRICS

-
- 6 Crossref
- 9,428 View
- 406 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Vonoprazan-based Dual and Triple Therapy for Helicobacter pylori Eradication2023 September;23(3)
Antibiotic Resistance and Helicobacter pylori Eradication Therapy2023 September;23(3)