위축성 위염과 장상피화생에서 헬리코박터 파일로리 제균 치료의 의의
Significance of Helicobacter pylori Eradication on Atrophic Gastritis and Intestinal Metaplasia
Article information
Trans Abstract
There has been an accumulation of data regarding the chemopreventive effects of Helicobacter pylori (H. pylori) eradication. However, it remains unclear how H. pylori infection causes gastric cancer (GC) and how H. pylori eradication can prevent GC. Atrophic gastritis (AG) and intestinal metaplasia (IM) are known as precancerous lesions which mainly lead to intestinal-type GC but to some extent, can also lead to diffuse-type GC. The most important mechanism of AG/IM is H. pylori-induced chronic gastritis. Thus, the reversibility of AG and IM by H. pylori eradication therapy is very important in the prevention of GC. There have been many studies providing data supporting the improvement of AG by the eradication of H. pylori to some extent. In contrast, IM has been regarded as “the point of no return.” However, more recent studies have implied the improvement of IM after eradication, suggesting the importance of early eradication therapy in reversible histological status. In this review, we focused on the reversibility of AG and IM by H. pylori eradication and tried to investigate the predicting factors for the improvement of AG and IM including age, sex, smoking, and diet, as well as H. pylori infection.
서 론
위암을 유발하는 요인으로서 중요한 여러 가지가 알려져 있지만 가장 중요한 인자는 Helicobacter pylori (H. pylori) 감염이며, 그 외 인자로서는 노령과 남성 성별, 위암 직계력, 짠 음식과 훈제식품, 흡연, 음주, 위축성 위염과 장상피화생을 들 수 있다[1]. 이 중 위축성 위염과 장상피화생의 위암 위험도에 대한 발표가 많이 되어 왔는데, 예를 들면 위암 발생률에 있어 H. pylori 양성 위축성 위염은 H. pylori 양성이면서 위축성 위염이 없는 경우에 비하여 4.9배, H. pylori 음성이면서 위축성 위염이 없는 경우에 비해서는 14.5배 증가하는 것으로 알려져 있다[2-4]. 장상피화생의 위험성은 더욱 높아 H. pylori 양성 장상피화생의 경우는 H. pylori 양성이면서 장상피화생이 없는 경우에 비하여 위암 발생률이 6.4배 내지 10.9배 증가하는 것으로 보고되어[3,5] 위축성 위염과 장상피화생은 위암의 중요한 전암성 병변으로 간주된다[6].
위축성 위염과 장상피화생의 유병률은 나라마다 다르고 그 진단 방법에 따라 다르지만 2011년 4,023명을 대상으로 한 국내 전국 다기관 연구에서는 내시경적 위축성 위염의 유병률은 40.7%, 장상피화생의 유병률은 12.5%였고 남성에서 여성보다 의미 있게 높게 보고된 바 있다[7]. 흥미로운 것은 다변량 분석에서 위암 직계 가족력(first degree relative)이 있는 군에서 위암 발생 위험인자인 장상피화생이 유의하게 높다는 것이다[7]. 이러한 위축성 위염과 장상피화생의 조직검사 양성률에 대한 분당서울대학교병원의 최근 15년 데이터를 보면 여성에서는 의미있는 감소를 보이지만 남성은 감소하지 않아 H. pylori 외의 흡연, 음주, 식이 요소도 중요함을 시사한 바 있다[8].
위축성 위염과 장상피화생의 가장 중요한 위험인자는 H. pylori 감염으로[9], H. pylori를 제균하였을 때 이 병변들이 가역적으로 호전되는지에 대한 여러 연구들이 수행되어 왔다. 현재까지 위축성 위염은 가역성을 보이는 반면 장상피화생은 그렇지 않다는 의견이 지배적이었으나[10-16], 548명을 대상으로 H. pylori 제균 후 10년까지 추적된 정상군에서의 분석을 보면 위축성 위염과 장상피화생이 가역적인 경우가 전정부, 체부에서 각각 33%, 44%였으며, 위축성 위염이 1년 후에 많이 호전되는 반면 장상피화생의 경우 5년 이상 걸리는 경우가 많아[17] 장기적 추적이 중요함을 시사한 바 있다. 이후 이러한 위축성 위염과 장상피화생의 호전에 미치는 요인에 대한 다변량 분석으로 어떤 요인이 호전에 영향을 미치는지 알아본 바 있다[18]. 이러한 연구를 바탕으로 본고에서는 2018년도 대한소화기학회지에 발표한 H. pylori 제균에 의한 위축성 위염과 장상피화생의 가역성에 대한 종설[4]과 H. pylori 제균 후 위축성 위염과 장상피화생의 호전에 영향을 미치는 인자에 대한 논문[18] 그리고 그 이후 발표된 논문 내용들을 추가하여 위축성 위염과 장상피화생의 발생 기전과 의미, H. pylori 제균의 유용성에 대하여 알아보고자 한다.
본 론
1. 위축성 위염과 장상피화생의 발생 기전 및 위험인자
만성 염증은 세포에 손상을 일으키며 여러 단계의 변화를 거치게 하는데[19], 만성 염증과 연관된 전암성 조직에는 호중구, 대식세포, 단핵구, 비만세포, 호산구, 수지상세포, 림프구 등이 존재함으로써[20] 소위 종양 미세환경(tumor microenvironment)을 이루게 된다. 이러한 종양 미세환경을 이루는 염증세포들은 싸이토카인과 활성산소, 활성질소 등을 생산함으로써 암성 변화의 개시, 촉진 그리고 전이에 관여한다[4]. 이러한 물질들은 산화, 질소화, 할로겐화 등의 화학 반응을 통하여 세포 DNA와 RNA, 단백질들을 손상시켜 세포의 변이를 조장하고 조직의 효소와 단백질의 기능을 변형시켜 여러 단계의 암성 변화에 기여한다[4,21]. H. pylori에 감염된 조직에서는 특히 활성산소와 tumor necrosis factor-α의 역할이 중요한 것으로 보고되어 왔는데[22,23], H. pylori 감염 자체보다는 H. pylori에 의하여 유발된 만성 염증이 위암으로 진행되는 과정을 촉발하는 것으로 보이며, 이러한 과정은 H. pylori가 없더라도 지속될 수 있는 것으로 생각된다[4,24]. 즉, H. pylori의 생존에 적합하지 않은 장상피화생이 발생하여 더 이상 H. pylori가 생존하지 못한 상황에서 종양 미세환경이 더욱 진행하면서 위암이 발생하는 이유이다.
위축성 위염은 만성 염증으로 위점막 선세포(gastric glandular cell)가 소실되어 위점막의 두께가 얇아지는 결과를 초래하여 점막하 혈관이 잘 관찰되는 특징을 보이는 상태로 정의된다. 이후 염증이 진행되면 이렇게 소실된 위점막 선세포가 소장 또는 대장세포로 대체되는 조직학적 장상피화생이 발생하게 된다[25,26]. 널리 사용되고 있는 최신 Sydney 시스템(updated Sydney system)에 따르면, 위축성 위염은 주로 H. pylori와 관련된 다발성(multifocal) 위염과 체부 우세형의 자가면역성 위염으로 분류되며, 전정부와 체부의 소만과 대만 등에서 각각 조직검사를 시행할 것을 권고하고 있다. 조직학적으로는 단핵구의 침윤, 다형핵 백혈구의 활성도, 위축성 위염, 장상피화생, H. pylori 균 밀도의 정도를 없음, 경도, 중등도, 고도의 4단계로 나누고 있다[25].
국내에서 389명의 수진자를 대상으로 한 연구에 따르면, 조직검사로 진단된 위축성 위염의 위험인자는 H. pylori 감염, 나이 61세 이상, cagA와 vacA m1 양성 등이었다[9]. 이러한 염증으로 소실된 위 상피세포가 소장 또는 대장세포로 대체되는 조직학적 장상피화생의 위험인자는 H. pylori 감염, 61세 이상의 나이, 흡연의 과거력, 자극적인 음식, 직업(무직 혹은 비전문적인 직업), 유전자 IL10-592 C/A (A/A에 비하여) 등이었고, IL6-572G (C/C에 비하여)는 장상피화생에 대한 보호인자로 확인되었다[9]. 이처럼 위축성 위염이 주로 H. pylori 감염 내지 그 독성인자에 기인하는데 반하여 장상피화생은 숙주인자가 위험인자라는 점은 위축성 위염이 모두 장상피화생으로 가기보다는 각 개인이 가지고 있는 여러 인자에 따라 다를 수 있음을 시사한다고 하겠다[4,9]. 또한 4,023명을 대상으로 한 국내 다기관 연구에서는 내시경적 위축성 위염의 위험인자로서 40세 이상의 나이, 남성, H. pylori IgG 양성, 장상피화생, 학력(대학 졸업 미만) 등으로 확인되었고, 내시경적 장상피화생의 위험인자로는 40세 이상의 나이, 남성, H. pylori IgG 양성, 위축성 위염, 위암의 직계 가족력, 학력(대학 졸업 미만), 유제품 섭취 등[7]으로 나타남으로써 조직검사를 기준으로 한 위축성 위염과 장상피화생 연구[9]와 아주 같지는 않으나 비슷한 면이 있었다[4]. 또한 위암의 직계 가족력 유무로 시행한 국내의 환자-대조군 연구에서 위암의 직계 가족력은 전정부 조직학적 장상피화생의 위험인자임을 확인하였다[27]. H. pylori 감염과 연령의 증가는 위축성 위염과 장상피화생의 위험인자였고, 자극적인 음식은 전정부 장상피화생의 위험을 증가시킴이 보고되었다[27]. 이상의 연구 보고를 요약해보면 조직검사나 내시경검사를 기준으로 한 위축성 위염과 장상피화생의 위험인자로서 가장 중요한 것은 H. pylori 감염이며, 이에 더하여 남성, 연령, 위암 직계력이 있고 자극적인 음식을 즐기는 경우로 정리할 수 있겠다[4].
장상피화생의 정확한 발생 기전은 완전히 밝혀져 있지 않으나 최근의 연구들에서 십이지장에서 직장에 이르는 장관 특이적인 전사인자(transcriptional factor)인 CDX 유전자 발현이 장상피화생은 물론 이형성증 및 위암으로의 진행에 중요하다는 가설이 제시된 바 있다[28]. 이에 본 연구자가 270명을 대상으로 H. pylori 감염 유무, 장상피화생, 이형성증과 위암군으로 나누어 CDX1과 CDX2의 유전자 발현을 real-time PCR로 알아본 결과 정상군의 정상 위점막에서는 CDX1과 CDX2가 발현되지 않으나 장상피화생이 있는 경우 CDX1과 CDX2의 발현이 관찰되었고 H. pylori 감염군의 위 조직에서 비감염군에 비하여 CDX2의 발현이 유의하게 높았다[29]. 또한 장상피화생 정도가 심해짐에 따라 CDX1과 CDX2의 발현이 증가하였고, CDX2는 불완전형 장상피화생에서 의미 있게 높았다[4,29]. 그리고 CDX1은 정상군보다 이형성증군에서 높게 발현되었고 CDX1과 CDX2 모두 위암군에서 정상군보다 높아[4] 이러한 가설을 뒷받침한 바 있다. 또한, H. pylori 제균 후 평균 33.7개월간 추적한 연구에서는 체부 장상피화생의 개선이 CDX2 mRNA 발현의 감소와 연관되어 있음을 보고함으로써[30] 장상피화생과 CDX2의 연관성 및 H. pylori 제균에 의한 장상피화생 가역성의 근거를 시사한 바 있다.
2. 위암 발생 예측에 있어서 위축성 위염과 장상피화생의 역할
조직학적으로 심한 위축성 위염, 위체부에 두드러진 위염이 위암의 위험인자로 알려져 있어[3] 이를 위암 조기 발견에 활용하려는 시도가 있어 왔다[1]. 그중 operative link on gastritis assessment (OLGA) 평가 시스템은 Sydney 시스템의 조직학적인 평가를 이용하여 전정부와 체부의 염증 정도를 고려하여 위암의 위험도를 분류한 것으로서 0, I, II 단계는 낮은 위암 위험도를 III, IV 단계는 높은 위암 위험도를 반영한다는 보고들이 있다[31,32]. 이후 장상피화생 정도를 활용한 operative link on gastric intestinal metaplasia assessment (OLGIM)의 높은 관찰자간 일치도가 보고되면서 OLGA와 함께 사용할 것이 제안되었다[33]. 2014년도 H. pylori 위염에 관한 교토 국제 합의(Kyoto Global Consensus)에서도 위암의 위험도는 위축성 위염의 범위 및 정도와 연관되며 위암 발생의 위험도 평가는 OLGA나 OLGIM을 활용하도록 제안되면서[34] 이에 대한 관심이 집중되고 있다. 내시경 절제술로 이형성이나 위암을 치료한 환자의 이시성(metachronous) 종양 발생의 위험인자를 52개월 추적 관찰 후 분석한 국내 논문에서 위체부에서의 정상 또는 경도의 장상피화생군에 비하여 중등도나 심한 장상피화생을 가진 군에서 이시성 종양 발생의 hazard ratio가 4.12 (95% CI 2.3~13.87; P=0.022)로 의미 있게 높아, 중등도 이상의 장상피화생이 위암 직계 가족력(hazard ratio 3.52, 95% CI 1.09~11.40; P=0.036)과 함께 이시성 종양 발생의 위험인자임을 보고한 바 있다[35]. 또한 H. pylori 감염에 의하여 증가하는 MOS 유전자의 메틸화 소견은 H. pylori 제균 후 장상피화생이 없는 경우는 감소하지만 장상피화생이 발생한 경우는 H. pylori 제균으로 가역적 변화가 나타나지 않았는데[36], 이시성 종양 발생의 위험인자로 심한 장상피화생과 위암 직계 가족력 외에도 MOS 유전자의 메틸화 소견이 중요한 위험인자임이 밝혀지면서 빈번한 내시경 시행의 기준으로 유용할 것임이 시사된 바 있다[35].
한편, OLGA 단계는 위암 중 위축성 위염이나 장상피화생과 관련성이 높은 장형(intestinal type) 위암과 관계가 있으나 미만형 위암(diffuse type)과는 관계가 없다는 보고가 있었다[37]. 그러나 미만형 위암의 발생 과정은 장형에 비하여 그 선행 조직 변화에 대하여 덜 명확하게 밝혀져 있지만 H. pylori 감염은 장형과 미만형 모두에서 연관되어 있고 만성 활동성 위염이 진행되면서 상피세포의 손상을 주는 과정을 수반한다는 점을 공유하고 있다[38,39]. 결국 장형은 물론 미만형에서도 OLGA, OLGIM의 유용성이 시사되는데, 최근 국내 연구에 따르면 높은 OLGA와 OLGIM 단계(III, IV)가 장형(P<0.001 for OLGA and OLGIM) 뿐만 아니라 미만성(P<0.001 for OLGA, P=0.003 for OLGIM) 위암의 발생에 있어서도 독립적인 위험인자임을 확인한 바 있다[40].
위암 발생률이 낮은 네덜란드 연구에서 장상피화생 진단 후 5년 내에 위암 발생률은 매년 0.25%였고[1], 장상피화생을 가진 환자는 위암 발생 위험성이 10배 내지 10.9배에 이른다는 국내외 보고가 있었다[5,41]. 우리나라보다는 낮지만 위암 발생률이 높은 중국의 경우 장상피화생의 정도에 따른 위암 발생 OR은 17.1에서 29.3에 이른다는 보고가 있어[42] 심한 장상피화생은 매우 중요한 전암성 병변으로 간주되어 한국에서는 1년 간격의 추적 위내시경 검사가 제안되고 있다[43]. 국가에서 암 정복을 목적으로 하는 보건 정책에서 위내시경이나 위조영술을 2년마다 하는 것을 권장하고 있으나 이처럼 더 짧은 주기를 권유하는 이유는 분화도가 좋고 점막에 국한되어 있는 2 cm 이하의 조기위암의 경우 내시경 점막하 박리술(endoscopic submucosal disection)이나 내시경 점막 절제술(endoscopic mucosal resection)로 완치가 가능한데, 심한 장상피화생 소견을 보인 수진자에서 1년 주기 내시경 검사를 시행받은 경우 그 이상 주기보다 내시경 시술에 적절한 조기위암을 의미 있게 많이 발견하였기 때문이다[44].
3. H. pylori 제균에 의한 위축성 위염과 장상피화생의 가역성
H. pylori 제균이 위암 발생의 위험을 줄이는 것에 대해서는 의심의 여지가 없으나[45-48] 그 기전에 대해서는 다양한 의견이 있다. 최근 종설에서 H. pylori 제균의 위암 발생 억제의 중요한 기전으로 위축성 위염과 장상피화생의 가역성 외에 메틸화, 상피간엽전이(epithelial-mesenchymal transition) 및 줄기세포 변화의 가역성을 제시한 바 있다[49]. H. pylori 제균으로 위축성 위염과 장상피화생이 개선되었는지에 대해서는 다양한 연구들과 상반된 보고들로 인하여 많은 논란이 있어 왔다[50]. H. pylori 제균 후 위축성 위염과 장상피화생의 개선 여부에 관하여 발표된 여러 연구들을 2018년도 대한소화기학회지에 소개한 바 있는데 이후 추가 발표된 좋은 논문이 없어 그대로 인용하고자 한다(Table 1)[4].

Key Studies on the Improvement of Atrophic Gastritis and Intestinal Metaplasia after Helicobacter pylori Eradication Therapy
1) 외국의 주요 전향적 연구 및 대규모 연구
지금까지 발표된 외국의 전향적 연구 및 대규모 연구로는 미국, 중국, 대만 등의 연구를 들 수 있다[4]. 대부분의 연구에서 조직학적 중등도의 평가는 범주형 척도를 이용하여 시행하였는데, 정상에서 위암에 이르는 각 조직학적 특성에 번호를 부여하는 방식이었다. 무작위 배정 위약 대조 연구는 미국과 중국에서 각각 시행되었는데, 미국의 2005년 연구에서는 795명의 환자를 대상으로 제균 후 12년까지 추적한 결과를 보고하였으며, 제균에 의하여 위축성 위염과 장상피화생 모두 개선이 있었고 특히 제균 상태가 오래 유지될수록 위염 치유 효과가 늘어난다는 흥미로운 내용을 보고하였던 바 있다[51]. 중국에서 2006년 발표된 무작위 배정 위약 대조 연구에서는 3,365명을 대상으로 제균 후 4년, 8년째에 추적하였는데, 평균적인 조직학적 중증도를 감소시켜 위축성 위염, 장상피화생, 이형성, 위암의 유병률을 감소시켰다고 보고하였다[52].
중국에서는 2004년 특히 장상피화생을 대상으로 한 무작위 배정 위약 대조 연구가 보고되었는데, 587명의 환자를 대상으로 제균 치료 5년 후의 장상피화생의 진행도가 평가되었다. 제균 성공군에서 위약군에 비하여 장상피화생 진행의 위험도가 의미 있게 감소하였음을 보여주는 의미 있는 연구였다[53]. 반면, 대만에서 발표된 대규모 코호트 추적 연구에서는 제균 시 위축성 위염 및 위암의 감소 효과는 확인되었으나 장상피화생에 대한 효과는 확인되지 않은 상반된 결과를 보고하였다[12].
2) 한국에서 시행된 연구
위축성 위염과 장상피화생에 대한 H. pylori 제균의 효과를 연구한 국내 연구는 드문 가운데, 2000년 전향적 연구가 보고되었던 바 있다. 소화성궤양 환자를 대상으로 한 연구로, H. pylori 감염 상태에서 제균되지 않은 십이지장궤양 환자의 추적시 장상피화생이 약간 증가하는 경향을 보였으나 통계적으로는 유의하지 않았으며, 제균된 위궤양 환자에서 장상피화생이 제균 후 줄어드는 경향은 있었으나 역시 통계적 유의성은 보이지 않았다[54].
반면, 최근에 한국에서 최신 Sydney 시스템을 이용하여 10년까지 추적한 전향적 연구가 있었다. 제균에 성공한 경우 위축성 위염과 장상피화생에 있어 의미 있는 감소가 관찰되었는데, 특히 제균 시점으로부터 위축성 위염과 장상피화생이 완전히 소실될 때까지의 기간을 측정하였다는 점에서 의미 있는 연구라고 할 수 있다[18].
3) 메타분석
H. pylori 제균에 따른 위점막의 조직학적 변화를 주제로 한 메타분석은 크게 2007년, 2011년, 2014년 세 차례 발표되었고, 추가로 위암 발생의 위험도에 관하여 장상피화생/이형성군에 대하여 보고한 2015년 연구가 있었다. 2007년 8개의 연구에 대한 메타분석에서는 제균 치료의 위축성 위염에 대한 개선 효과를 확인하였으나 장상피화생에 대해서는 효과가 없었다고 발표하였던 바 있다[13]. 다음으로 2011년 연구는 12개의 연구를 대상으로 하였고 체부의 위축성 위염이 의미 있게 개선되었음을 보고하였으나 전정부의 위축성 위염이나 장상피화생에 있어서는 개선 효과가 확인되지 않았다고 결론지었다[15].
반면, 2014년 16개의 연구를 대상으로 한 메타분석에서는 제균 후 전정부와 체부의 위축성 위염은 물론, 전정부의 장상피화생까지도 호전됨을 보고하였다[55]. 이 메타분석은 기존 메타분석과 비교하여 상대적으로 설계 상의 의의가 있다고 할 수 있는데, 최신 Sydney 시스템을 사용하여 세 군데 이상의 조직 결과를 가진 연구만을 대상으로 하였고 end point로 weighted mean difference를 제공함으로써 기존의 OR에 비하여 위염과 장상피화생의 정도를 표현한 연속 변수에 더 적합한 분석 결과임을 주장하였다. 추가적으로, 원자료(raw data)를 최대한 확보하여 분석함으로써 치료 기간이나 종류에 의한 영향을 배제하고자 하였고 제균 성공/실패를 확실히 구분하여 메타분석의 신빙성을 높이고자 하였다[55]. 세 차례의 메타분석 모두 제균의 위축성 위염에 대한 효과가 확인되었으며, 장상피화생에 대해서는 한 차례의 메타분석에서 전정부에서만 개선이 보고되었다.
비교적 최근인 2015년에 장상피화생과 이형성 환자에 대한 하위집단 분석(subgroup analysis)을 보고한 메타연구가 있었다. 당 연구에서는 무작위 배정 연구들을 대상으로 환자군을 ‘정상, 비위축성 위염, 위축성 위염’군과 ‘장상피화생, 이형성’군으로 나누어 분석한 결과 제균 치료가 비위축성 위염, 위축성 위염에서는 의미 있게 위암 발생의 상대 위험도(relative risk)를 낮추었으나 장상피화생/이형성군에서는 위암 발생의 위험을 낮추지 못하였다고 보고하였다[56]. 추가적으로, 1개월에서 9년까지 장기간의 양성자펌프억제제 투여는 위축성 위염을 증가시킨다는 메타분석 결과가 발표되었던 바 있어, 양성자펌프억제제를 장기간 복용할 경우 유의해야 할 것으로 보인다[57].
4. 위축성 위염과 장상피화생의 호전에 영향을 끼치는 인자
H. pylori 제균으로 위축성 위염이 호전되는 것은 대체로 인정되고 있으나 장상피화생이 개선되는지에 대해서는 상반된 보고들이 있어 왔다. 이는 아마도 연구 규모 및 장기적 추적 기간의 상이성도 있겠고, 또한 위축성 위염과 장상피화생을 유발하는 인자가 각 연구의 코호트에 따라 차이가 있었기 때문이라고 추측된다.
저자들이 2012년 284명의 환자를 대상으로 제균 후 3년간의 추적을 보고한 국내 연구에 따르면 체부 위축성 위염의 개선을 예측하는 인자로 낮은 기저 pepsinogen (PG) I/II 비율(3 이하), 높은 염분 섭취, 체부 우세형 위염 등이 있었고, 전정부 장상피화생에 대해서는 매운 음식(spicy food), 더 높은 기저 장상피화생 등급이 있었다[58]. 전정부 위축성 위염의 개선을 저해하는 인자로는 oip-A 양성 균주가 있었다. 또한 IL1B-511 C/T가 C/C 유전형에 비하여 전정부 장상피화생의 개선을 방해하였다[58]. 체부 장상피화생의 개선과 관련된 인자로는 높은 기저 장상피화생 등급, 낮은 PG I/II 비율, 체부 우세형 위염 등이 있었고, 방해인자로는 IL6-572 C/G가 C/C에 비하여 개선의 저해인자로 보고되었다[58]. 이 연구에서 위축성 위염은 가역적 변화를 보였지만 장상피화생은 좋아지지 않았던 것은 아마도 예수가 적고 추적 기간이 짧았기 때문이라 생각되어, 2018년 778명의 대상자를 최대 10년간 추적하여 위축성 위염과 장상피화생의 호전에 영향을 끼칠 수 있는 인자, 즉 환경적인 요인, 염증 반응을 조절하는 숙주인자의 단일염기다형성, H. pylori 균의 독성인자의 유전자 다형성 등 총 24개의 요인에 대하여 조사하였다[18]. H. pylori 제균 치료나 치료 후 추적 기간 이외에도 환경적인 요인, 숙주 요인, 유전적 다형성 등이 위축성 위염과 장상피화생의 호전에 영향을 주기 때문에 환경적 요인 11개(성별, 나이, H. pylori 균 감염 및 제균 여부, 흡연, 음주력, 혈액형, 염분 식이, 매운 음식, 위암의 가족력, 학력, 경제력), 숙주의 유전적 다형성 10개, H. pylori 독성인자의 유전자 다형성 3개에 대하여 연구하였다[18]. 전정부 및 체부의 위축성 위염의 경우 H. pylori의 제균이 위축성 위염의 호전에 통계적으로 유의한 인자였고 전정부의 장상피화생은 cagA 양성 환자와 H. pylori를 제균한 환자에서 유의하게 호전된 결과를 보였다[18]. 체부의 장상피화생은 H. pylori의 제균이 유의한 인자였다[18]. 이를 다시 H. pylori 감염 여부로 나누어 보았을 때 H. pylori에 감염된 환자군에서는 cagA 및 나이가 위축성 위염과 장상피화생의 호전에 유의한 인자였고, H. pylori가 제균된 환자군에서는 젊은 나이와 경제력이 위축성 위염과 장상피화생의 호전에 유의한 인자였다[18]. H. pylori 감염은 주로 5세 이하에서 감염이 일어나는데[48,59], 젊은 나이일수록 H. pylori균에 감염된 기간이 짧기 때문에 위축성 위염과 장상피화생의 호전이 잘 되는 것으로 판단된다[18]. 가장 중요한 인자인 H. pylori 제균 여부를 배제하고 다른 요인들의 유의성을 확인하기 위하여 H. pylori에 감염된 환자군, H. pylori에 감염되지 않은 환자군, H. pylori 제균이 된 환자군 등으로 나누어 각각 분석하였다(Table 2, 3).

Factors Predicting the Improvement of Atrophic Gastritis and Intestinal Metaplasia in Helicobacter pylori Infected Subjects
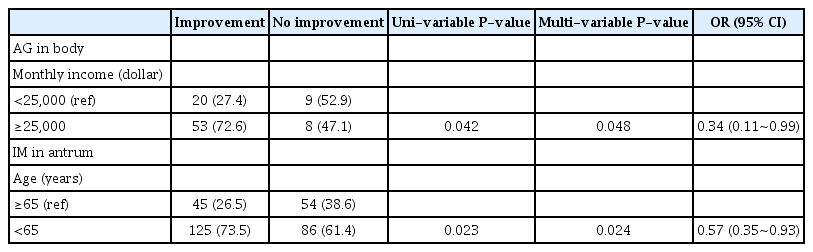
Factors Predicting the Improvement of Atrophic Gastritis and Intestinal Metaplasia in Helicobacter pylori Eradicated Subjects
H. pylori에 감염된 군에서는 나이, cagA가 위축성 위염과 장상피화생의 호전에 유의한 영향을 끼쳤다(Table 2) [18]. 다른 논문에서도 cagA의 경우 위축성 위염과 장상피화생이 호전되는데 유의한 영향을 끼친 바 있는데[40], cagA 항체 양성인 경우 위축성 위염과 장상피화생의 유병률이 유의하게 증가한다고 알려져 있다[60]. 또한 cagA가 위암의 위험인자인지에 대해서도 연구가 이루어지고 있는데[61-63], 본 연구에서는 cagA 항체 양성 환자에서 위축성 위염과 장상피화생이 유의하게 호전된다는 흥미로운 결과를 보인 것이다[18].
다음으로 H. pylori 제균이 된 환자군에서는 경제력이 위축성 위염의 호전에 유의한 영향을 끼쳤고 나이가 장상피화생 호전의 유의한 인자였다[18]. 이를 통하여 나이, 경제력 등 환경적인 요인이 H. pylori의 감염 및 위축성 위염과 장상피화생의 발생만이 아니라 호전에도 영향을 끼친다고 볼 수 있다[24]. H. pylori의 감염 여부도 경제-사회적 여건과 연관되었다는 연구가 있는 것에 기인하여[64,65] 위생 상태나 좋은 영양 상태, 항산화 식사 등이 위축성 위염의 호전에 영향을 끼쳤을 것으로 생각된다.
이처럼 위축성 위염과 장상피화생의 호전에 유의하게 영향을 끼치는 요인으로 H. pylori 제균 치료는 공통적이었으나 다른 요인들도 있었는데, 이것은 위축성 위염과 장상피화생의 위험 요소가 다르기 때문으로 설명할 수 있다[24,66]. 위축성 위염의 위험인자로는 H. pylori 감염, 고령, H. pylori 독성인자, 남자, 학력 등이 있고, 장상피화생의 위험인자로는 H. pylori 감염, 고령, 남자, 흡연력, 매운 음식, 위암 가족력 등이 있다[5,9]. 이를 통하여 위축성 위염이 장상피화생으로 진행하지만 각각 다른 인자가 영향을 끼치므로 이들 인자를 고려하여 H. pylori 제균 치료나 위암에 대한 선별검사를 위한 위내시경 검사의 주기를 정하는 것이 필요하겠다.
5. Pepsinogen과 위축성 위염의 관련성
위축성 위염의 진단은 여러 방법이 있으나 표준화된 합의는 없는 실정이다. 2,558명의 환자를 대상으로 한 대규모 국내 연구가 참고가 될 수 있는데, 이 연구에서는 내시경적 위축성 위염의 진단에는 Kimura-Takemoto 분류를, 조직학적 위축성 위염의 진단에는 최신 Sydney 시스템을 이용하였다[67]. 이를 혈청 PG 검사 결과와 연관 지었는데, 혈청 PG I/II 비율은 위축성 위염이 증가할수록 감소하였고, 내시경적 위축성 위염의 존재 유무를 구분하는데 있어 cut-off value는 3.2였고, 조직학적 위축성 위염 유무를 구분하는 cut-off value는 3.0이었다[67]. 내시경적 소견과 조직학적 소견 사이에는 의미 있는 연관성이 있었는데, 내시경적 진단의 민감도와 특이도는 전정부에서 각각 65.9%, 58.0%, 체부에서는 각각 71.3%, 53.7%로 보고되었다[67]. 내시경적, 조직학적, 혈청학적 진단은 서로 연관성이 있었으나 각각의 검사 방법들은 제한점이 있으므로 여러 진단 방법을 함께 고려하는 것이 필요함을 제시하였다[67].
또 다른 최근의 국내 연구에서는 368명의 위암/이형성군과 610명의 대조군을 대상으로 H. pylori 제균에 따른 혈청 PG 값을 12개월 간격으로 측정하였다[68]. 제균 후에 혈청 PG I과 II 값은 모두 감소하였고, I/II 비율은 제균 후에 의미 있게 증가하였으며, PG I의 감소 및 I/II 비율의 증가 소견은 추적검사에서도 계속 유지되었다[68]. 제균에 성공한 환자군 중 위암/이형성군과 대조군을 비교하였을 때 PG I 값 및 PG I/II 비율에 있어 12개월/23개월까지는 차이가 있었으나 24개월 이후에는 이러한 차이가 보이지 않았다[68]. 또한 제균에 성공한 위암/이형성군과 대조군을 비교하였을 때 전정부 및 체부의 장상피화생에 있어서 양 군 간의 차이가 있었으나 24개월 이후에는 체부의 장상피화생에 있어서는 차이가 없었고 전정부의 차이는 유지되었다[68]. 상기 연구의 결과를 요약하면, 제균 후 시간이 흐름에 따라 위암/이형성군과 대조군에서 PG 비율과 체부의 장상피화생의 차이가 없어진 것으로 볼 수 있어 H. pylori 제균에 의하여 종양 미세환경에 있어 큰 호전을 보임을 간접적으로 시사한다고 하겠다.
6. H. pylori 제균 시기 및 제균 대상과 관련된 연구
18년간의 H. pylori 양성과 제균율을 보고한 국내 연구에 따르면 2005년, 2011년, 2016~2017년에서 제균 추세를 비교하였을 때 40~49세, 50~59세, 60~69세, 70세 이상 등에서 제균 치료를 받는 환자수가 의미 있게 증가하는 경향 등 고령 환자에서의 제균력이 늘어나고 있는 것을 확인하였다[69]. 이는 연령이 높아질수록 건강에 관심이 많아지는 것에 기인하는 것으로 보인다. 이미 자세히 소개한 바 있는 ‘H. pylori 제균 후 위축성 위염과 장상피화생이 호전에 영향을 미치는 인자에 대한 전향적 연구’에 따르면 체부 장상피화생이나 위축성 위염과는 연관성이 보이지 않았지만 65세 미만의 나이가 전정부 장상피화생의 개선에 유의한 인자였다[18]. 또한 고령에서 호발하는 위암/이형성군에서 H. pylori 제균에 의하여 PG I/II 비율이 대조군과 차이를 보이지 않는 등[68] 종양 미세환경에 있어 호전을 보이는 여러 정황 그리고 계속 늘어가는 우리나라 평균 수명을 고려할 때 제균 치료에 있어 나이 제한을 두는 것은 바람직하지 않을 것으로 보인다. 또한 H. pylori 제균의 급여기준이 2018년 1월부터 확대되었고, 위축성 위염의 경우 제균 가능한 조건이 되었으며, 제균 후의 요소호기검사는 모두 보험이 되었다. 일본에서 이전에는 매년 60만 명이 H. pylori 제균약을 복용하다가 H. pylori 양성 위염에서 모두 보험이 적용된 2013년 2월 이후 140만 명으로 2.3배로 제균 인구가 증가한 것처럼[70] 우리나라에서도 향후 H. pylori 제균 인구는 2016~2017년 23.5% [69]보다 더욱 더 증가할 것으로 보인다. 본문에서 소개한 여러 연구들을 종합해볼 때, H. pylori 제균은 가능한 빠른 시기에 시행하는 것이 전암성 병변의 진행을 늦추거나 혹은 되돌리는데 의미가 있을 것으로 보인다.
결 론
현재 많은 가이드라인에서 위축성 위염과 장상피화생 환자에 대한 H. pylori 제균 치료를 권고하고 있다. 그러나 아직까지 제균 치료가 위축성 위염과 장상피화생을 개선시키는지에 대해서는 많은 논란이 있다. 그동안의 여러 연구를 종합해보면, 제균 치료는 위축성 위염을 개선하는 것으로 보이며 장상피화생이 발생하면 돌이키기 어려운 상태로 생각되었으나 최근의 연구에서는 장상피화생 또한 개선이 가능하다는 보고가 점점 많아지고 있다. 이는 더 많은 환자에서 더 장기간의 추적검사가 이루어지면서 이러한 변화가 나타난 것으로 보인다. 모든 연구를 종합하면 H. pylori의 제균 치료는 최대한 조기에 시행할수록 전암성 병변을 개선하고 위암을 예방하는데 효과가 있지만 100세 시대를 바라보는 시점에서 나이에 상관없이 H. pylori 제균을 하면 3~5년 이상의 시간이 흐르면서 호전 가능성이 높아 위암 발생의 예방에 도움이 될 것으로 보인다. 이러한 상황에서 최근 발표된 보건복지부의 H. pylori 제균 고시는 시기 적절한 확대로 보이지만 세계 제1의 위암 발생이라는 오명을 가지고 있는 우리나라 상황에서 이웃 일본의 2013년 조치처럼 H. pylori에 의한 위염이 있는 모든 한국인에서의 H. pylori 제균에 대한 보험 확대가 이루어지는 것이 필요하리라 생각된다.
Notes
No potential conflict of interest relevant to this article was reported.
