 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 21(3); 2021 > Article |
|
Abstract
Autoimmune gastritis is a corpus-dominant type of gastritis with positive serum anti-parietal cell antibodies (APCA) and/or anti-intrinsic factor antibodies. Serum APCA and pepsinogen (PG) assays were performed in subjects with corpus-dominant gastritis detected by endoscopy. Serum APCA was positive in five patients. All these patients were postmenopausal women (four Koreans and one Caucasian from the Russian Federation) with a mean age of 59.0±3.2 years. They displayed low PG I levels ranging from 8.1 to 18.8 ng/mL (mean, 11.4±4.8 ng/mL) and low PG I/II ratios ranging from 0.7 to 2.4 (mean, 1.2±0.7). Three of the patients were being treated for autoimmune thyroiditis. Multiple gastric neuroendocrine tumors were observed in two Helicobacter pylori (H. pylori)-naive patients with high serum gastrin levels exceeding 700 pg/mL and serum chromogranin A levels exceeding 1,000 ng/mL. In the remaining three patients, intestinal metaplasia was observed in the biopsied specimens from the antrum, suggesting a history of H. pylori infection. Our findings indicate the value of positive serum APCA findings, low serum PG I levels, and low serum PG I/II ratios in confirming autoimmune gastritis in patients showing corpus-dominant atrophy, regardless of their H. pylori infection status.
위축성 위염은 원위부에 위축이 심한 전정부 우세형(antrumdominant) 위염과 근위부에 위축이 심한 체부 우세형(corpusdominant) 위염으로 분류할 수 있다. Helicobacter pylori (H. pylori) 감염에 의한 위축과 장상피화생 변화는 전정부에서 시작하여 체부로 이행하는 반면, 자가면역성 위염(autoimmune gastritis)은 체부와 기저부에 분포한 벽세포(parietal cell)가 항벽세포 항체(anti-parietal cell antibody)나 항내인성인자 항체(anti-intrinsic factor antibody)에 의해 파괴되면서 체부 우세형 위염을 유발한다[1]. 위축은 장상피화생과 동반되므로 자가면역 화생성 위축성 위염(autoimmune metaplastic atrophic gastritis)으로 불리기도 한다. 최근에는 동양인에서도 진단 예가 증가하기 시작하면서 검진 위내시경 검사를 받은 일본인 6,739명 중에서 33명(0.49%)이 자가면역성 위염으로 진단되었다는 보고도 있다[2]. 이 연구에서 여성의 자가면역성 위염 유병률은 0.65%로 남성의 0.40%보다 높았으며 진단된 33명 중 32명이 혈청 항벽세포 항체 양성 소견을 보였다.
자가면역성 위염은 벽세포에 있는 양성자 펌프(proton pump)인 H+/K+ ATPase를 항원으로 인식하는 자가면역 항체가 활성화되어 발생한다[3]. 항벽세포 항체는 CD4+ T세포매개성 면역반응을 통해 벽세포를 파괴하고 기저부와 체부에 광범위한 위축을 유발한다. 나아가서 항벽세포 항체는 벽세포뿐만 아니라 같은 위저선(oxyntic gland)에 있는 주세포(chief cell)까지 파괴하여 펩시노겐(pepsinogen, PG) I 분비가 감소하고, 주변에 있는 장크롬친화성 유사 (enterochromaffin-like cell, ECL) 세포와 유문부의 G세포가 상대 적으로 활성화되면서 혈청 가스트린(gastrin) 수치가 상승한다[4]. 또한, 위저선 파괴로 인해 위산 분비와 내인성인자 생성이 저하되면 비타민과 미량영양소가 제대로 흡수되지 못하고, 항내인성인자 항체까지 활성화된 경우에는 T helper 17/T helper 1 경로를 통해 악성 빈혈과 영양소 결핍이 진행된다[5]. 따라서 철분, 칼슘, 마그네슘, 엽산이나 비타민 결핍이 지속되면 위산과 내인성인자를 생성하는 위저선의 벽세포 손상을 의심해야 한다.
H. pylori 감염의 유병률이 높은 지역에서는 체부 우세형 위축성 위염이 전정부 우세형에 비해 드물지만 감염자의 20~30%는 양성자펌프에 대한 면역반응을 보인다[6]. H. pylori 감염 시 T세포매개성 면역반응이 증가해서 자가면역성 위염이 오히려 발생하기 쉽다는 보고도 있다[7]. 따라서 H. pylori 감염과 무관하게 체부 우세형 위축과 낮은 혈청 PG I 수치, 높은 가스트린 수치를 보이면 자가면역성 위염을 감별해야 한다. 이에 지난 6개월간 외래를 방문한 환자들 중에서 위 소견을 보이는 경우에 혈청 항벽세포 항체를 검사한 결과, 5명에서 자가면역성 위염이 진단되었기에 보고한다.
과거 병력이 없는 54세 한국인 여성이 위내시경 검진에서 다발성 상피하 종양이 발견되어 의뢰되었다. 위장관 증상은 없었으나 전신무력감과 간헐적인 어지러움증을 호소하였다. 내시경 소견상 체부와 기저부에는 광범위한 위축과 다발성 상피하 종양들이 관찰되었다(Fig. 1A, B). 전정부에서는 위축이 관찰되지 않아서(Fig. 1C), 역위축을 보이는 체부 우세형 위염으로 진단하고 혈청 검사를 시행하였다. 혈청 항벽세포 항체 검사는 COMVI-II IFA (IMMCO diagnostics, Buffalo, NY, USA) 시약을 사용하여 AP 16 IF ELITE (DAS, Rome, Italy) 장비로 전처리한 뒤, 형광 현미경(Olympus, Tokyo, Japan)으로 판독하였다. 혈청 PG 검사(HBi Co., Anyang, Korea)는 latex enhanced turbidimetric immunoassay로 측정하였고 항H. pylori immunoglobulin G (IgG) 수치는 한국인에서 민감도 100%와 특이도 75.4%를 보이는 Chorus H. pylori IgG assay (DIESSE, Siena, Italy)로 기존 보고와 같이 측정하였다[8]. 그 결과, 항벽세포 항체 양성으로 보고되었으며 PG I 수치는 8.1 ng/mL로 낮았고 H. pylori 감염의 증거는 없었다(Table 1). 혈청 가스트린은 >1,000.0 pg/mL (참고치 13~115 pg/mL), chromogranin A 수치는 1,643.0 ng/mL (참고치 ≤108.0 ng/mL)였다. 혈액 검사에서 hemoglobin 10.4 g/dL (참고치 12~16 g/dL), hematocrit 32.7% (참고치 36~48%), mean corpuscular volume 82.6 fL (참고치 80~98 fL), mean corpuscular hemoglobin (MCH) 26.3 pg (참고치 26~32 pg), MCH concentration 31.8% (참고치 32~36%), 철(Fe) 24 µg/dL (참고치 29~164 µg/dL), ferritin 6.19 ng/mL (참고치 13~150 ng/mL), transferrin and iron-binding capacity 452 µg/dL (참고치 220~433 µg/dL)로 보고되어 철분결핍성 빈혈로 진단하였다. 혈청 비타민 B12 수치는 108 pg/mL (참고치 197~771 pg/mL), 비타민 D 수치는 6.17 ng/mL (참고치 >21 ng/mL)로 낮아서 철분결핍성 빈혈과 악성 빈혈이 동반된 것으로 진단하였다.
체부에 보이는 상피하 종양들은 모두 내시경 점막하박리술(endoscopic submucosal dissection)과 내시경 점막절제술(endoscopic mucosal resection)로 절제하였다. 절제한 9개 모두 신경내분비종양으로 진단되었으며 가장 큰 종양은 1.7 cm로 점막하층까지 침범한 2단계(grade 2)의 신경내분비종양으로 진단되었다(Fig. 1D). Synaptophysin 면역화학염색을 시행한 결과, 양성 소견을 보였다(Fig. 1E). 다른 신경내분비 표지자인 chromogranin과 CD56에 대한 면역염색에서도 양성이었다. Ki-67 index는 3.7%로 신경내분비종양 2단계(grade 2)에 해당하였다. 내시경 검사 시 채취한 위점막 조직에서는 체부에서 위축과 ECL세포 증식이 관찰되었다(Fig. 1F). 기저부에서는 위저선이 관찰되지 않았으며 림프형질세포(lymphoplasma cell) 침윤, 장상피화생과 가성 유문 화생(pseudo-pyloric metaplasia)이 관찰되었다(Fig. 1G). 신경내분비종양에 대한 내시경 절제술 후, 환자는 전신무력감이 급격히 호전되었으며 경구용 철분제와 비타민을 복용하면서 빈혈도 사라졌다. 두 달 후에 추적 검사를 한 결과, 내시경으로 관찰되는 상피하 종양은 없었으며 혈청 chromogranin A 수치는 1,643.0 ng/mL에서 77.5 ng/mL로 정상화된 소견을 보였다. 현재는 증상이 없는 상태로 비타민과 영양제를 복용하면서 추적 관찰 중이다.
갑상선 저하증과 고혈압이 있는 58세 여성이 위내시경 검사에서 다발성 상피하 종양이 발견되어 의뢰되었다. 러시아 연방 국가에서 방문한 백인 여성으로 위암의 가족력이나 H. pylori 감염력은 없었다. 위내시경 소견상 기저부와 체부에 국한된 위축성 위염과 끈적한 점액이 묻은 다발성 상피하 종양이 관찰되었다(Fig. 2). 자가면역성 위염 의심 하에 혈청 검사를 시행한 결과, 항벽세포 항체 양성, chromogranin A 5,640.0 ng/mL, 가스트린 776.0 pg/mL로 높게 보고되었다. 혈청 PG I 수치는 13.6 ng/mL, PG I/II 비는 0.7로 낮았다. 상피하 종양을 조직 검사한 결과, 1단계(grade 1)의 신경내분비종양(Ki-67 index <1%, chromogranin 양성, synaptophysin 양성)으로 보고되었다.
자가면역성 위염 진단 당시, 좌측 갑상선에서 유두암(papillary carcinoma)이 발견되어 외과에서 갑상선 부분절제술을 시행하였다. 혈청 항thyroid peroxidase 항체 수치는 3,619.1 U/mL (참고치 0~60 U/mL)로 자가면역성 갑상선염으로 진단되었다. 갑상선암 수술 후, 갑상선 저하증이 호전된 것을 확인한 뒤에 위의 다발성 신경내분비종양들을 octreotide 주사로 치료하였다. 한달 후에 추적 검사를 한 결과, chromogranin A 수치는 5,640.0 ng/mL에서 696.7 ng/mL, 가스트린 수치는 776.0 pg/mL에서 309.0 pg/mL로 호전 중이었다. 현재는 long acting release octreotide를 주사하면서 추적 관찰 중이다.
15년 전에 좌측 유방암으로 유방절제술을 받은 62세 한국인 여성이 내시경 검사를 받기 위해 내원하였다. 유방암은 재발이 없는 상태였으며 복용 중인 약도 없었다. 위내시경 소견에서 체부와 기저부에 광범위한 위축이 관찰되어(Fig. 3A, B) 혈청 검사를 시행하였다. 항벽세포 항체 양성, 가스트린 430.0 pg/mL로 상승되어 자가면역성 위염으로 진단하였다. 전정부에서 융기형 병변(Fig. 3C)이 관찰되어 조직 검사한 결과, 경도의 장상피화생과 미란이 보고되었다. 체부의 배경 위점막 조직 검사 소견에서는 림프형질세포 침윤과 일부 남은 분홍빛 벽세포가 있는 위저선이 관찰되었다(Fig. 3D). 하지만 대부분의 위점막에서는 위저선이 관찰되지 않았으며 장상피화생과 가성 유문 화생이 관찰되었다. 전정부의 배경 위점막 조직 검사에서는 이상 소견이 관찰되지 않았다(Fig. 3E). 혈청 PG I 수치는 18.8 ng/mL, PG I/II 비는 2.4로 낮았으나 H. pylori 감염으로 진단받거나 치료받은 적이 없다고 하여 본인도 모르는 사이에 제균된 과거 감염자로 분류하였다. 현재는 치료 없이 추적 관찰 중이다.
20년 전에 자궁 근종으로 자궁절제술을 받은 뒤, 3년 전에 갑상선염이 진단되어 신지로이드(synthyroid)를 복용 중인 61세 한국인 여성이 명치의 통증과 구역, 식욕 저하로 내원하였다. 위내시경 소견상 체부와 기저부에서 위축이 보였다(Fig. 4A, B). 전정부에는 위축이 없었으며 궤양이 관찰되었다(Fig. 4C, D). 궤양에서 조직 검사를 한 결과, 경도의 장상피화생과 미란이 보고되었으며 H. pylori는 없었다. 양성 위궤양과 자가면역성 위염이 의심되어 혈청 검사를 한 결과, 항벽세포 항체는 양성이었으며 혈청 PG I 수치는 6.8 ng/mL로 낮게 보고되었다. H. pylori 제균 치료한 적이 없어서 우연히 치료된 과거 감염자로 추정되었으며, 13.7 AU/mL로 낮은 혈청 항H. pylori IgG 수치는 위양성 소견으로 판단되었다. 혈청 비타민 B12 수치가 121 pg/mL였으나 빈혈은 없었다(Table 1). 혈청 가스트린 수치도 정상 소견을 보였다. 현재 비타민과 궤양 치료제를 복용하면서 경과를 관찰하는 중이다.
8년 전에 H. pylori 제균 치료를 받고 재감염 없이 지내던 61세 한국인 여성이 내시경 추적 검사를 위해서 방문하였다. 2년 전에는 체부의 소만측에서 1 cm 크기의 과형성 용종이 발견되어 내시경 절제술로 제거하였으며 7년 전에 하시모토 갑상선염을 진단받아 신지로이드를 복용하는 중이었다. 위내시경에서는 과거 감염으로 인해 전정부에서 시작된 화생성 위염이 체부까지 관찰되었다(Fig. 5A, B). 이전에 용종절제술을 한 체부의 소만에는 이상이 없었으나, 전정부에는 8년째 변화가 없는 융기형 병변이 관찰되었다(Fig. 5C). 융기형 병변을 조직 검사한 결과, 심한 단계(marked degree)의 장상피화생이 보고되어 과거 감염에 의한 것으로 판단하였다. PG I 수치는 9.9 ng/mL로 감소되어 있었으며 혈청 항벽세포 양성 소견을 보여서 과거 감염자에서 발생한 자가면역성 위염으로 진단하였다. 환자는 증상이 없는 상태로 추적 관찰 중이다.
H. pylori 감염이 흔한 지역에는 자가면역성 위염이 드물 것이라는 선입견이 있으나 체부 우세형 위축성 위염이 관찰된 한국인 4명과 백인 1명에서 혈청 항벽세포 항체를 검사한 결과, 양성으로 보고되어 자가면역성 위염으로 진단하였다. 모두 폐경 후의 여성으로 평균 나이는 59.0±3.2세였으며, 3명은 자가 면역성 갑상선염으로 치료 중이었다. H. pylori 감염력의 증거가 없는 미감염자 2명에서는 위에서 다발성 신경내분비종양이 함께 진단되었다.
혈청 항벽세포 항체를 검사한 5명 모두에서 양성 소견을 보여서 결과가 위양성일 가능성도 고려해보았으나 특징적인 위내시경 소견, 동반된 위 신경내분비종양(증례 1, 2), 높은 가스트린 수치(증례 1-3), 동반된 자가면역성 갑상선염(증례 2, 4, 5)을 참조하여 자가면역성 위염으로 확진할 수 있었다. 또한, 모두 낮은 혈청 PG I 수치(11.4±4.8 ng/mL)와 PG I/II 비(1.2±0.7)를 보여서 자가면역성 위염을 진단하는 데 도움이 되었다. 항벽세포 항체는 H. pylori 감염보다 강력하게 벽세포를 손상시키기 때문에 자가면역성 위염 환자들의 평균 혈청 PG I 수치는 8.2 ng/mL로 H. pylori 감염으로 인한 손상에 비해 낮다[9]. 다른 일본 연구에서도 자가면역성 위염 환자들의 평균 혈청 PG I 수치가 6.6 ng/mL, PG I/II 비가 0.6으로 낮게 보고되었다[10]. 실제로 혈청 항H. pylori IgG 음성이면서 혈청학적 위축(PG I ≤70 ng/mL & PG I/II ≤3.0)이 있는 환자 24명을 조사해보니 4명이 자가면역성 위염이었다는 보고도 있다[11]. 따라서 혈청 PG I 수치가 낮고 위내시경에서 체부 우세형 위축이 관찰되면 혈청 항벽세포 항체를 검사해서 자가면역성 위염을 감별하는 것이 바람직하다.
항벽세포 항체는 거의 위산이 고갈되는 상태까지 위저선을 파괴하기 때문에 위 내 pH가 높아서 H. pylori 이외에 요소 분해효소를 생성하는 균(α-Streptococcus, γ-Streptococcus, Haemophilus, Enterococcus, Neisseria, Klebsiella pneumoniae, Klebsiella oxytoca, Escherichia coli 등)이 증식하기 쉽다[12]. 따라서 요소호기 검사는 위양성률이 높으므로 대변항원 검사로 H. pylori 제균 여부를 확인해야 한다. 즉, 자가면역성 위염 환자에서 H. pylori 제균 성공 여부를 요소호기 검사로 판단하면 계속해서 제균 실패(endless eradication failure)로 나온다. 아울러 H. pylori 감염만으로는 벽세포와 주제포가 고갈될 정도로 극심한 손상이 발생하지 않으므로, 만약 체부나 기저부 조직 검사 소견에서 위저선이나 벽세포와 주세포가 관찰되지 않을 정도로 위축이 심하면 자가면역성 위염을 의심해야 한다[13]. 본원에서 진단된 환자들의 조직 검사 소견에서도 근위부 위축이 심한 체부 우세형 위염을 확인할 수 있었으며 림프형질 세포 침윤, 위저선 위축, 장상피화생, 가성 유문 화생, ECL세포 증식 등이 관찰되어 자가면역성 위염에 합당한 소견을 보였다. 위의 근위부에서 관찰되는 ECL 등 내분비세포 과형성은 chromogranin A 면역염색을 하면 보다 명확하게 관찰할 수 있고, 유문선이 있는 원위부에서 관찰되는 G세포 과형성 및 위선과 근육 다발로 구성된 선유근증은 가스트린 면역염색을 하면 보다 쉽게 진단할 수 있다[14].
혈청 항내인성인자 항체도 자가면역성 위염을 진단하는 데 도움이 되지만 환자 중 27%에서만 양성 소견(민감도 37%, 특이도 100%)을 보이는 반면, 항벽세포 항체는 자가면역성 위염 환자의 81%에서 양성 소견(민감도 81%, 특이도 90%)을 보인다[15]. 또한, 혈청 항내인성인자 항체가 양성인 경우에는 대부분 악성 빈혈이 동반되는데, 중국인 자가면역성 위염 환자 중 19.3%에서만 악성 빈혈이 진단될 정도로 동양인에서는 드물다[16]. 이번에 진단된 환자 중에서도 단 1명에서만 악성 빈혈이 있었으므로 혈청 항내인성인자 항체를 검사하였더라도 진단과 치료가 달라지지 않았을 것으로 추정된다. 한국인에서 위내시경과 혈청항체 검사 소견을 보고한 논문으로는 충청남도 5개 병원에서 악성 빈혈 환자 97명(남자 54명, 여자 43명)을 분석한 다기관 연구가 있다[17]. 환자들의 평균 연령은 66세로 97명 중 83명이 혈청 항벽세포나 항내인성인자 항체 검사를 해서 71명(85.5%)이 둘 중 하나에서 양성 소견을 보였다. 혈청 항벽세포 항체는 81명 중 35명에서 양성, 항내인성인자 항체는 80명 중 62명이 양성으로 나왔는데 악성 빈혈 환자들만 분석한 연구라서 항내인성인자 항체 양성률이 높은 것으로 해석된다. 이 연구에서 위내시경 검사는 97명 중 56명에서 시행되었으며 55명이 체부의 위축성 위염 소견을 보였다. 따라서 우리나라 악성 빈혈 환자 중 절반은 자가면역성 위염이 있을 것으로 추정된다.
H. pylori 감염이 흔한 곳에서는 체부 우세형 위염과 전정부 우세형 위염이 혼합되어 관찰될 수 있는데 자가면역성 위염 환자들은 H. pylori 감염성 위축성 위염 환자들에 비해서 높은 혈청 가스트린 수치를 보이며 동반된 자가면역성 갑상선염의 유병률이 높다[18]. 증례 5의 경우, 제균 치료 후에도 광범위한 화생성 위염이 지속되어 다른 환자들에 비해 위축이 덜 명확하였으나, 이미 자가면역성 갑상선염으로 치료 중이라는 점과 낮은 혈청 PG I 수치를 보고 자가면역성 위염으로 진단하였다. 흔히 동반되는 자가면역성 질환은 하시모토 갑상선염으로 갑상선위 증후군(thyrogastric syndrome)이나 다선 자가면역성 증후군(polyglandular autoimmune syndrome)으로 불리기도 한다[19]. 다른 자가면역질환인 I형 당뇨, 전신 홍반 루푸스, 피부근염, 원발 담즙성 간경변, Addison병, 만성 두드러기(chronic urticaria), 중증근무력증(myasthenia gravis), 백반증(vitiligo), 구강편평태선(oral lichen planus), IgG4 연관성 질환도 동반될 수 있으나[20], 이번에 진단된 5명에서는 갑상선염 이외에 다른 자가면역성 질환은 발견되지 않았으며 불임이나 유산 등의 특이 소견도 없었다.
대부분의 자가면역성 위염 환자들은 명확한 체부 우세형 위축성 위염만 보이지만 끈적한 점액(증례 2)이나 백색 변화(증례 5)가 동반될 수 있다[21]. 백색 변화는 고가스트린혈증에 의해 벽세포 돌출이 심해져서 발생한 가성 위용종이 대부분이며 드물게 고분화도의 선암으로 진단되기도 한다[22]. 아울러 자가면역성 위염 환자의 위에서는 신경내분비종양이나 과형성 용종, 선와상피세포 증식으로 인한 선암이 발생할 수 있는데[23], 본원 환자 5명 중 높은 혈청 가스트린(>700 pg/mL)과 chromogranin A (>1,000 ng/mL) 수치를 보인 2명에서 신경내분비종양이 진단되었다. 위 신경내분비종양은 크게 세 가지로 분류되며, 자가면역성 위염에서 발생하는 대부분의 신경내분비종양은 예후가 양호한 I형에 속한다[24]. I형 중 87.1%는 자가면역성 위염을 동반하지만 일부에서는 H. pylori 감염만 진단되므로 주의해야 한다[25]. II형은 Zollinger-Ellison 증후군에서 발생한 신경내분비종양으로 다발성내분비종양(multiple endocrine neoplasia type 1)에 속하며 III형은 2 cm 이상의 단일 종양이 흔한데 크거나 Ki-67 index가 높을수록 림프절이나 간으로 전이할 가능성이 높다[26]. 한편, I형의 위 신경내분비종양은 대부분이 작은 다발성 종양으로 전이가 드물어서 크기 2 cm 이하의 신경내분비종양에 대해서는 내시경 절제술을 시행한다[27]. 약 8개월 후에 60%에서 재발되지만 다시 내시경으로 절제하면 예후는 좋다[28]. 종양이 많아서 내시경으로 절제할 수 없을 때는 가스트린 분비를 줄이기 위해 전정부 절제술을 고려하거나 somatostatin 유사체(octreotide, lanreotide, pasireotide)를 주사한다[29]. 최근에는 가스트린/cholecystokinin-2 receptor 길항제인 netazepide도 복용약으로 개발되었다[30]. 자가면역성 위염은 다른 자가면역질환과 달리 면역조절제, 스테로이드, 생물학제, 항염증제의 효과가 입증되지 않아서 철분, 비타민 B12, 엽산 등 부족한 영양소만 보충하면서 정기적으로 추적 검사를 한다[31].
결론적으로, 자가면역성 위염은 H. pylori 감염 상태와 무관하게 발생할 수 있는 질환으로 의사가 내시경 소견을 보고 체부 우세형 위염을 진단하여 혈청 항벽세포나 항내인성인자 항체를 검사하지 않는 이상 진단할 수 없는 질환이다. 위에 동반된 다발성 신경내분비종양이나 다른 장기의 자가면역성 질환, 낮은 혈청 PG I 수치와 PG I/II 비, 높은 혈청 가스트린 수치와 chromogranin A 수치는 자가면역성 위염을 진단하는 데 도움이 된다. 이번 보고에서도 5명 중 3명이 자가면역성 갑상선염으로 신지로이드를 복용 중이었으며, 5명 모두 혈청 PG I 수치가 낮았다. 악성 빈혈은 1명에서만 관찰되었는데 서양과 달리 동양인 자가면역성 위염 환자에서는 항내인성인자 항체나 악성 빈혈이 드물고 항벽세포 항체만 있는 경우가 흔하기 때문으로 해석된다. 아울러 조직 검사 소견에서 체부와 기저부에 림프형 질세포 침윤 및 위저선 소실, 위축, 장상피화생, 가성 유문 화생, ECL세포 증식이 관찰되어 자가면역성 위염을 진단하는 데 도움이 되었다. 종합할 때, 자가면역성 위염은 H. pylori 감염력이 있는 한국인에서도 발생하므로 체부 우세형 위축이 저명하거나 자가면역성 갑상선염이 있는 환자가 낮은 혈청 PG I 수치를 보이면 혈청 항체 검사를 해서 진단할 것을 권한다.
Acknowledgements
This work was supported by the Korean National Research Foundation 016R1D1A1B02008937.
Fig. 1.
Gastric neuroendocrine tumors in an autoimmune gastritis patient with general weakness. (A) Retroflexed view shows several subepithelial tumors with diffuse atrophy in the upper body. (B) Antegrade view shows diffuse atrophy with several subepithelial tumors in the lower body. Transparent vessels are observed on the surface of the subepithelial lesions. The lesions were hard in consistency without the cushion or rolling sign. (C) No atrophy is observed in the antrum. (D) Neuroendocrine tumors arising from the atrophic gastric mucosa (H&E stain, ×40). (E) Tumor cells positive for synaptophysin, which is specific for neuroendocrine tumors (synaptophysin immunohistochemical stain, ×40). (F) Proliferation of enterochromaffin-like cells observed with atrophy in the biopsied specimen taken from the lower body (H&E stain, ×200). (G) In the biopsied specimen taken from the upper body, atrophic mucosa without fundic glands are observed. Pseudo-pyloric metaplasia is also observed (left part of this image) with intestinal metaplasia and lymphoplasma cell infiltration (right part) in the atrophic mucosa (H&E stain, ×200).
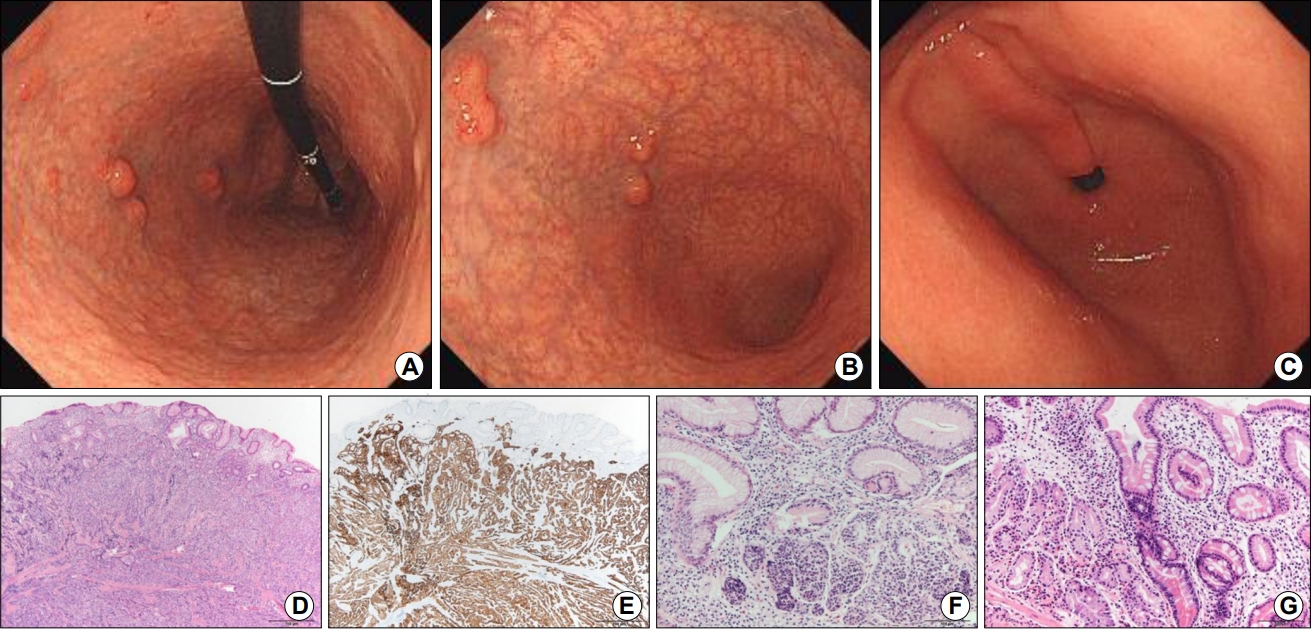
Fig. 2.
Multiple gastric neuroendocrine tumors in an autoimmune gastritis patient with newly-diagnosed thyroid cancer. (A) Diffuse atrophy is observed with multiple subepithelial lesions in the fundus. (B) Retroflex view of the upper body reveals multiple subepithelial lesions with yellowish sticky mucus. A grade 1 neuroendocrine tumor with positive staining for chromogranin A and synaptophysin is observed in the biopsied specimen of the largest subepithelial lesion in the greater curvature side of the upper body. (C) Linear hyperemic streaks are evident in the antrum without atrophy.
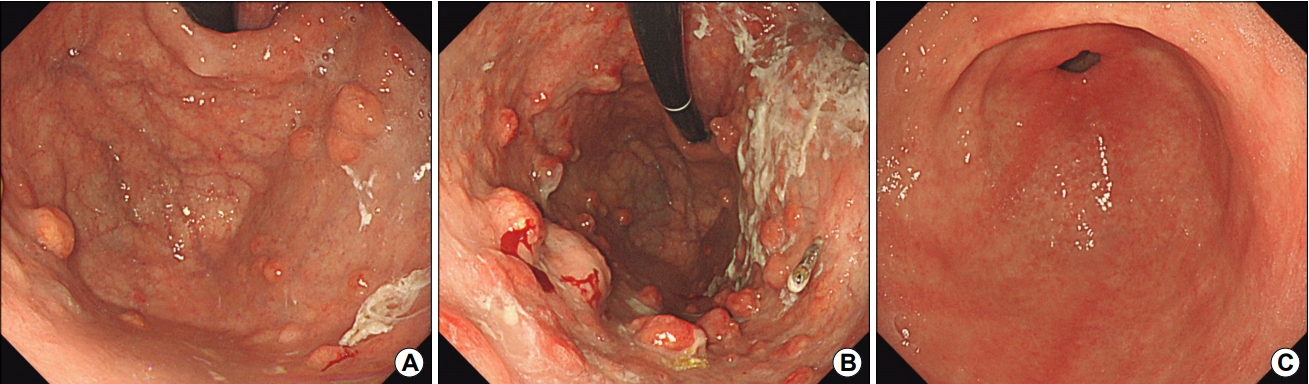
Fig. 3.
Endoscopic findings of an autoimmune gastritis patient with a history of breast cancer resection. (A) Diffuse atrophy is observed in the fundus. (B) Retroflex view of the body shows diffuse atrophy. (C) Diffuse irregular nodularity is observed in the antrum. Mild intestinal metaplasia and erosion are evident in the biopsied specimen from the elevated lesion in the posterior wall of the antrum. (D) In the lamina propria taken from the upper body, lymphoplasma cell infiltration can be observed in the atrophic mucosa (H&E stain, ×200). On the right side of this image, the pink-colored cells indicate parietal cells in remnant fundic glands. Intestinal metaplasia and pseudo-pyloric metaplasia are observed in other parts of the image. The findings are consistent with autoimmune gastritis. (E) No abnormal findings are observed in the biopsied specimen taken from the background mucosa of the antrum (H&E stain, ×200).
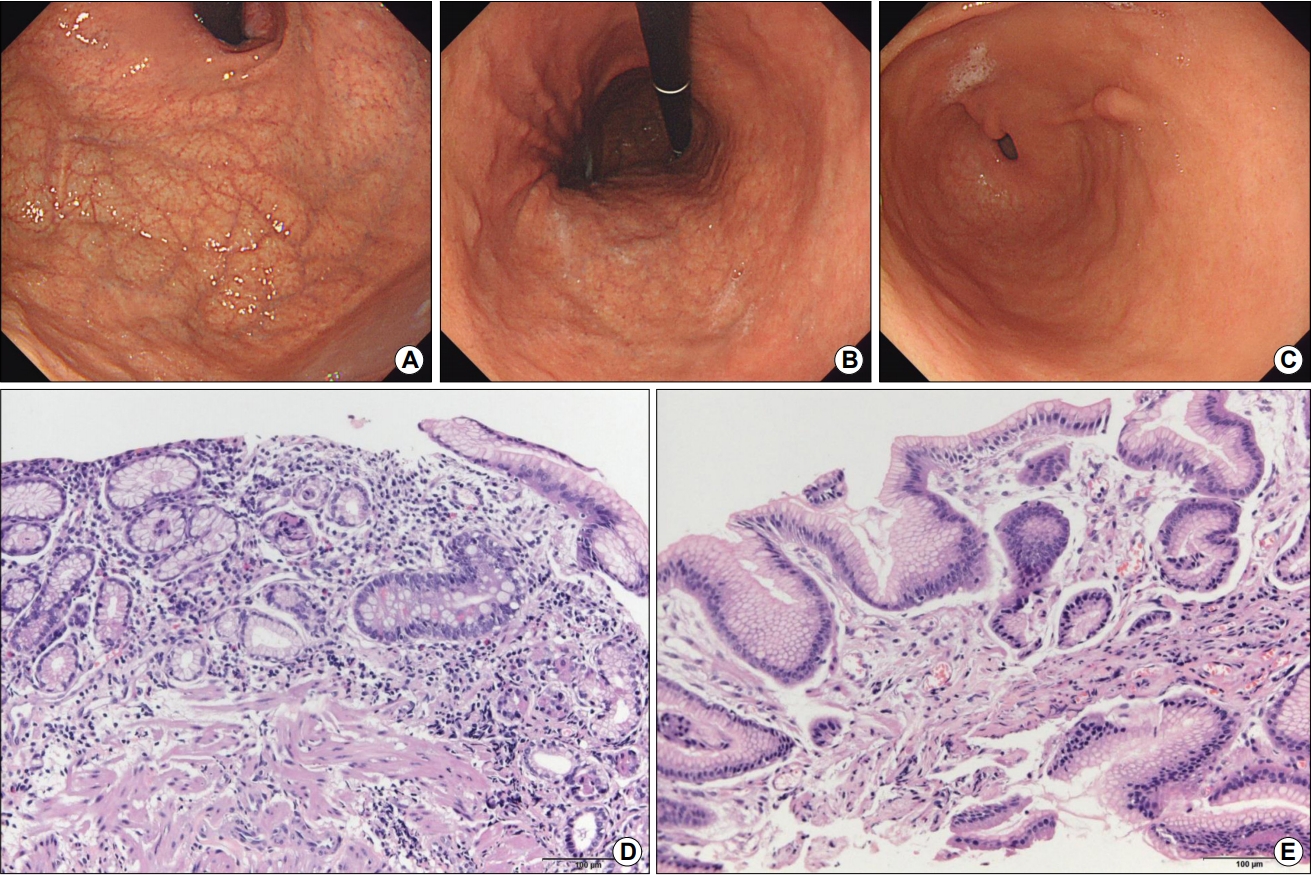
Fig. 4.
Endoscopic findings in an autoimmune gastritis patient with autoimmune thyroiditis. (A) Retroflexed view shows diffuse atrophy in the upper body. (B) Diffuse atrophy extending down to the lower body. (C) No atrophy is observed in the antrum. (D) An ulcer is observed in the lesser curvature side of the distal antrum. A mild degree of intestinal metaplasia and erosion are observed in the biopsied specimen from the margin of the ulcer. Helicobacter pylori was found to be absent.
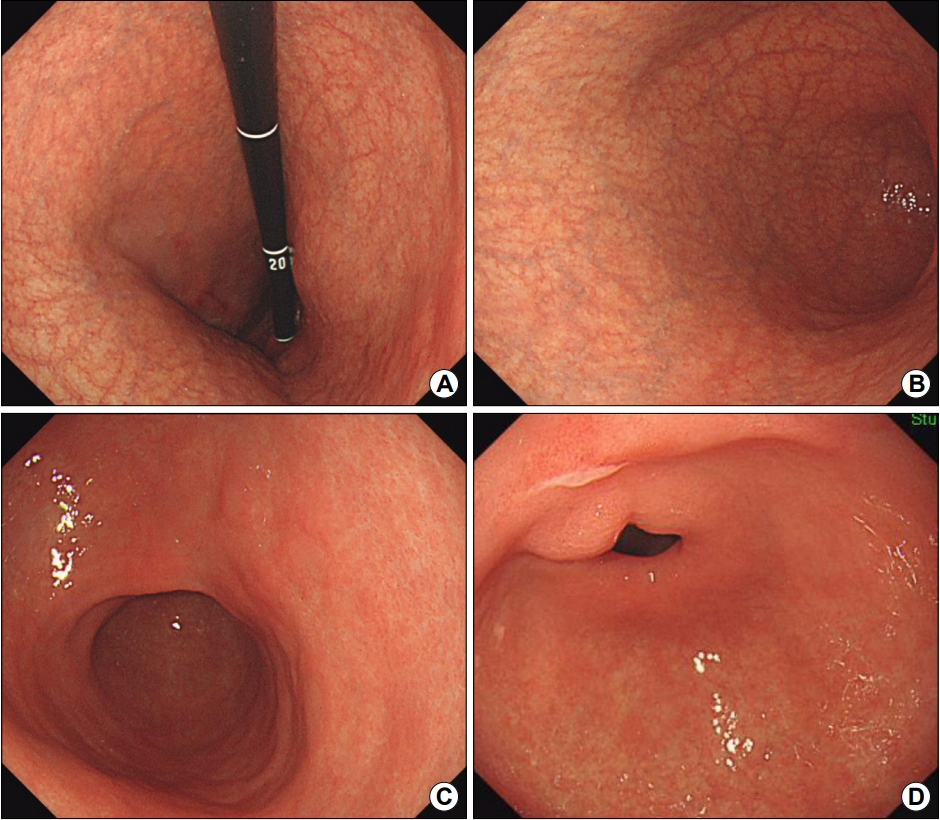
Fig. 5.
Endoscopic findings in an autoimmune gastritis patient with a history of Helicobacter pylori eradication and gastric hyperplastic polyp resection. (A) Diffuse mucosal nodularity and atrophy are observed in the fundus with whitish nodular lesions. (B) Retroflex view of the body with diffuse mucosal nodularity and atrophy. There was no evidence of recurrence in the lesser curvature side of the lower body after gastric hyperplastic polyp resection (2 years prior). (C) Diffuse mucosal nodularity and atrophy extending down to the antrum. A 1.5 cm-sized elevated lesion is observed in the greater curvature side of the antrum. A marked degree of intestinal metaplasia was found in the biopsied specimen from the elevated lesion.

Table 1.
Fasting Serum Assay and Imaging Study Findings in Five Autoimmune Gastritis Patients
| Patient 1, F/54 | Patient 2, F/58 | Patient 3, F/62 | Patient 4, F/61 | Patient 5, F/60 | |
|---|---|---|---|---|---|
| Anti-parietal cell antibody | Positive | Positive | Positive | Positive | Positive |
| Anti-H. pylori IgG (AU/mL) | <5 | 5.4 | 5.7 | 13.7 | 5.3 |
| Pepsinogen I (ng/mL) | 8.1 ↓ | 13.6 ↓ | 18.8 ↓ | 6.8 ↓ | 9.9 ↓ |
| Pepsinogen II (ng/mL) | 10.2 | 18.6 | 7.7 | 7.3 | 10.4 |
| Pepsinogen I/II ratio | 0.8 ↓ | 0.7 ↓ | 2.4 ↓ | 0.9 ↓ | 1.0 ↓ |
| Hemoglobin (g/dL) | 10.4 ↓ | 14.0 | 12.5 | 13.0 | 12.8 |
| Vitamin B12 (pg/mL) | 108 ↓ | 425 | 573 | 121 ↓ | NA |
| Gastrin (pg/mL) | >1,000 ↑ | 776.0 ↑ | 430.0 ↑ | 97.8 | NA |
| Chromogranin A (ng/mL) | 1,643.0 | 5,640.0 | NA | NA | NA |
| H. pylori infection status | Naive | Naive | Past infection (unintended eradication) | Past infection (unintended eradication) | Past infection (eradicated in May 2012) |
| Medical history | None | Hypertension | No recurrence after resecting left breast cancer in June 2006 | Hysterectomy because of uterine myoma (20 years previously) | Endoscopic resection for 1 cm-sized gastric hyperplastic polyp in December 2018 |
| Left thyroidecotmy for papillary carcinoma in February 2021 | |||||
| Coesxisting autoimmune disease | None | Autoimmune thyroiditis with synthyroid intake since January 2021 | None | Autoimmune thyroiditis with synthyroid intake since August 2017 | Autoimmune thyroiditis with synthyroid intake since January 2013 |
| Symptoms | General weakness and dizziness | Chronic fatigue | None | Epigastric pain, anorexia, and nausea | None |
| Endoscopic findings of the corpus | Diffuse atrophy with nine NETs (resected endoscopically in December 2020) | Diffuse atrophy with inumerable NETs (under octerotide treatment since February 2021) | Diffuse atrophy | Diffuse atrophy | Diffuse atrophy and nodularity due to extensive IM |
| Endoscopic findings of the antrum | None | Linear streaks | Nodular lesion with limited IM | Ulcer with limited IM | Elevated lesion with extensive IM |
| Computed tomography findings of the abdomen | Nodular enhancing lesions in the gastric body (≤1.1 cm) | Low density lesion with mild capsular retraction in the livera | No remarkable finding | Mild gastric wall thickening | No remarkable finding |
REFERENCES
1. Massironi S, Zilli A, Elvevi A, Invernizzi P. The changing face of chronic autoimmune atrophic gastritis: an updated comprehensive perspective. Autoimmun Rev 2019;18:215–222.


2. Notsu T, Adachi K, Mishiro T, et al. Prevalence of autoimmune gastritis in individuals undergoing medical checkups in Japan. Intern Med 2019;58:1817–1823.



3. van Driel IR, Baxter AG, Laurie KL, et al. Immunopathogenesis, loss of T cell tolerance and genetics of autoimmune gastritis. Autoimmun Rev 2002;1:290–297.


4. Magris R, De Re V, Maiero S, et al. Low pepsinogen I/II ratio and high gastrin-17 levels typify chronic atrophic autoimmune gastritis patients with gastric neuroendocrine tumors. Clin Transl Gastroenterol 2020;11:e00238.



5. Cavalcoli F, Zilli A, Conte D, Massironi S. Micronutrient deficiencies in patients with chronic atrophic autoimmune gastritis: a review. World J Gastroenterol 2017;23:563–572.



6. Bergman MP, Vandenbroucke-Grauls CM, Appelmelk BJ, et al. The story so far: Helicobacter pylori and gastric autoimmunity. Int Rev Immunol 2005;24:63–91.


7. D'Elios MM, Amedei A, Benagiano M, Azzurri A, Del Prete G. Helicobacter pylori, T cells and cytokines: the "dangerous liaisons". FEMS Immunol Med Microbiol 2005;44:113–119.



8. Kwon H, Lee SY, Kim JH, et al. The ABC classification is less useful for older Koreans born before 1960. Gut Liver 2019;13:522–530.




9. Terao S, Suzuki S, Yaita H, et al. Multicenter study of autoimmune gastritis in Japan: clinical and endoscopic characteristics. Dig Endosc 2020;32:364–372.


10. Kamada T, Sumi N, Suehiro M, et al. Clinical characteristics and serological findings of type A gastritis. Stomach Intestine 2019;54:973–981.
11. Terao S, Tome M, Kure I, et al. Most cases categorized into the group D are not those with complete elimination of Helicobacter pylori infection because of advanced atrophy and intestinal metaplasia. Jpn J Helicobacter Res 2013;14:5–14.
12. Furuta T, Baba S, Yamade M, et al. High incidence of autoimmune gastritis in patients misdiagnosed with two or more failures of H. pylori eradication. Aliment Pharmacol Ther 2018;48:370–377.


13. Kaizaki Y, Aoyagi H, Kogami A, Hara T, Hayashi Y. Pathological findings of autoimmune gastritis. Stomach Intestine 2019;54:963–971.
14. Coati I, Fassan M, Farinati F, Graham DY, Genta RM, Rugge M. Autoimmune gastritis: pathologist's viewpoint. World J Gastroenterol 2015;21:12179–12189.



15. Lahner E, Norman GL, Severi C, et al. Reassessment of intrinsic factor and parietal cell autoantibodies in atrophic gastritis with respect to cobalamin deficiency. Am J Gastroenterol 2009;104:2071–2079.



16. Zhang H, Jin Z, Cui R, Ding S, Huang Y, Zhou L. Autoimmune metaplastic atrophic gastritis in Chinese: a study of 320 patients at a large tertiary medical center. Scand J Gastroenterol 2017;52:150–156.


17. Song IC, Lee HJ, Kim HJ, et al. A multicenter retrospective analysis of the clinical features of pernicious anemia in a Korean population. J Korean Med Sci 2013;28:200–204.



18. Tsuboi M, Niikura R, Hayakawa Y, Hirata Y, Ushiku T, Koike K. Distinct features of autoimmune gastritis in patients with open-type chronic gastritis in Japan. Biomedicines 2020;8:419.



19. Tozzoli R, Kodermaz G, Perosa AR, et al. Autoantibodies to parietal cells as predictors of atrophic body gastritis: a five-year prospective study in patients with autoimmune thyroid diseases. Autoimmun Rev 2010;10:80–83.


20. Rodriguez-Castro KI, Franceschi M, Miraglia C, et al. Autoimmune diseases in autoimmune atrophic gastritis. Acta Biomed 2018;89:100–103.


21. Maruyama Y, Yoshii S, Kageoka M, et al. Endoscopic findings of autoimmune gastritis:chronic atrophic gastritis type A. Stomach Intestine 2019;54:998–1009.
22. Doyama H, Yoshida N, Tsuyama S, et al. The “white globe appearance” (WGA) a novel marker for a correct diagnosis of early gastric cancer by magnifying endoscopy with narrow-band imaging (M-NBI). Endosc Int Open 2015;3:E120–E124.




23. Mahmud N, Stashek K, Katona BW, et al. The incidence of neoplasia in patients with autoimmune metaplastic atrophic gastritis: a renewed call for surveillance. Ann Gastroenterol 2019;32:67–72.


24. Sato Y, Imamura H, Kaizaki Y, et al. Management and clinical outcomes of type I gastric carcinoid patients: retrospective, multicenter study in Japan. Dig Endosc 2014;26:377–384.


25. Sato Y, Iwafuchi M, Ueki J, et al. Gastric carcinoid tumors without autoimmune gastritis in Japan: a relationship with Helicobacter pylori infection. Dig Dis Sci 2002;47:579–585.


26. Saund MS, Al Natour RH, Sharma AM, et al. Tumor size and depth predict rate of lymph node metastasis and utilization of lymph node sampling in surgically managed gastric carcinoids. Ann Surg Oncol 2011;18:2826–2832.



27. Hosokawa O, Kaizaki Y, Hattori M, et al. Long-term follow up of patients with multiple gastric carcinoids associated with type A gastritis. Gastric Cancer 2005;8:42–46.



28. Merola E, Sbrozzi-Vanni A, Panzuto F, et al. Type I gastric carcinoids: a prospective study on endoscopic management and recurrence rate. Neuroendocrinology 2012;95:207–213.


29. Chen WC, Warner RR, Ward SC, et al. Management and disease outcome of type I gastric neuroendocrine tumors: the Mount Sinai experience. Dig Dis Sci 2015;60:996–1003.



-
METRICS

-
- 3 Crossref
- 3,892 View
- 120 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res






