 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 24(1); 2024 > Article |
|
Abstract
Perforations or fistulas in the gastrointestinal tract constitute serious emergencies and are associated with high morbidity and mortality rates. Such lesions, occurring in the esophagus, stomach, and duodenum, may arise from noniatrogenic causes (e.g., peptic ulcers, corrosive insults, trauma, malignant tumors) and iatrogenic causes (e.g., endoscopic procedures and surgeries). A prompt diagnosis and an appropriate management strategy are crucial for early recovery before secondary complications occur that may be induced by infection and/or chemical damage from gastric acid or bile. Various endoscopy-based treatment modalities have been developed and play pivotal roles in the management of upper gastrointestinal perforations and fistulas. Through-the-scope clips, self-expanding metallic stents, over-the-scope clips, endoscopic suturing devices, and endoscopic vacuum therapy have significantly improved the success rates associated with treating these types of lesions. However, choosing the optimal modalities that lead to good patient prognoses depends on the lesion characteristics, such as its size, duration, location, and surrounding tissue condition. Thus, gastrointestinal endoscopists have to regularly master and incorporate new endoscopy-based treatment approaches for these complicated conditions.
소화관에서 발생하는 천공 또는 누공은 소화기 질환들 중에서도 심각한 응급 상황 중에 하나이다. 식도, 위, 십이지장으로 구성된 상부위장관에서 천공 또는 누공이 발생하면 병변 위치와 천공의 양상, 그리고 환자와 관련된 요인들로 인해 심각도가 증가할 수 있다. 식도는 주변에 대동맥, 심장, 폐, 기관지 등 주요 장기들이 밀집해 있어서 천공 또는 누공에 의한 2차 합병증이 치명적으로 발생할 수 있다. 위와 십이지장에서 천공이 발생한 경우 강력한 산성 화학물질인 위산과 담즙에 의한 2차 합병증이 발생할 가능성이 높다는 특징이 있다.
소화기 내시경이 비약적으로 발전한 최근 수십 년 동안 위장관의 천공 또는 누공과 같은 심각한 합병증에 대한 내시경 치료법들도 다양하게 소개되어 왔다. 주목할 만한 것은 최근에 소개된 여러 치료법들의 임상 성적이 상당히 높다는 것이 보고되고 있어 이 분야에 대한 소화기전문의들의 관심이 더욱 필요한 시점이다. 본고에서는 상부위장관 천공 또는 누공에 대해 살펴보고 내시경 치료법들을 중심으로 한 치료법에 대해 논하도록 하겠다.
식도 천공 또는 누공은 드물지만 생명을 위협할 수 있는 중대한 질환이며, 의인성과 비의인성으로 분류할 수 있다[1]. 의인성 천공 또는 누공은 수술이나 내시경 기구 사용으로 인해 발생하는 것으로 진단적 내시경 검사보다는 pneumatic dilatation이나 경구 내시경 근절개술 등과 같은 치료내시경 시술에 의해 발생할 확률이 유의하게 높으며(0.03%-0.11% vs. 0.3%-9%) [2,3], 식도 수술에 의한 누공은 0%-40% [4-6]의 비율로 발생하는 것으로 알려져 있다. Boerhaave syndrome이나 자발성 식도 파열과 같은 비의인성 천공은 전체 식도 천공의 약 15% 정도의 비중으로 발생하는 것으로 알려져 있으며, 외상이나 악성 종양에 의해서도 발생할 수 있다[4].
증상은 천공의 위치에 따라 다르다. 흉강 내 천공일 경우 retrosternal chest pain이 주로 발생하고 경부 천공일 경우에는 경부 통증 또는 연하곤란, 복강 내 천공일 경우 명치 통증으로 증상이 발현된다. 이학적 소견으로는 피하 기종을 시사하는 마찰음(crepitus)이 나타날 수 있으며[5], 때로는 수 시간 만에 상태가 악화되어 종격동염, 패혈증, 또는 다장기 부전과 사망으로 이어질 수 있다[6].
따라서 조속한 진단과 적절한 임상적 대처가 매우 중요하다. 특히 내시경은 진단 과정에서 천공의 진단에 가장 직접적인 수단으로 활용할 수 있으며, 치료적 처치 후에는 천공이 제대로 해결되고 있는지 면밀히 확인하는 데 중요한 수단의 하나로 활용될 수도 있다. 내시경 외에 천공의 진단과 치료 후 추적에 사용되는 다른 영상 검사로는 흉부 컴퓨터 단층촬영과 식도조영술이 추천된다. 그러나 식도조영술의 경우 식도 천공 진단의 위음성률이 10%까지 되는 것으로 보고되어[7] 식도 천공이 확실하지 않은 경우 환자 상태가 허락한다면 적극적으로 내시경 검사를 시행하여 천공 여부를 확인하는 것이 좋다.
소화성 궤양이나 부식성 물질을 삼킴으로 생기는 비의인성 원인과 내시경적 점막 절제술(EMR) 또는 내시경적 점막하 박리술(ESD)과 같은 고위험 내시경 시술, 또는 위의 수술적 치료에 의한 의인성 천공으로 나눌 수 있다. 위의 ESD에 의한 합병증에 대한 18개의 논문들을 종합하여 분석한 한 연구에 의하면, 위 ESD에 의한 천공의 위험요인으로는 병변의 위치(위 상부 1/3 [8], 중부의 대만곡 부위 [9], 위절제술 후 잔위[10]), 2 cm 이상의 병변 크기[11], 점막하층 침범[12], 점막하층 섬유화[13], 2시간 이상의 긴 시술시간[14,15], 80세 이상의 고령[14], 시술 전 외래 또는 진단내시경 등 업무부담[16] 등으로 알려져 있다. 위에서의 ESD에 의한 천공 발생률은 3.02%로 보고되었으나(16941건 중 512건), 그 중 98%에서는 수술 없이 회복되었다. 대부분의 EMR 또는 ESD 도중에 천공이 발생하며, 지연 천공률은 0.4%-0.7%였다[17]. 위 수술에 의한 누공은 0%-40% [18-20]의 비율로 발생하는 것으로 알려져 있으며, 문합부 주위의 불량한 혈액순환, 문합부의 과도한 긴장 또는 높은 관강 내 압력, 문합부 봉합 실패 등이 원인이 되어 발생한다[5,21-23]. 식도 천공 또는 누공과 마찬가지로 조속한 진단과 치료가 중요하며 내시경이 중요한 역할을 한다.
소화성궤양 등에 의한 비의인성 십이지장 천공의 발생 빈도는 효과적인 위산분비 억제제 덕분에 감소해 왔다. 의인성 원인으로는 십이지장 협착 확장술, 유두절제술을 포함한 EMR, ESD, 초음파내시경 검사, 내시경적 역행성 담췌관담도조영술(ERCP), 수술 등이 있다. 십이지장 벽이 얇기 때문에 십이지장에서의 내시경 시술에 의한 천공 위험이 식도, 위, 대장 등 다른 장관보다 높다. Piecemeal EMR 또는 ESD에 의한 천공 발생률은 2.2%-14.3%로[24-26] 위 또는 식도에서 piecemeal EMR 또는 ESD에 의한 천공 발생률보다 대체적으로 높다. ERCP에 의한 천공 발생률은 1% 이내, 사망률은 7.8%-9.9%로 보고되었다[27-30]. 수술 후 십이지장 누공은 위 절제술 후에 십이지장 잘린끝(duodenal stump)에서 발생하는 형태가 대부분이며 위수술 후 1.6%-5%에서 발생하는 것으로 알려져 있다[31].
의인성 십이지장 천공은 Stapfer 등[29]이 제안한 분류법에 의해 다음과 같이 네가지 타입으로 분류할 수 있으며, 1형부터 4형까지 천공 정도가 심한 정도를 반영한 것으로 이해될 수 있다. 1형 천공은 내시경의 측면 또는 선단에 의해 십지지장 내측 혹은 외측벽에 과도한 힘이 가해져서 발생하는 천공으로 장내 내용물이 복막 내부 또는 후복막으로 누출될 수 있다. 어려운 결석 추출 중에 십이지장경을 강제로 추출하는 경우에도 1형 천공이 발생할 수 있다. EMR 또는 ESD에 의한 천공이 1형 천공에 해당한다고 할 수 있다. 2형 천공은 과도한 유두 괄약근 절개로 유두주위에 발생하는 천공이다. 3형 천공은 안내철심 또는 바스켓 등에 의한 담관 손상을 의미한다. 4형 천공은 육안적 천공은 없으나 십이지장 주변 후복막에 공기만 관찰되는 경우이다[29]. 1형 천공은 전통적으로 수술이 우선적인 치료법으로 알려져 있으며, through-the-scope clip (TTSC) 또는 over-the-scope clip (OTSC)이 시도된 연구들이 있으나 모두 증례 보고 수준이다[26,32]. 2형 또는 3형 천공일 경우 액체 저류가 없고 천공 정도가 심하지 않다면 비수술적 처치로 치유가 가능할 수 있다. 4형 천공에서는 추가 치료는 필요하지 않다.
상부위장관에서 내시경 시술에 의한 의인성 천공 예방을 위해 다음과 같은 조치들을 적극 취해야 한다.
첫째, 시술이 길어질 것으로 예상된다면 전신마취 하에 시술을 시행하는 것을 고려해야 한다. 진정 수면으로 시술을 진행할 경우 뒤로 갈수록 환자의 움직임이 심해져서 시술 시에 돌발적으로 내시경 기구에 의해 위장관 벽이 손상될 확률이 매우 높아진다. 모든 경우를 미리 예측하기는 어려우나 병변이 크거나 위치가 어려운 경우, 또는 식도나 십이지장 같이 시술 난이도가 높은 위치에서 시술을 해야 할 경우 등이 장시간 시술이 예측되는 변수가 될 수 있다.
둘째, 천공 위험이 높을 것으로 예상되는 내시경 시술 시에는 대기 공기 대신에 이산화탄소 사용을 적극 고려한다. 이산화탄소는 조직에 빨리 흡수되므로 천공이 발생할 경우에 대처도 좀 더 용이해질 수 있다. 또한 시술 중에 과도한 위장관내 압력 상승 위험을 줄일 수 있다.
셋째, 내시경 시술 경험이 풍부할수록 천공 위험이 낮아진다. 특히 식도나 십이지장과 같이 공간이 좁거나 각진 부위가 있는 경우에는 특히 충분한 시술 경험이 있는 내시경의가 EMR 또는 ESD 시술을 시행해야 한다.
만약 천공이 발생하였다면 다음과 같이 침착하게 대처하고 관리해야 한다.
우선 천공이 발생한 상황에서 지속적으로 내시경에 의해 공기가 장관으로 주입되면 복강 내 압력이 증가하면서 천공 부위가 보이지 않게 되어 상황이 악화될 수 있다. 이러한 상황이 발생할 경우 16-18 gauge vinca 또는 혈관주사 카테터를 복부의 피부를 통해 복강 내로 삽입하면 공기를 체외로 배출시킬 수 있다. 그러면 복강 내 압력이 떨어지면서 장관 내 공간에 여유가 생기게 되어 상황을 호전시킬 수 있다. 바늘을 삽입하는 위치는 보통 배의 좌상복부, 중앙 또는 하복부 중에서 선택할 수 있으며, 천공의 위치에 따라 공기가 많이 새는 부위가 다양할 수 있으므로 타진하여 가장 공명이 심한 부위를 찌르는 것이 좋다.
둘째, 천공이 발생했다면 입원을 유지하고 금식, 수액 공급, 항생제 정주 등을 유지해야 하며, 비위관을 삽입하여 천공 치료를 도와야 한다. 그러나 혈역학적 불안정성, 심한 복부 강직, 식도정맥류 또는 협착, 혈액 응고장애 등이 있는 상황에서는 비위관 삽입이 상황을 악화시킬 수 있으므로 비위관 삽입의 시기를 조정하거나 신중하게 삽입 여부를 결정해야 한다.
셋째, 식사가 가능한지 결정하기 전에 수용성 조영제를 이용한 위장관 조영술을 시행하여 천공이 잘 막혔는지 확인해야 한다. 식이는 물과 맑은 미음부터 시작한다.
넷째, 천공을 해결하기 위해서는 우선적으로는 내시경을 이용한 치료법을 고려하며, 여러 치료법 중에서 천공의 양상을 고려하여 선택한다. 내시경 치료법에 대한 설명을 이어서 논하도록 하겠다.
상부위장관에 발생한 의인성 천공의 수술적 치료 여부는 진단 시점, 천공 위치, 천공의 크기, 복막염 또는 폐혈증 발생 여부, 영상학적 검사 소견, 내시경 치료의 성공 여부 등의 요인에 따라 결정된다. 식도 천공은 24시간 이내, 위 12시간 이내, 그리고 십이지장은 24시간 이내가 천공 조기 진단의 기준으로 제시되고 있다. 천공 크기에 따라 1 cm 미만일 때는 TTSC, 1 cm 이상일 때는 OTSC, 또는 TTSC+endoloop 조합법 중에 선택하여 내시경적 천공 봉합을 시도할 수 있다. 만약 내시경적 천공 봉합이 실패하거나 컴퓨터 단층촬영에서 조영제의 혈관 외 유출 또는 액체 저류(fluid collection)를 보일 때, 또는 폐혈증이나 임상적으로 불안정한 상태로 악화되는 경우에는 수술적 치료를 고려해야 한다[28,33,34].
상부위장관 천공 또는 수술 후 누출의 상황에서 시도될 수 있는 다양한 내시경 치료법들이 개발되었다. 천공 또는 문합부 누출을 성공적으로 치료하기 위해서는 다학제적인 접근이 매우 중요하다. 한가지 치료만으로 성공적인 치료 효과를 거두기 어려운 경우가 많고, 상황이 변하여 추가적인 치료가 필요할 수도 있다. 상부위장관에서 발생한 수술 후 누출의 내시경 치료 효과에 대한 연구들에서 1차 내시경 치료에 의한 누출 폐쇄 성공률은 50.1%-59.2%, 전체적인 내시경 치료 성공률은 72.9%-81%로 보고되어[35-37] 내시경 치료만으로 수술 후 누출 해결이 어려울 수 있고, 다중의 내시경 치료 시행이 필요할 수 있다는 것을 보여주었다. 이러한 사례들의 예시가 Fig. 1과 2에 제시되었다.
내시경을 통해 천공 또는 누출이 확인되면 어떤 종류의 내시경 시술을 시행할 것인지 결정하기 위해 천공의 위치, 크기, 천공의 경계 상태 등이 평가되어야 한다. 클립 설치술, 스텐트 삽입술, 내시경 봉합, 내시경 음압 치료 등이 상부위장관 천공 또는 누공의 치료에 고려될 수 있다.
연성 내시경용 클립은 내시경의 channel로 삽입할 수 있는 형태의 TTSC와 내시경 끝 부분에 얹혀서 사용하는 형태의 OTSC로 분류할 수 있다.
TTSC는 개발 초기에는 주로 지혈에 사용되었지만 점차 적용 범위가 확장되어 위장관 천공을 봉합하는 용도로도 사용되고 있다. 천공 부위 점막 가장자리 상태가 괴사나 심한 염증이 없는 등 양호하고 천공 크기가 1 cm 미만이라면 식도, 위, 십이지장 어느 위치에서든 TTSC를 천공 부위에 설치하는 것이 가능하다[38]. 제조회사마다 다양한 형태의 클립이 상업적으로 판매되고 있으며, 클립의 다리 부분을 한번 오므리면 다시 펼 수 없는 형태가 주로 사용되었으나, 최근에는 클립 다리를 오므렸다가 다시 펼 수 있는 형태의 클립들도 있어서 천공의 봉합 성공률을 높일 수 있다. 클립으로 천공의 폐쇄를 시도할 때 내시경으로부터 먼 곳에서부터 근위부 방향으로 클립을 설치하는 것이 좋다. 그래야 이미 설치한 클립에 의해 시야가 방해받는 것을 예방할 수 있다. 또한 지퍼를 잠그듯이 천공 양측의 점막이 잘 포개지도록 클립을 설치하도록 해야 한다[39].
TTSC와 endoloop를 이용하여 2 cm 이상의 큰 천공의 폐쇄를 시도할 수 있다. 천공 주위 점막에 2 채널 내시경으로 endoloop를 위치시키면서 TTSC로 고정한 후에 endoloop를 조여서 천공을 폐쇄시키는 방법이다[40]. 또는 천공 부위로 그물막의 지방 조직(omental fat)을 위 안쪽으로 당긴 후에 TTSC를 천공 경계에 같이 고정하는 방법도 있다[41]. 그러나, 상기의 방법들은 소규모 연구로 제시되어 이어서 소개될 최신 내시경 치료법보다 치료 성적이 대등하거나 우월하다고 볼 근거가 매우 미약하다. 또한 주로 위에서 발생한 천공에서 시행하기가 유리하며, 식도나 십이지장에서는 공간이 좁아서 시도가 어려울 수 있다.
OTSCⓇ (Ovesco Endoscopy AG, Tuebingen, Germany)는 좀더 최근에 개발된 클립으로 TTSC보다 더 강력한 폐쇄 기능을 가지고 있다. 국내에서는 2019년부터 사용이 가능하게 되었으며 크기는 세 가지 크기(11, 12, 14 mm)로 제공되고 있다. OTSC는 내시경의 끝에 장착된 투명한 애플리케이터 캡에 장착된 상태로 천공 부위에 접근한 후에 천공 주위의 조직을 캡 안으로 흡인한 후에 클립을 설치할 수 있도록 되어 있다. 이 과정에서 천공의 양 쪽 점막을 각각 독립적으로 잡아서 당길 수 있는 겸자(Twin Grasper; Ovesco Endoscopy AG, Tuebingen, Germany)를 이용하여야 천공 폐쇄를 더 용이하게 할 수 있다. 또 다른 장점으로 TTSC에 비해 OTSC가 더 큰 폐쇄력과 조직을 잡는 힘을 가지고 있다는 것이다. 이는 천공 부위를 더 단단하게 폐쇄시킬 수 있게 한다. TTSC 설치 후 유지기간이 돼지 모델에서 최장 약 4-5주로 보고된 바 있다[42]. 반면 OTSC는 한 연구에서 3달 정도 최초 설치 부위에 유지될 수 있는 것으로 보고되었다[43]. 그러나 천공의 길이가 20 mm보다 크거나 천공 가장자리에 염증성 또는 괴사성 변화가 있는 경우 OTSC 설치가 실패할 수 있다[44]. OTSC의 치료 성적은 급성 천공에서는 상당히 높은 성공률을 보였지만[45,46], 만성 누공 또는 누출을 대상으로 한 연구들에서는 다양한 치료 성공률을 보였다[47-52]. 1-2 cm 크기의 위 또는 식도 천공에서 우선적으로 시도해 볼 수 있다.
개발 초기에는 폐색성 위장관 암을 가진 환자들에 대한 증상 완화 목적으로 사용되어 왔던 스텐트가 식도 천공, 문합부 누출, 그리고 누공의 치료에 효과적인 방법으로 인정받고 있다. 특히 자가팽창형 금속 스텐트(self-expanding metallic stent, SEMS)가 가장 선호되는데, SEMS는 형상기억 합금인 nitinol을 이용하여 망사 형태로 제작되며 길이, 축 지름, 전개 방식이 다양하다. 또한 역류를 방지하기 위해 항역류 밸브(anti-reflux valve)가 있는 SEMS가 있는데, 이는 위식도 접합부위에 스텐트를 설치해야 하는 경우 위산 역류를 예방할 목적으로 선택하면 유용하다. 식도 천공에서는 스텐트 전체가 피막으로 덮인 fully covered SEMS (FCSEMS)가 주로 사용되며 부분적으로 피막이 덮여 있는 partially covered SEMS(PCSEMS)를 사용하는 것도 가능하다.
이러한 피막형 스텐트를 사용할 경우 가장 큰 문제는 스텐트 이탈률이 높다는 것이다[53-55]. 스텐트 이탈을 예방하기 위해 TTSC로 고정하는 방법[56,57], OTSC로 고정하는 방법[58], 그리고 내시경 봉합 시스템으로 고정하는 방법[59]이 제시되어 왔으며, 스텐트 고정을 하지 않을 때보다 스텐트 이탈률을 유의하게 낮추는 것으로 나타났다. OTSC 또는 내시경 봉합 시스템으로 고정하는 방법에 대한 메타분석 결과를 비교해 보면 식도 FCSEMS의 이탈률이 각각 8% (95% confidence interval[CI], 4%-15%), 15.9% (95% CI, 11.4%-21.6%)로 OTSC를 이용한 스텐트 고정법에서 스텐트 이탈률이 좀 더 낮은 것으로 보이나 대상환자군이 서로 다른 연구들을 대상으로 한 분석 결과로 직접 비교는 곤란하다[58,60]. 또한 스텐트 이탈을 방지하기 위한 구조(anti-migration system)를 갖춘 식도 FCSEMS(FCSEMS-ARS)가 개발되었는데, 스텐트 몸체에 두 군데 피막으로 덮인 볼록한 팽대 부위가 있는(double bump) 스텐트(Niti-S Beta™; TaeWoong Medical, Seoul, Korea) [61,62]와 스텐트 몸체 중앙에 피막이 덮이지 않은 볼록한 금속 망사부위가 있는 스텐트(Niti-S Double-Type™; TaeWoong Medical, Seoul, Korea) [63,64]로 분류할 수 있다. 그러나 double-type 스텐트의 경우 비피막형 팽대 부위가 주변 조직에 박혀서 스텐트를 제거하려 할 때 스텐트가 조직으로부터 분리되지 않아 스텐트 제거가 매우 어려워지는 상황이 발생하는 경우가 있다. 두 스텐트에서의 스텐트 제거 실패율을 비교한 연구가 아직 발표된 것이 없지만, 식도 천공 또는 누출의 상황에서는 double-type 스텐트보다는 제거가 좀 더 용이한 팽대 부위가 피막이 덮힌 형태의 스텐트가 더 적합하다.
스텐트 적정 유지 기간에 대해서는 일치된 합의가 되어있지 않다. 식도 천공의 경우 2주 내지 12주까지 스텐트 유지 기간이 연구마다 다양했으며, 많은 저자들이 4-6주 내에 스텐트를 제거할 것을 제안하였다[65-69]. 최소 2주 이상 유지한다는 것에 대해서는 이전 문헌들에서 대체적으로 일치하고 있으므로, 2주 이후부터는 병소의 호전 정도를 추적 관찰하면서 스텐트 유지 기간을 결정하는 전략이 필요하다.
간혹 PCSEMS를 사용할 경우 피막이 덮이지 않은 부위가 주변 조직에 매몰되어 제거가 불가능한 경우가 있는데[70], 이때 FCSEMS를 PCSEMS 안쪽에 설치하여 약 2주간 매몰부위의 점막 조직에 압박 괴사를 유도하여 스텐트를 제거하는 stent-in-stent 제거 테크닉이 효과적이고 안전하다고 보고되었다[71].
SEMS 설치술의 치료효과는 여러 변수에 의해 영향을 받는다. 우선 식도 천공을 초기에 치료할수록 예후는 더 양호하다. Fischer 등[72]은 식도 천공에 스텐트 삽입 시술이 지연될수록 입원 기간이 증가하고 패혈증 또는 장기부전 발생이 증가하였다고 보고하였다. 식도 천공의 위치와 크기에 따라서 스텐트 치료의 효과가 영향을 받을 수 있다. 7년간에 걸쳐 식도 천공, 문합부 누출 또는 누공이 발생한 187명의 환자들을 대상으로 후향적으로 분석한 한 연구에서 경부 식도 또는 위-식도 경계부에 발생한 천공, 크기가 6 cm 이상인 천공일 때 스텐트 치료 성공률이 유의하게 낮은 것으로 나타났다[73].
내시경 봉합 시스템은 식도, 위, 십이지장 천공의 1차 폐쇄 수단으로 활용될 수 있다. 동시에 SEMS 설치 후 이탈을 방지하기 위한 고정용으로 활용할 수도 있다. 내시경 봉합 시스템은 천공으로 인한 장관 벽의 결함 크기가 커서 다른 수단으로 해결되지 않을 정도의 상황에서도 전층에 대한 접근(approximation) 봉합을 가능하게 한다.
상업적으로 사용 가능하고 미국 FDA에서 승인한 첫 번째 내시경 봉합 시스템은 OverStitch™ (Apollo Endosurgery Inc., Austin, TX, USA)이다. 이 시스템은 이중 채널이 있는 치료용 내시경으로만 사용이 가능했다. 2018년에는 Over-Stitch Sx™가 출시되었는데, 이 시스템은 단일 채널 내시경에서도 사용 가능하다. 내시경 봉합 시스템은 바늘을 움직이는 핸들, 제어 헤드에 부착된 봉합 교환 카테터 유닛으로 구성된 핸들 부위와 굽어진 바늘, 조직을 잡는 용동의 헬릭스, 그리고 봉합 유닛으로 구성되어 있는 내시경 선단 부착부로 되어 있다. 곡선 바늘은 조직의 깊은 층까지 천공 부위의 접근 봉합이 가능하도록 하며, 봉합을 한 후에 내시경을 제거하지 않고도 봉합실을 다시 로딩할 수 있다. 그러나, 이 시스템은 아직 국내에 도입되지 않아 사용할 수 없는 상황이다.
2014년에 Henderson 등[74]이 최대 3 cm 크기의 식도 천공 3례에 대해 내시경 봉합 시스템인 Overstitch device (Apollo Endosurgery, Austin, TX, USA)로 성공적인 천공 폐쇄 결과를 보고하였다. 2016년에 8개 기관의 122명의 환자에서 내시경 봉합 시스템의 치료효과를 후향적으로 분석한 논문이 발표되었다. 122명 중에 47명에서는 스텐트 고정, 40명은 누공, 15명은 식도 천공, 20명은 문합부 누출의 치료를 위해 내시경 봉합 시스템이 사용되었는데, 전체적인 시술의 기술적 성공률은 97.5%였고 누공, 천공, 문합부 누출에서의 임상적 성공률은 각각 93%와 80%, 25%였다[59]. 이 연구에서 문합부 누출 환자에서의 임상적 성공률이 현저히 낮은 것은 연구에 포함된 문합부 누출 기간이 30일 이상인 경우가 많았기 때문이다. 연구에 따르면 문합부 누출이 30일이 지난 환자에서 의 시술 성공률은 0%였다.
만성 위장관 누공에서 내시경 봉합 시스템의 치료 성공률이 낮다는 것은 다른 연구에서도 증명되었다. 20명의 만성 누공 환자들(식도: 17명, 위: 2명, 소장: 1명)을 대상으로 Apollo Overstitch 봉합 시스템(Apollo Endosurgery)의 치료 효과를 분석한 후향 연구에서 시술의 기술적 성공률은 100%였으나 시술 후 3개월에 시행한 추적 내시경에서 누공 폐쇄가 성공적으로 유지된 경우는 5명(25%; 식도 3명, 위 1명, 소장 1명)에 불과하였다[75].
위 또는 식도 천공에 의한 합병증으로 천공 주위 공간에 농양이나 액체 고임이 발생한 경우 전통적으로 수술적 또는 컴퓨터 단층촬영 영상 유도 배액술을 시행해 왔다. 최근에는 위장관 천공 또는 수술 후 누출 부위에 음압을 걸어 배액하고 결손 부위에 재생 조직의 생성을 유도하는 endoluminal vacuum therapy (EVT) 또는 endoscopic vacuum-assisted closure device (EVAC) 치료가 각광을 받고 있다. EVT의 치료 목표는 공동(cavity)에 고인 액을 흡수하고 공동을 수축시키며 건강한 육아 조직에 의해 천공 부위가 폐쇄되도록 하는 것이다. EVT는 직장 수술 후에 발생한 문합부의 직장 주위 농양의 배액 수단으로 최초로 사용되었다[76]. 이후 상부위장관 천공 및 누출로 인한 농양의 배액을 위한 치료법으로도 활발히 시도되었다. 식도절제술 또는 위암 수술 후에 식도 천공 또는 문합부 누출이 발생하여 EVT를 시행한 52명의 환자를 대상으로 한 대규모 전향적 임상 연구에서 임상적인 치료 성공률이 94.2%였다[77]. 독일에서 개발된 Endo-sponge (B. Braun Melsungen AG, Melsungen, Germany)는 원래 직장 문합부 누출의 치료용으로 FDA 승인을 받은 EVAC 제품인데, 식도 또는 위 천공 또는 누출로 인한 합병증 관리 목적으로 사용할 수도 있다.
최근 국내에서도 식도 또는 위 수술 후 발생한 문합부 누출에서 EVAC의 우수한 치료 효과가 보고되었다. 식도 수술 후에 문합부 누출이 생긴 20명의 환자를 대상으로 EVAC의 치료 성적을 후향적으로 분석한 한 연구에서 치료 성공률은 95% (19 of 20), 누공 봉합 치료기간은 14.5일이었으며, 수술 전 선행항암치료 시행이 3주 이상의 누출 치료 기간 연장의 유의한 관련 인자로 나타났다[78]. 위 수술 후에 발생한 문합부 누출에 대한 다른 후향 분석 연구에서는 11명의 환자에서 EVAC로 치료하였는데 모든 환자에서 누공이 해결되었고, 누공 봉합 치료기간도 SEMS 치료군에 비해 유의하게 짧았다(15 days vs. 36 days; p<0.001) [79].
EVAC 설치 전에 영상검사를 통해 천공 부위와 연결된 공동을 확인하고 오버튜브를 설치한다. 이후 내시경으로 천공과 연결된 공동을 가능하다면 관찰하고 괴사 조직이나 고인 액체를 제거한다. 그런 다음 EVAC 안에 포함된 스폰지를 공동의 크기에 맞게 자른 다음 비위관의 원위부에 부착하고 움직이지 않도록 고정시킨다. 이렇게 준비가 되면 스폰지가 장착된 비위관을 오버튜브로 밀어 넣고 내시경으로 천공부위까지 위치시킨 후에 스펀지로 덮인 부위를 공동 안쪽으로 넣는다. 비위관의 다른 쪽 끝 부위는 비강을 지나도록 하여 체외에서 음압 펌프에 연결하여 흡인한다. 스펀지 교환은 일반적으로 3-5일마다 시행하도록 되어 있으나 환자 상황이나 기관의 여건에 따라 조정이 가능하다. Laukoetter 등[77]은 평균 6회의 총 스펀지 교환이 필요하다고 보고하였으나, 약 4회 정도로도 충분하다는 연구도 있다[80]. 그러나 내시경을 자주 해야 하는 번거로움이 있고 스폰지로 덮인 관의 위치가 이동하여 효과가 반감될 수 있으며, 내시경 조작으로 천공 부위에 손상을 악화시킬 수 있다는 점을 기억해야 한다.
EVT가 기존의 치료법 중에서 가장 우수한 임상 결과를 보인 SEMS 설치술과 대등하거나 우월한 치료 효과가 있다는 연구 결과들이 보고되고 있다. 2013년부터 2022년까지 발표된 식도 절제술 또는 위 절제술 후에 발생한 문합부 누출에서 EVT와 SEMS의 치료성적을 분석한 8편의 논문들을 대상으로 메타분석(총 환자수: 357명)한 연구에서 EVT가 SEMS에 비해 높은 누출 폐쇄 성공률(odds ratio [OR] 2.58, 95% CI 1.43-4.66), 짧은 치료기간(OR 9.18, 95% CI -17.05--1.32), 낮은 단기 합병증 발생률(OR 0.35, 95% CI 0.18-0.71)과 사망률(OR 0.47, 95% CI 0.24-0.92)을 보이는 것으로 나타났다[81]. 그러나, 상기 메타분석에 포함된 8편의 논문들이 모두 후향적 분석에 기반한 것들이어서 EVT와 SEMS 설치술에 대한 추가적인 대규모 전향적 비교 연구가 필요하다. 현재 독일의 한 연구진에 의해서 EVT와 SEMS 치료에 대한 전향적 무작위 2상 연구(ESOLEAK trial)가 진행 중이다[82].
상부위장관 천공과 누공은 질환에 의해 발생하는 경우와 내시경 치료 또는 수술에 의해 발생하는 경우로 분류할 수 있는데, 어느 경우에서든지 신속한 진단과 치료가 치료 성적과 예후에 절대적으로 중요하다. 천공과 누공 폐쇄를 유도하기 위해 다양한 내시경을 기반으로 한 치료법들이 개발되어 왔으며, 이러한 치료법들은 상부위장관 천공과 누공 환자의 관리에서 매우 중요한 위치를 차지하고 있다. 수술적 치료를 시행하기 전에 내시경적인 접근을 우선적으로 시도하는 것이 매우 익숙하고 자연스러운 것이 현실이다. 수술 후에 천공 또는 누공이 발생한 상황 중에 일부는 추가 수술이 불가능하거나 매우 위험한 상황인 경우가 종종 있어 내시경 치료의 역할은 더욱 중요하게 된다. 따라서 내시경 의사들은 상부위장관에서 천공과 누공이 발생하는 상황에 대해 다양한 내시경 치료법들을 배우고 익숙할 정도로 경험을 쌓는 것이 필수적이다. 미래에 새롭게 시도되고 소개되는 방법들이 계속 나올 가능성이 있어 이 부분에 대해서도 관심을 가져야 한다.
Notes
Fig. 1.
Endoscopic findings of a difficult healing process in patient who underwent total gastrectomy for gastric cancer and had an anastomotic leakage on esophagojejunostomy site. A 7–8 mm sized anastomotic leakage was found on POD #8 (A). The FCSEMS was inserted to cover the leakage site (B). And the fixation with endoclips was done at a prximal site of FCSEMS (C). The FCSEMS was kept upto POD #63 (D). After removing the FCSEMS, the leakage site was aggravated on the same day (E). E-VAC therapy was performed (F). The anastomotic leakage was shown as much improved status, filled by granulation tissue on POD #94 (G). On follow-up endoscopy at POD #185, the leakage site was completely resoluted (H). POD, postoperative day; FCSEMS, full-covered self-expandable metallic stent; E-VAC, endoscopic vacuum assisted closure.
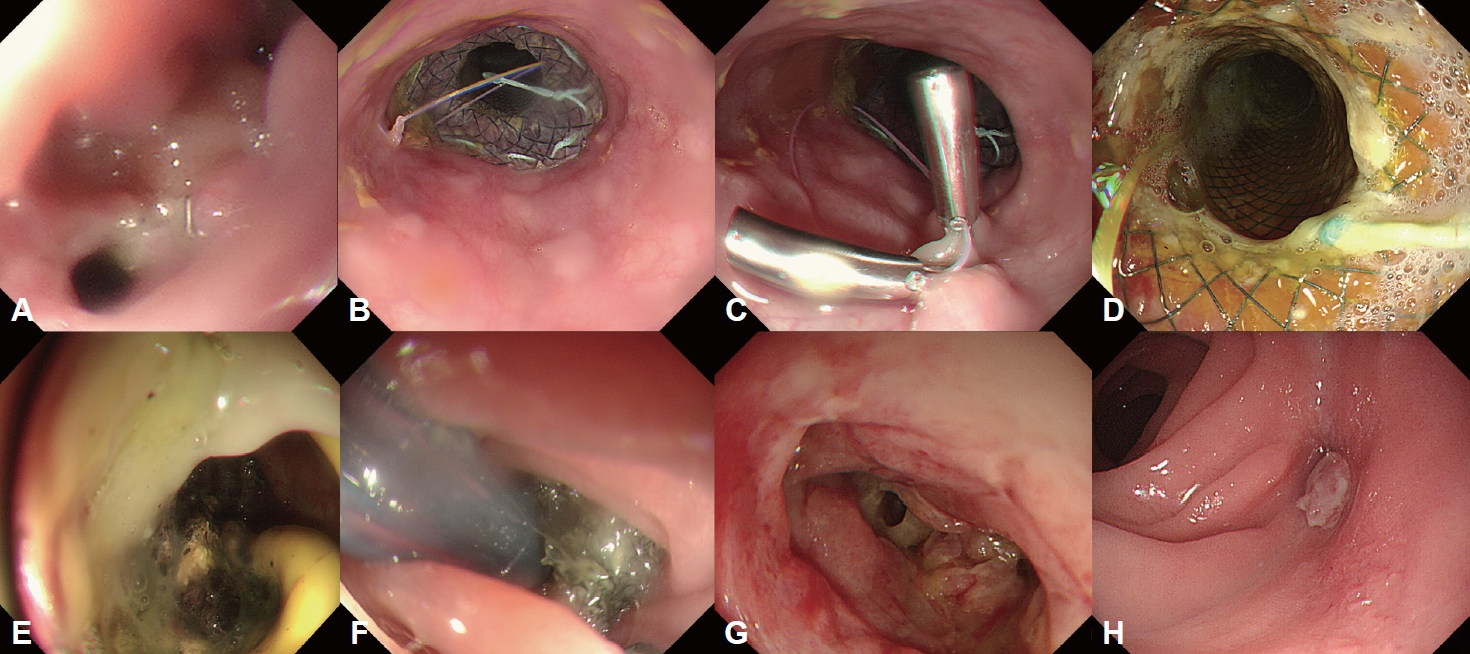
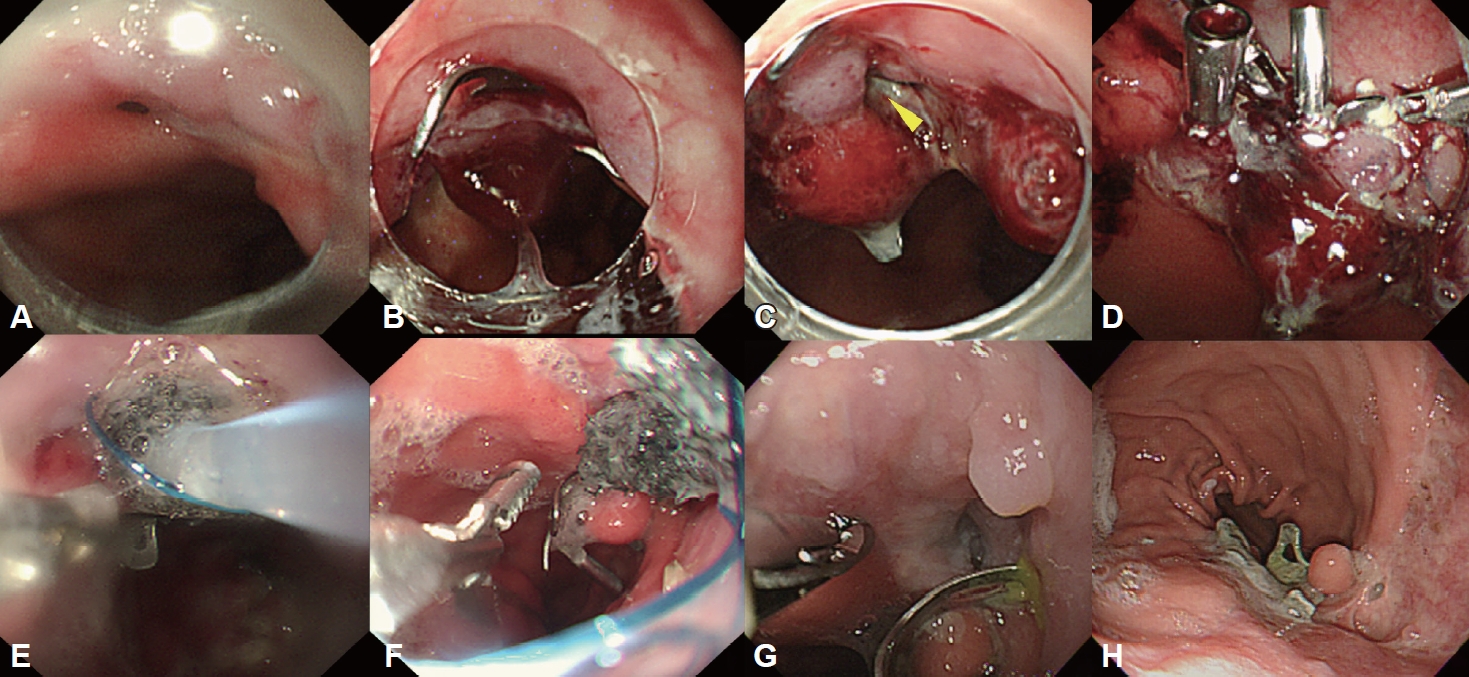
Fig. 2.
The healing process of anastomotic fistula identified at POD #14 in patients with a lower esophageal cancer undergoing the Ivor Lewis esophagectomy. A small-sized (5 mm) anastomotic fistula was found at the esophagogastrostomy site (A). Because fibrotic changes were suspected at the fistula site, OTSC placement was performed (B). However, the fistula site remained unresolved at POD #21, as indicated by an arrowhead (C), and was closed by placing multiple endoclips (D). Despite these manipulations, the fistula site was still not closed. Therefore, E-VAC therapy was performed on POD #25 (E and F). The fistula was sealed by granulation tissue on POD #52 (G). On follow-up endoscopy on POD #183, the fistula site was completely healed (H). POD, postoperative day; OTSC, over-the-scope clip; E-VAC, endoscopic vacuum assisted closure.
REFERENCES
1. Vidarsdottir H, Blondal S, Alfredsson H, Geirsson A, Gudbjartsson T. Oesophageal perforations in Iceland: a whole population study on incidence, aetiology and surgical outcome. Thorac Cardiovasc Surg 2010;58:476–480.


3. Gonzalez JM, Benezech A, Barthet M. Complications of submucosal endoscopy. Best Pract Res Clin Gastroenterol 2016;30:783–791.


4. Weledji EP, Verla V. Failure to rescue patients from early critical complications of oesophagogastric cancer surgery. Ann Med Surg (Lond) 2016;7:34–41.



5. Inokuchi M, Otsuki S, Fujimori Y, Sato Y, Nakagawa M, Kojima K. Systematic review of anastomotic complications of esophagojejunostomy after laparoscopic total gastrectomy. World J Gastroenterol 2015;21:9656–9665.



6. Watanabe M, Miyata H, Gotoh M, et al. Total gastrectomy risk model: data from 20,011 Japanese patients in a nationwide internet-based database. Ann Surg 2014;260:1034–1039.

7. Bladergroen MR, Lowe JE, Postlethwait RW. Diagnosis and recommended management of esophageal perforation and rupture. Ann Thorac Surg 1986;42:235–239.


8. Onozato Y, Ishihara H, Iizuka H, et al. Endoscopic submucosal dissection for early gastric cancers and large flat adenomas. Endoscopy 2006;38:980–986.


9. Kim HJ, Chung H, Jung DH, et al. Clinical outcomes of and management strategy for perforations associated with endoscopic submucosal dissection of an upper gastrointestinal epithelial neoplasm. Surg Endosc 2016;30:5059–5067.



10. Ojima T, Takifuji K, Nakamura M, et al. Complications of endoscopic submucosal dissection for gastric noninvasive neoplasia: an analysis of 647 lesions. Surg Laparosc Endosc Percutan Tech 2014;24:370–374.

11. Imagawa A, Okada H, Kawahara Y, et al. Endoscopic submucosal dissection for early gastric cancer: results and degrees of technical difficulty as well as success. Endoscopy 2006;38:987–990.


12. Kim JH, Nam HS, Choi CW, et al. Risk factors associated with difficult gastric endoscopic submucosal dissection: predicting difficult ESD. Surg Endosc 2017;31:1617–1626.



13. Higashimaya M, Oka S, Tanaka S, et al. Outcome of endoscopic submucosal dissection for gastric neoplasm in relationship to endoscopic classification of submucosal fibrosis. Gastric Cancer 2013;16:404–410.



14. Yoo JH, Shin SJ, Lee KM, et al. Risk factors for perforations associated with endoscopic submucosal dissection in gastric lesions: emphasis on perforation type. Surg Endosc 2012;26:2456–2464.



15. Mannen K, Tsunada S, Hara M, et al. Risk factors for complications of endoscopic submucosal dissection in gastric tumors: analysis of 478 lesions. J Gastroenterol 2010;45:30–36.



16. Lim SM, Park JC, Lee H, Shin SK, Lee SK, Lee YC. Impact of cumulative time on the clinical outcomes of endoscopic submucosal dissection in gastric neoplasm. Surg Endosc 2013;27:1397–1403.



17. Yamamoto Y, Kikuchi D, Nagami Y, et al. Management of adverse events related to endoscopic resection of upper gastrointestinal neoplasms: review of the literature and recommendations from experts. Dig Endosc 2019;31(Suppl 1): 4–20.



18. Lindner K, Fritz M, Haane C, Senninger N, Palmes D, Hummel R. Postoperative complications do not affect long-term outcome in esophageal cancer patients. World J Surg 2014;38:2652–2661.



19. Blencowe NS, Strong S, McNair AG, et al. Reporting of short-term clinical outcomes after esophagectomy: a systematic review. Ann Surg 2012;255:658–666.

20. Whooley BP, Law S, Alexandrou A, Murthy SC, Wong J. Critical appraisal of the significance of intrathoracic anastomotic leakage after esophagectomy for cancer. Am J Surg 2001;181:198–203.


21. Hummel R, Bausch D. Anastomotic leakage after upper gastrointestinal surgery: surgical treatment. Visc Med 2017;33:207–211.




22. Bracale U, Peltrini R, De Luca M, et al. Predictive factors for anastomotic leakage after laparoscopic and open total gastrectomy: a systematic review. J Clin Med 2022;11:5022.



23. Jeong SH, Lee JK, Seo KW, Min JS. Treatment and prevention of postoperative leakage after gastrectomy for gastric cancer. J Clin Med 2023;12:3880.



24. Inoue T, Uedo N, Yamashina T, et al. Delayed perforation: a hazardous complication of endoscopic resection for non-ampullary duodenal neoplasm. Dig Endosc 2014;26:220–227.


25. Fanning SB, Bourke MJ, Williams SJ, Chung A, Kariyawasam VC. Giant laterally spreading tumors of the duodenum: endoscopic resection outcomes, limitations, and caveats. Gastrointest Endosc 2012;75:805–812.


26. Jung JH, Choi KD, Ahn JY, et al. Endoscopic submucosal dissection for sessile, nonampullary duodenal adenomas. Endoscopy 2013;45:133–135.


27. Andriulli A, Loperfido S, Napolitano G, et al. Incidence rates of post-ERCP complications: a systematic survey of prospective studies. Am J Gastroenterol 2007;102:1781–1788.


28. Paspatis GA, Arvanitakis M, Dumonceau JM, et al. Diagnosis and management of iatrogenic endoscopic perforations: European Society of Gastrointestinal Endoscopy (ESGE) position statement - update 2020. Endoscopy 2020;52:792–810.


29. Stapfer M, Selby RR, Stain SC, et al. Management of duodenal perforation after endoscopic retrograde cholangiopancreatography and sphincterotomy. Ann Surg 2000;232:191–198.



30. Nakamura K, Yamaguchi Y, Hasue T, et al. The usefulness and safety of carbon dioxide insufflation during endoscopic retrograde cholangiopancreatography in elderly patients: a prospective, double-blind, randomized, controlled trial. Hepatogastroenterology 2014;61:2191–2195.

31. Aurello P, Sirimarco D, Magistri P, et al. Management of duodenal stump fistula after gastrectomy for gastric cancer: systematic review. World J Gastroenterol 2015;21:7571–7576.



32. Gubler C, Bauerfeind P. Endoscopic closure of iatrogenic gastrointestinal tract perforations with the over-the-scope clip. Digestion 2012;85:302–307.



33. Paspatis GA, Dumonceau JM, Barthet M, et al. Diagnosis and management of iatrogenic endoscopic perforations: European Society of Gastrointestinal Endoscopy (ESGE) position statement. Endoscopy 2014;46:693–711.


34. Schmidt A, Fuchs KH, Caca K, Küllmer A, Meining A. The endoscopic treatment of iatrogenic gastrointestinal perforation. Dtsch Arztebl Int 2016;113:121–128.



35. Smith ZL, Park KH, Llano EM, et al. Outcomes of endoscopic treatment of leaks and fistulae after sleeve gastrectomy: results from a large multicenter U.S. cohort. Surg Obes Relat Dis 2019;15:850–855.


36. Rodrigues-Pinto E, Pereira P, Sousa-Pinto B, et al. Retrospective multicenter study on endoscopic treatment of upper GI postsurgical leaks. Gastrointest Endosc 2021;93:1283–1299.e2.


37. Deffain A, Alfaris H, Hajjar R, et al. Long-term follow-up of a cohort with post sleeve gastrectomy leaks: results of endoscopic treatment and salvage surgery. Surg Endosc 2023;37:9358–9365.



38. Watkins JR, Farivar AS. Endoluminal therapies for esophageal perforations and leaks. Thorac Surg Clin 2018;28:541–554.


39. Stavropoulos SN, Modayil R, Friedel D. Closing perforations and postperforation management in endoscopy: esophagus and stomach. Gastrointest Endosc Clin N Am 2015;25:29–45.

40. Maekawa S, Nomura R, Murase T, Ann Y, Harada M. Complete closure of artificial gastric ulcer after endoscopic submucosal dissection by combined use of a single over-the-scope clip and through-thescope clips (with videos). Surg Endosc 2015;29:500–504.



41. Sachdev AH, Iqbal S, Ribeiro IB, de Moura DTH. Use of omental patch and endoscopic closure technique as an alternative to surgery after endoscopic full thickness resection of gastric intestinal stromal tumors: a series of cases. World J Clin Cases 2020;8:120–125.



42. Shin EJ, Ko CW, Magno P, et al. Comparative study of endoscopic clips: duration of attachment at the site of clip application. Gastrointest Endosc 2007;66:757–761.


43. Schmidt A, Beyna T, Schumacher B, et al. Colonoscopic full-thickness resection using an over-the-scope device: a prospective multicentre study in various indications. Gut 2018;67:1280–1289.


44. Hagel AF, Naegel A, Lindner AS, et al. Over-the-scope clip application yields a high rate of closure in gastrointestinal perforations and may reduce emergency surgery. J Gastrointest Surg 2012;16:2132–2138.



45. Weiland T, Fehlker M, Gottwald T, Schurr MO. Performance of the OTSC system in the endoscopic closure of iatrogenic gastrointestinal perforations: a systematic review. Surg Endosc 2013;27:2258–2274.



46. Li Y, Wu JH, Meng Y, Zhang Q, Gong W, Liu SD. New devices and techniques for endoscopic closure of gastrointestinal perforations. World J Gastroenterol 2016;22:7453–7462.



47. Honegger C, Valli PV, Wiegand N, Bauerfeind P, Gubler C. Establishment of Over-The-Scope-Clips (OTSC®) in daily endoscopic routine. United European Gastroenterol J 2017;5:247–254.



48. Surace M, Mercky P, Demarquay JF, et al. Endoscopic management of GI fistulae with the over-the-scope clip system (with video). Gastrointest Endosc 2011;74:1416–1419.


49. Kirschniak A, Subotova N, Zieker D, Königsrainer A, Kratt T. The Over-The-Scope Clip (OTSC) for the treatment of gastrointestinal bleeding, perforations, and fistulas. Surg Endosc 2011;25:2901–2905.



50. Albert JG, Friedrich-Rust M, Woeste G, et al. Benefit of a clipping device in use in intestinal bleeding and intestinal leakage. Gastrointest Endosc 2011;74:389–397.


51. Sandmann M, Heike M, Faehndrich M. Application of the OTSC system for the closure of fistulas, anastomosal leakages and perforations within the gastrointestinal tract. Z Gastroenterol 2011;49:981–985.


52. Haito-Chavez Y, Law JK, Kratt T, et al. International multicenter experience with an over-the-scope clipping device for endoscopic management of GI defects (with video). Gastrointest Endosc 2014;80:610–622.


53. Alazmi W, Al-Sabah S, Ali DA, Almazeedi S. Treating sleeve gastrectomy leak with endoscopic stenting: the Kuwaiti experience and review of recent literature. Surg Endosc 2014;28:3425–3428.



54. El Mourad H, Himpens J, Verhofstadt J. Stent treatment for fistula after obesity surgery: results in 47 consecutive patients. Surg Endosc 2013;27:808–816.



55. van Wezenbeek MR, de Milliano MM, Nienhuijs SW, Friederich P, Gilissen LP. A specifically designed stent for anastomotic leaks after bariatric surgery: experiences in a tertiary referral hospital. Obes Surg 2016;26:1875–1880.



56. Boyanov N, Shtereva K, Madzharova K, Kirkov L, Shopov N, Andonov V. Prevention of migration of esophageal self-expandable metallic stents using endoscopic clips. Medicina (Kaunas) 2023;59:2035.



57. Vanbiervliet G, Filippi J, Karimdjee BS, et al. The role of clips in preventing migration of fully covered metallic esophageal stents: a pilot comparative study. Surg Endosc 2012;26:53–59.



58. Jena A, Chandnani S, Jain S, Sharma V, Rathi P. Efficacy of endoscopic over-the-scope clip fixation for preventing migration of selfexpandable metal stents: a systematic review and meta-analysis. Surg Endosc 2023;37:3410–3418.



59. Sharaiha RZ, Kumta NA, DeFilippis EM, et al. A large multicenter experience with endoscopic suturing for management of gastrointestinal defects and stent anchorage in 122 patients: a retrospective review. J Clin Gastroenterol 2016;50:388–392.

60. Law R, Prabhu A, Fujii-Lau L, Shannon C, Singh S. Stent migration following endoscopic suture fixation of esophageal self-expandable metal stents: a systematic review and meta-analysis. Surg Endosc 2018;32:675–681.



61. Conio M, Savarese MF, Filiberti RA, et al. Palliation of malignant esophageal obstruction using an anti-migration self-expandable metal stent: results of a prospective multicenter study. Clin Res Hepatol Gastroenterol 2021;45:101683.


62. Boerlage TCC, Houben GPM, Groenen MJM, et al. A novel fully covered double-bump stent for staple line leaks after bariatric surgery: a retrospective analysis. Surg Endosc 2018;32:3174–3180.




63. Gonzalez JM, Garces Duran R, Vanbiervliet G, et al. Double-type metallic stents efficacy for the management of post-operative fistulas, leakages, and perforations of the upper gastrointestinal tract. Surg Endosc 2015;29:2013–2018.



64. Hussain Z, Diamantopoulos A, Krokidis M, Katsanos K. Doublelayered covered stent for the treatment of malignant oesophageal obstructions: systematic review and meta-analysis. World J Gastroenterol 2016;22:7841–7850.



65. Gurwara S, Clayton S. Esophageal perforations: an endoscopic approach to management. Curr Gastroenterol Rep 2019;21:57.



66. Baron TH, Song LMWK, Zielinski MD, Emura F, Fotoohi M, Kozarek RA. A comprehensive approach to the management of acute endoscopic perforations (with videos). Gastrointest Endosc 2012;76:838–859.


67. Romero RV, Goh KL. Esophageal perforation: continuing challenge to treatment. Gastrointest Interv 2013;2:1–6.

68. van Heel NC, Haringsma J, Spaander MC, Bruno MJ, Kuipers EJ. Short-term esophageal stenting in the management of benign perforations. Am J Gastroenterol 2010;105:1515–1520.



69. Dabizzi E, De Ceglie A, Kyanam Kabir Baig KR, Baron TH, Conio M, Wallace MB. Endoscopic “rescue” treatment for gastrointestinal perforations, anastomotic dehiscence and fistula. Clin Res Hepatol Gastroenterol 2016;40:28–40.


70. Sharma P, Kozarek R.; Practice Parameters Committee of American College of Gastroenterology. Role of esophageal stents in benign and malignant diseases. Am J Gastroenterol 2010;105:258–273; quiz 274.



71. DaVee T, Irani S, Leggett CL, et al. Stent-in-stent technique for removal of embedded partially covered self-expanding metal stents. Surg Endosc 2016;30:2332–2341.



72. Fischer A, Thomusch O, Benz S, von Dobschuetz E, Baier P, Hopt UT. Nonoperative treatment of 15 benign esophageal perforations with self-expandable covered metal stents. Ann Thorac Surg 2006;81:467–472.


73. Freeman RK, Ascioti AJ, Giannini T, Mahidhara RJ. Analysis of unsuccessful esophageal stent placements for esophageal perforation, fistula, or anastomotic leak. Ann Thorac Surg 2012;94:959–964; discussion 964-965.


74. Henderson JB, Sorser SA, Atia AN, Catalano MF. Repair of esophageal perforations using a novel endoscopic suturing system. Gastrointest Endosc 2014;80:535–537.


75. Jin D, Xu M, Huang K, et al. The efficacy and long-term outcomes of endoscopic full-thickness suturing for chronic gastrointestinal fistulas with an Overstitch device: is it a durable closure? Surg Endosc 2022;36:1347–1354.



76. Weidenhagen R, Gruetzner KU, Wiecken T, Spelsberg F, Jauch KW. Endoscopic vacuum-assisted closure of anastomotic leakage following anterior resection of the rectum: a new method. Surg Endosc 2008;22:1818–1825.



77. Laukoetter MG, Mennigen R, Neumann PA, et al. Successful closure of defects in the upper gastrointestinal tract by endoscopic vacuum therapy (EVT): a prospective cohort study. Surg Endosc 2017;31:2687–2696.



78. Min YW, Kim T, Lee H, et al. Endoscopic vacuum therapy for postoperative esophageal leak. BMC Surg 2019;19:37.




79. Choi SI, Park JC, Jung DH, Shin SK, Lee SK, Lee YC. Efficacy of endoscopic vacuum-assisted closure treatment for postoperative anastomotic leak in gastric cancer. Gut Liver 2020;14:746–754.



80. Bludau M, Hölscher AH, Herbold T, et al. Management of upper intestinal leaks using an endoscopic vacuum-assisted closure system (EVAC). Surg Endosc 2014;28:896–901.



-
METRICS

-
- 0 Crossref
- 1,166 View
- 19 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Endoscopic Treatment and Prevention of Acute Variceal Hemorrhage2024 March;24(1)
Artificial Intelligence in the Analysis of Upper Gastrointestinal Disorders2021 December;21(4)
Endoscopic Resection of Gastrointestinal Stromal Tumor: Is It Safe?2021 September;21(3)
Timing of Endoscopy for Acute Upper Gastrointestinal Bleeding2021 September;21(3)






