 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 19(3); 2019 > Article |
|
Abstract
Although surgical resection is the mainstay of treatment for resectable esophageal cancer, it is associated with considerable morbidity and mortality. Endoscopic resection, including endoscopic mucosal resection and endoscopic submucosal dissection, has been considered as a feasible alternative to surgical resection for superficial esophageal squamous cell carcinoma based on its minimal invasiveness and favorable outcomes in suitable indications. The long-term outcomes of endoscopic resection are comparable to those of surgery when tumors are confined to the intraepithelial or lamina propria layer because these tumors have low or no risk of lymph node metastasis. The results of histopathological examination of the resected specimens should be interpreted thoroughly regarding the requirement of additional treatment. Treatment-related adverse events include bleeding, perforation, and stricture. Preventive measures should be taken during and after the procedure, particularly when the mucosal defects account for more than three-fourths of the circumference. In this review, the indications and outcomes of endoscopic treatment for esophageal squamous cell carcinoma are summarized.
ņŗØļÅäņĢöņØĆ ņ¦äļŗ©Ļ│╝ ņ╣śļŻī ļ░®ļ▓ĢņØś ļ░£ņĀäņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņśłĒøäĻ░Ć ļ¦żņÜ░ ļČłļ¤ēĒĢ£ ņ£äņןĻ┤Ć ņĢö ņżæņØś ĒĢśļéśņØ┤ļŗż. ņØ┤ļŖö ņŗØļÅäņĢöņØ┤ ņØ┤ļ»Ė ņ¦äĒ¢ēļÉ£ ņāüĒā£ņŚÉņä£ ļ░£Ļ▓¼ļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄĻ│Ā ļ”╝ĒöäņĀł ņĀäņØ┤Ļ░Ć ĒØöĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż[1]. ņĀłņĀ£Ļ░ĆļŖźĒĢ£ ņŗØļÅäņĢöņØś Ēæ£ņżĆ ņ╣śļŻīļŖö ņŗØļÅä ņĀłņĀ£ņłĀņØ┤ņ¦Ćļ¦ī ņłśņłĀņŚÉ ļö░ļź┤ļŖö ņØ┤ĒÖśņ£©Ļ│╝ ņé¼ļ¦ØļźĀņØ┤ ļåÆĻ│Ā ņłśņłĀ Ēøä ņéČņØś ņ¦łņØä ĒÜīļ│ĄĒĢśĻĖ░Ļ╣īņ¦Ć ĻĖ┤ ņŗ£Ļ░äņØ┤ ĒĢäņÜöĒĢśļŗżļŖö ņĀ£ĒĢ£ņĀÉņØ┤ ņ׳ļŗż[2,3]. ļ”╝ĒöäņĀł ņĀäņØ┤ Ļ░ĆļŖźņä▒ņØ┤ ņŚåļŖö ņØ╝ļČĆ Ēæ£ņ×¼ņä▒ ņŗØļÅäņĢö(superficial esophageal cancer)ņŚÉ ļīĆĒĢ£ ĻĘ╝ņ╣śņĀü ņĀłņĀ£ ļ¬®ņĀüņ£╝ļĪ£ ļé┤ņŗ£Ļ▓Į ņ╣śļŻīĻ░Ć ņŗ£Ē¢ēļÉśĻ│Ā ņ׳ņ£╝ļ®░, ņŚäĻ▓®ĒĢ£ ņĀüņÜ® ĻĖ░ņżĆņŚÉ ļö░ļź┤ļ®┤ ņ╣śļŻī Ēøä ņāØņĪ┤ņ£©ņØ┤ ņłśņłĀĻ│╝ ļīĆļō▒ĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[4]. ņä£ĻĄ¼ņŚÉņä£ļŖö ņŗØļÅä ņāśņĢöņóģ(adenocarcinoma)ņØ┤ ĻĖēĻ▓®Ē׳ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ņ£╝ļéś ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ ļ░£ņāØĒĢśļŖö ņŗØļÅäņĢöņØĆ ļīĆļČĆļČäņØ┤ ĒÄĖĒÅēņäĖĒżņĢöņóģ(squamous cell carcinoma)ņ£╝ļĪ£[5], ļ│Ė ņøÉĻ│ĀņŚÉņä£ļŖö ĒÄĖĒÅēņäĖĒżņĢöņóģņØś ļé┤ņŗ£Ļ▓Į ņ╣śļŻīņŚÉ ļīĆĒĢśņŚ¼ ĻĖ░ņłĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
Ēæ£ņ×¼ņä▒ ņŗØļÅäņĢöņØĆ ļ”╝ĒöäņĀł ņĀäņØ┤ņŚÉ Ļ┤ĆĻ│ä ņŚåņØ┤ ņĀÉļ¦ēņĖĄĻ│╝ ņĀÉļ¦ēĒĢśņĖĄņŚÉ ĻĄŁĒĢ£ļÉ£ ņŗØļÅäņĢöņ£╝ļĪ£ ņĀĢņØśĒĢśļ®░, ĻĘĖņżæ ļ”╝ĒöäņĀł ņĀäņØ┤Ļ░Ć ņŚåņ£╝ļ®┤ņä£ ņĀÉļ¦ēņŚÉ ĻĄŁĒĢ£ļÉ£ ņŗØļÅäņĢöņØä ņĪ░ĻĖ░ ņŗØļÅäņĢö(early esophageal cancer)ņØ┤ļØ╝Ļ│Ā ĒĢ£ļŗż. ļé┤ņŗ£Ļ▓Į ņ╣śļŻīņØś ņØ┤ņāüņĀüņØĖ ļ¬®Ēæ£ļŖö ņØ╝Ļ┤ä ņĀłņĀ£ ļ░Å ĻĘ╝ņ╣śņĀü ņĀłņĀ£ņØ┤ļ»ĆļĪ£ ņĪ░ĻĖ░ ņŗØļÅäņĢöĻ│╝ ļ”╝ĒöäņĀł ņĀäņØ┤ Ļ░ĆļŖźņä▒ņØ┤ ļé«ņØĆ ņØ╝ļČĆ Ēæ£ņ×¼ņä▒ ņŗØļÅäņĢöņØ┤ ļé┤ņŗ£Ļ▓Į ņ╣śļŻīņØś ļīĆņāüņØ┤ ļÉ£ļŗż.
ņ╣śļŻī ņĀä ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīī, ņ╗┤Ēō©Ēä░ļŗ©ņĖĄņ┤¼ņśü, ņ¢æņĀäņ×É ļ░®ņČ£ ļŗ©ņĖĄņ┤¼ņśü ļō▒ņØś Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ļ”╝ĒöäņĀł ļ░Å ņøÉĻ▓® ņĀäņØ┤ ņŚ¼ļČĆļź╝ ĒÖĢņØĖĒĢśĻ│Ā ņ×äņāü ļ│æĻĖ░ļź╝ ņäżņĀĢĒĢśļŖö Ļ│╝ņĀĢņØ┤ ĒĢäņÜöĒĢśļŗż[2]. ņŗØļÅäņĢöņØś ĻĄŁņåīņ╣©ņ£ż Ļ╣ŖņØ┤ļź╝ ņśłņĖĪĒĢśļŖö ļŹ░ņŚÉļŖö ļé┤ņŗ£Ļ▓Įņ£╝ļĪ£ Ļ┤Ćņ░░ļÉ£ ņ£ĪņĢł ĒśĢĒā£Ļ░Ć ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢ£ļŗż. ņ£ĪņĢłņĀü Ļ┤Ćņ░░ņŚÉ ļö░ļźĖ 0-IĒśĢ(Ēæ£ļ®┤ņ£ĄĻĖ░ĒśĢ) ļśÉļŖö 0-IIIĒśĢ(Ēæ£ļ®┤ĒĢ©ļ¬░ĒśĢ)ņŚÉņä£ļŖö 0-IIĒśĢ(ĒÅēĒāäĒśĢ)Ļ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņĀÉļ¦ēĒĢś ņ╣©ņ£żņØ┤ ļŹö ļ¦ÄĻ│Ā, ĒÄĖĒÅēĒĢśņ¦Ć ņĢŖņØĆ ņ£ĪņĢł ĒśĢĒā£(0-IIaĒśĢ ļśÉļŖö 0-IIcĒśĢ) ļśÉĒĢ£ ņĀÉļ¦ēĒĢśņĖĄņ£╝ļĪ£ņØś ņ╣©ņ£żņØä ņŗ£ņé¼ĒĢśļ»ĆļĪ£ ļé┤ņŗ£Ļ▓Į ņ╣śļŻīņØś ļīĆņāüņ£╝ļĪ£ļŖö ņĀüĒĢ®ĒĢśņ¦Ć ņĢŖļŗż[6-8]. Ēæ£ļ®┤ņØ┤ ĻĘĀņØ╝ĒĢśņ¦Ć ņĢŖĻ▒░ļéś Ļ▓░ņĀłņāü ļśÉļŖö Ļ│╝ļ”ĮņāüņØ┤ Ļ┤Ćņ░░ļÉśļŖö Ļ▓ĮņÜ░ņŚÉļÅä ņĀÉļ¦ēĒĢśņĖĄ ņ╣©ņ£ż Ļ░ĆļŖźņä▒ņØ┤ ļåÆņ£╝ļ»ĆļĪ£ ņŻ╝ņØśĒĢ┤ņĢ╝ ĒĢ£ļŗż[9]. ņØ┤ņÖĖņŚÉļÅä ļŻ©Ļ│© ņÜ®ņĢĪņØä ļ╣äļĪ»ĒĢ£ ņāēņåī ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ĒåĄĒĢśņŚ¼ ļ│æļ│ĆņØś Ēü¼ĻĖ░ņÖĆ ļ▓öņ£äļź╝ ļ│┤ļŗż ļ¬ģĒÖĢĒĢśĻ▓ī ĒīīņĢģĒĢĀ ņłś ņ׳ņ£╝ļ®░, ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņÖĆ ņØ┤ļ»Ėņ¦Ć ņ”ØĻ░Ģ ļé┤ņŗ£Ļ▓Į ĻĖ░ļ▓ĢņØä ĒÖ£ņÜ®ĒĢśņŚ¼ ņČöĻ░ĆņĀüņØĖ ņĀĢļ│┤ļź╝ ņ¢╗ņØä ņłś ņ׳ļŗż[10,11].
ņŗØļÅäņĢöņØś ņ╣śļŻī ņĀäļץņØä ņłśļ”ĮĒĢśļŖö ļŹ░ ņ׳ņ¢┤ Ļ░Ćņן ņżæņÜöĒĢ£ ņÜöņåīļŖö ĻĄŁņåī ļ”╝ĒöäņĀł ņĀäņØ┤ Ļ░ĆļŖźņä▒ņØä ņśłņĖĪĒĢśļŖö Ļ▓āņØ┤ļŗż. ļ”╝ĒöäņĀł ņĀäņØ┤ ņ£äĒŚśĻ│╝ ņŚ░Ļ┤ĆļÉ£ ņØĖņ×ÉļĪ£ļŖö ļ│æļ│ĆņØś Ēü¼ĻĖ░, ņ£ĪņĢł ĒśĢĒā£, ļ”╝ĒöäĻ┤Ć ņ╣©ņ£ż(lymphatic invasion) ļō▒ņØ┤ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░, ĒŖ╣Ē׳ ņŗØļÅäņĢöņØś ĻĄŁņåīņ╣©ņ£ż ņĀĢļÅäĻ░Ć ļ”╝ĒöäņĀł ņĀäņØ┤ņÖĆ ļ░ĆņĀæĒĢ£ Ļ┤ĆĻ│äĻ░Ć ņ׳ļŗż[6,7,12-15]. Ēæ£ņ×¼ņä▒ ņŗØļÅäņĢöņ£╝ļĪ£ ņłśņłĀņØä ļ░øņØĆ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ļČäņäØ Ļ▓░Ļ│╝ ņŗØļÅäņĢöņØ┤ ņāüĒö╝ļé┤(intraepithelial, M1) ļśÉļŖö ņĀÉļ¦ēĻ│Āņ£ĀņĖĄ(lamina propria, M2)ņŚÉ ĻĄŁĒĢ£ļÉ£ Ļ▓ĮņÜ░ 0~5.6%ņŚÉņä£ ļ”╝ĒöäņĀł ņĀäņØ┤Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, ņóģņ¢æņØ┤ ņĀÉļ¦ēĻĘ╝ņĖĄ(muscularis mucosa, M3)Ļ╣īņ¦Ć ņ╣©ļ▓öĒĢśĻ▒░ļéś ņĀÉļ¦ēĒĢśņĖĄņ£╝ļĪ£ņØś ņ╣©ņ£żņØ┤ 200 ╬╝m ņØ┤ļé┤ņØĖ Ļ▓ĮņÜ░(submucosa 1, SM1) ļ”╝ĒöäņĀł ņĀäņØ┤ņØś ļ╣łļÅäļŖö Ļ░üĻ░ü 9.0~25.0%, 15.0~53.1%ļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż[6,12,16]. ļö░ļØ╝ņä£ ņĀÉļ¦ēņĢö ņżæņŚÉņä£ļÅä ļ”╝ĒöäņĀł ņĀäņØ┤ Ļ░ĆļŖźņä▒ņØ┤ Ļ▒░ņØś ņŚåļŖö ņāüĒö╝ļé┤ ļśÉļŖö ņĀÉļ¦ēĻ│Āņ£ĀņĖĄņŚÉ ĻĄŁĒĢ£ļÉ£ Ļ▓ĮņÜ░ļź╝ ļé┤ņŗ£Ļ▓Į ņ╣śļŻīņØś ņĀłļīĆ ņĀüņØæņ”Øņ£╝ļĪ£ ņĀĢņØśĒĢ£ļŗż.
ņØ╝ļ│ĖĻ│╝ ņ£Āļ¤Į, ļ»ĖĻĄŁ Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉņä£ļŖö ņóģņ¢æņØ┤ M3 ļśÉļŖö SM1Ļ╣īņ¦Ć ņ╣©ņ£żĒĢśņśĆļŹöļØ╝ļÅä ļ»ĖņäĖĒśłĻ┤Ć ļśÉļŖö ļ”╝ĒöäĻ┤ĆņŚÉ ņĢöņäĖĒż ņ╣©ņ£żņØ┤ ņŚåļŗżļ®┤ ļ”╝ĒöäņĀł ņĀäņØ┤ņØś ņ£äĒŚśņØ┤ ļé«ņ£╝ļ»ĆļĪ£ ļé┤ņŗ£Ļ▓Į ņ╣śļŻīņØś ņāüļīĆ ņĀüņØæņ”Ø ļśÉļŖö ĒÖĢļīĆ ņĀüņØæņ”Øņ£╝ļĪ£ Ļ│ĀļĀżĒĢ┤ļ│╝ ņłś ņ׳ļŗżĻ│Ā ĻĖ░ņłĀĒĢśĻ│Ā ņ׳ļŗż[8,17,18]. ĻĘĖļ¤¼ļéś ņ╣©ņ£ż Ļ╣ŖņØ┤Ļ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ļ”╝ĒöäņĀł ņĀäņØ┤ ņ£äĒŚśņä▒ņØ┤ Ļ░ĆĒīīļź┤Ļ▓ī ņ”ØĻ░ĆĒĢśļ»ĆļĪ£ ņ╣śļŻī ņĀä ĒÅēĻ░Ć Ļ▓░Ļ│╝Ļ░Ć M3 ļśÉļŖö SM1 ņ╣©ņ£żņØä ņŗ£ņé¼ĒĢ£ļŗżļ®┤ ļé┤ņŗ£Ļ▓Į ņ╣śļŻīļ│┤ļŗżļŖö ņłśņłĀņØ┤ ņČöņ▓£ļÉśļ®░, ņłśņłĀņŚÉ ļö░ļźĖ ņ£äĒŚśņØ┤ ļåÆņØĆ ņØ╝ļČĆ ĒÖśņ×ÉņŚÉņä£ ņäĀĒāØņĀüņ£╝ļĪ£ ļé┤ņŗ£Ļ▓Į ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ļŗż.
ļé┤ņŗ£Ļ▓Į ņ╣śļŻī Ēøä ņĀłņĀ£ ņĪ░ņ¦üņŚÉ ļīĆĒĢ£ ļ│æļ”¼ņĪ░ņ¦üĒĢÖņĀü Ļ▓Ćņé¼ Ļ▓░Ļ│╝ņŚÉ ļö░ļØ╝ ĻĘ╝ņ╣śņĀü ņ╣śļŻīļĪ£ ĒīÉļŗ©ĒĢĀ Ļ▓āņØĖņ¦Ć ņČöĻ░Ć ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢĀ Ļ▓āņØĖņ¦Ćļź╝ Ļ▓░ņĀĢĒĢ£ļŗż. ņŗØļÅäņĢöņØ┤ ņĀÉļ¦ēĻĘ╝ņĖĄņØä ņ╣©ņ£żĒĢśņśĆļŹöļØ╝ļÅä ņØ╝Ļ┤ä ņÖäņĀä ņĀłņĀ£ļÉśņŚłĻ│Ā ļČäĒÖöļÅäĻ░Ć ņóŗņ£╝ļ®┤ņä£ ļ»ĖņäĖĒśłĻ┤Ć ļśÉļŖö ļ”╝ĒöäĻ┤Ć ņ╣©ņ£żņØ┤ ņŚåļŗżļ®┤ ņČöĻ░Ć ņ╣śļŻī ņŚåņØ┤ ņĪ░ņŗ¼ņŖżļ¤ĮĻ▓ī Ļ▓ĮĻ│╝ļź╝ Ļ┤Ćņ░░ĒĢ┤ļ│╝ ņłś ņ׳ļŗż[12,17]. ļ│æļ│ĆņØ┤ ļČłņÖäņĀä ņĀłņĀ£ļÉśņŚłĻ▒░ļéś ņĀÉļ¦ēĒĢśņĖĄ ņ╣©ņ£ż, ļ»ĖņäĖĒśłĻ┤Ć ļśÉļŖö ļ”╝ĒöäĻ┤Ć ņ╣©ņ£żņØ┤ ĒÖĢņØĖļÉ£ Ļ▓ĮņÜ░ņŚÉļŖö ĒĢŁņĢö ļ░®ņé¼ņäĀ ņ╣śļŻī ļśÉļŖö ņłśņłĀĻ│╝ Ļ░ÖņØĆ ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢśļŗż[19]. ĻĘĖļ¤¼ļéś ņØ┤ļ¤¼ĒĢ£ ĻĖ░ņżĆņØä ņØ╝Ļ┤äņĀüņ£╝ļĪ£ ņĀüņÜ®ĒĢśĻĖ░ļ│┤ļŗżļŖö ĒÖśņ×ÉņØś ļÅÖļ░ś ņ¦łĒÖśĻ│╝ ņĀäņŗĀ ņāüĒā£, ņłśņłĀņŚÉ ļö░ļź┤ļŖö ņØ┤ĒÖśņ£©Ļ│╝ ņé¼ļ¦ØļźĀņØä Ļ│ĀļĀżĒĢśņŚ¼ ņ╣śļŻī ļ░®Ē¢źņØä Ļ▓░ņĀĢĒĢśļŖö Ļ▓āņØ┤ ļ░öļ×īņ¦üĒĢśļŗż.
ļé┤ņŗ£Ļ▓Į ņ╣śļŻīņØś ņóģļźśņŚÉļŖö ļé┤ņŗ£Ļ▓Į ņĀÉļ¦ē ņĀłņĀ£ņłĀ(endoscopic mucosal resection), ļé┤ņŗ£Ļ▓Į ņĀÉļ¦ēĒĢś ļ░Ģļ”¼ņłĀ(endoscopic submucosal dissection), ņĢäļź┤Ļ│ż ĒöīļØ╝ņŖżļ¦ł ņåīņ×æņłĀ(argon plasma coagulation), Ļ┤æņŚŁļÅÖ ņ╣śļŻī(photodynamic therapy) ļō▒ņØ┤ ĒżĒĢ©ļÉ£ļŗż. ļ│æļ│ĆņØś ņÖäņĀä ņĀłņĀ£ ļ░Å ņĀłņĀ£ Ēøä ņĪ░ņ¦üņŚÉ ļīĆĒĢ£ ļ│æļ”¼ņĪ░ņ¦üĒĢÖņĀüĻ▓Ćņé¼ļź╝ ņ£äĒĢ┤ņä£ļŖö ņĀÉļ¦ē ņĀłņĀ£ņłĀ ļśÉļŖö ņĀÉļ¦ēĒĢś ļ░Ģļ”¼ņłĀņØ┤ ņČöņ▓£ļÉśļ®░, ĒŖ╣Ē׳ ņĀÉļ¦ēĒĢś ļ░Ģļ”¼ņłĀņØĆ ņĀÉļ¦ē ņĀłņĀ£ņłĀĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ Ēü¼ĻĖ░Ļ░Ć Ēü¼Ļ▒░ļéś ņŗØļÅä ļé┤Ļ░ĢņØä ņÖäņĀäĒ׳ ļæśļ¤¼ņŗĖļŖö ļ│æļ│ĆĻ╣īņ¦ĆļÅä ņØ╝Ļ┤ä ņĀłņĀ£ĒĢĀ ņłś ņ׳ņ¢┤ ņÜ░ņäĀņĀüņ£╝ļĪ£ Ļ│ĀļĀżļÉ£ļŗż(Fig. 1) [20,21].
Ēæ£ņ×¼ņä▒ ņŗØļÅäņĢöņØś ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀ Ēøä ņ╣śļŻī ņä▒ņĀüņØĆ ļ¦żņÜ░ ņÜ░ņłśĒĢśļŗż. ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀ Ēøä 402ļ¬ģņØä ĒÅēĻĘĀ 50Ļ░£ņøöĻ░ä ņČöņĀü Ļ┤Ćņ░░ĒĢ£ Ļ▓░Ļ│╝ ņóģņ¢æņØ┤ ņāüĒö╝ļé┤ ļśÉļŖö ņĀÉļ¦ēĻ│Āņ£ĀņĖĄņŚÉ ĻĄŁĒĢ£ļÉ£ Ļ▓ĮņÜ░ 5ļģä ņāØņĪ┤ņ£©ņØĆ 90.5%ņśĆņ£╝ļ®░ ņĀÉļ¦ēĻĘ╝ņĖĄ ļśÉļŖö ņĀÉļ¦ēĒĢś ņ╣©ņ£żņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ Ļ░üĻ░ü 71.1%, 70.8%ļĪ£ ļé«ņØĆ ņāØņĪ┤ņ£©ņØä ļ│┤ņśĆļŗż[22]. ņāØņĪ┤ņ£©Ļ│╝ ņĀäņØ┤ ņ£äĒŚśņØĆ ņóģņ¢æņØś ņ╣©ņ£ż Ļ╣ŖņØ┤ņÖĆ ļ░ĆņĀæĒĢ£ ņŚ░Ļ┤ĆņØ┤ ņ׳ņŚłņ£╝ļ®░, ĒŖ╣Ē׳ ņĀÉļ¦ēņĢöņØ┤ļØ╝ ĒĢśļŹöļØ╝ļÅä ļ»ĖņäĖĒśłĻ┤Ć ļśÉļŖö ļ”╝ĒöäĻ┤Ć ņ╣©ņ£żņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņĀäņØ┤ ņ£äĒŚśņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż. ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ ļČäņäØĒĢ£ Ēæ£ņ×¼ņä▒ ņŗØļÅäņĢö 373ņśłņŚÉ ļīĆĒĢ£ ņĀÉļ¦ēĒĢś ļ░Ģļ”¼ņłĀ Ļ▓░Ļ│╝ļŖö ņØ╝Ļ┤ä ņĀłņĀ£, ņÖäņĀä ņĀłņĀ£ņ£©ņØ┤ Ļ░üĻ░ü 96.7%, 84.5%ņśĆņ£╝ļ®░ ĻĘ╝ņ╣śņĀü ņĀłņĀ£ Ēøä 5ļģä ļ¼┤ņ¦łļ│æ ņāØņĪ┤ņ£©(disease-free survival)ņØĆ 84.8%ņśĆļŗż[23].
ĻĄŁļé┤ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉņä£ ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀ Ēøä ņØ╝Ļ┤ä ņĀłņĀ£ņ£©Ļ│╝ ņÖäņĀä ņĀłņĀ£ņ£©ņØĆ Ļ░üĻ░ü 80.3~97.2%, 81.8~91.7%ļĪ£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļ®░ ņ╣śļŻī Ēøä ņ×¼ļ░£ ļśÉļŖö ņŗØļÅäņĢö ņŚ░Ļ┤Ć ņé¼ļ¦ØņØś ļ╣łļÅäļŖö ļ¦żņÜ░ ļé«ņĢśļŗż[24-29]. ļŗ©ņØ╝ ĻĖ░Ļ┤ĆņŚÉņä£ ņŗ£Ē¢ēļÉ£ ņ┤Ø 261Ļ░£ ļ│æļ│ĆņŚÉ ļīĆĒĢ£ ņĀÉļ¦ēĒĢś ļ░Ģļ”¼ņłĀ Ļ▓░Ļ│╝ļź╝ ļČäņäØĒĢ£ ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ņŚÉņä£ ņØ╝Ļ┤ä ņĀłņĀ£, ņÖäņĀä ņĀłņĀ£ņ£©ņØĆ Ļ░üĻ░ü 93.9%, 89.7%ņśĆņ£╝ļ®░ ņżæņĢÖĻ░Æ 35Ļ░£ņøö Ļ░äņØś ņČöņĀü Ļ┤Ćņ░░ Ļ▓░Ļ│╝ 5ļģä ņ¦łļ│æ ĒŖ╣ņØ┤ ņāØņĪ┤ņ£©(disease-specific survival)ņØĆ 100%ņśĆļŗż[29]. ļé┤ņŗ£Ļ▓Į ņĀÉļ¦ēĒĢś ļ░Ģļ”¼ņłĀĻ│╝ ņłśņłĀ ņä▒ņĀüņØä ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļÅä ļ│┤Ļ│ĀļÉśņŚłļŖöļŹ░, ņä▒Ē¢ź ņĀÉņłś ļ¦żņ╣Ł(propensity score matching) ļ░®ļ▓ĢņØä ņé¼ņÜ®ĒĢśņŚ¼ 120ņīŹņØś ĒÖśņ×Éļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ņĀÉļ¦ēĒĢś ļ░Ģļ”¼ņłĀņØä ļ░øņØĆ ĒÖśņ×ÉņØś ņĀäņ▓┤ ņāØņĪ┤ņ£©(overall survival)Ļ│╝ ņ¦łļ│æ ĒŖ╣ņØ┤ ņāØņĪ┤ņ£©ņØĆ 93.9%, 91.2%ļĪ£ ņłśņłĀņØä ļ░øņØĆ ĒÖśņ×ÉņØś ņä▒ņĀü(97.4%, 92.8%)Ļ│╝ ļ╣äĻĄÉĒĢĀ ļ¦īĒĢ£ ņłśņżĆņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż[4]. ņ╣śļŻīņÖĆ ņŚ░Ļ┤ĆļÉ£ ĒĢ®ļ│æņ”ØņØĆ ņłśņłĀņØä ļ░øņØĆ ĒÖśņ×ÉĻĄ░ņŚÉņä£ 55.5%, ļé┤ņŗ£Ļ▓Į ņ╣śļŻīļź╝ ļ░øņØĆ ĒÖśņ×ÉĻĄ░ņŚÉņä£ļŖö 18.5%ļĪ£ ņłśņłĀĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļŹö ļ¦ÄņØ┤ ļ░£ņāØĒĢśņŚ¼, ļé┤ņŗ£Ļ▓Į ņ╣śļŻīļź╝ ĒåĄĒĢśņŚ¼ ņéČņØś ņ¦łņØä ļ│┤ņĪ┤ĒĢśļ®┤ņä£ ņłśņłĀĻ│╝ ļīĆļō▒ĒĢ£ ņĀĢļÅäņØś ņ╣śļŻīņä▒ņĀüņØä ņ¢╗ņØä ņłś ņ׳ņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż(Table 1).
ļé┤ņŗ£Ļ▓Į ņ╣śļŻīņØś ĒĢ®ļ│æņ”ØņŚÉļŖö ņČ£ĒśłĻ│╝ ņ▓£Ļ│Ą, Ēśæņ░®ņØ┤ ĒżĒĢ©ļÉ£ļŗż. ņŗØļÅäļŖö ļé┤Ļ░ĢņØ┤ ņóüĻ│Ā ĻĄ┤Ļ│ĪņØ┤ ņ׳ņ£╝ļ®░ ņŗ¼ņן ļ░ĢļÅÖ ļśÉļŖö ĒśĖĒØĪņŚÉ ņØśĒĢ£ ņśüĒ¢źņØä ļ░øĻĖ░ ļĢīļ¼ĖņŚÉ ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀņØ┤ ĻĖ░ņłĀņĀüņ£╝ļĪ£ ņ¢┤ļĀĄļŗż. ļśÉĒĢ£ ņŗØļÅä ļ▓ĮņØĆ ņāüļīĆņĀüņ£╝ļĪ£ ņ¢ćņĢä ņ▓£Ļ│ĄņØś ņ£äĒŚśņØ┤ ļåÆņ£╝ļ®░, ņĀüņØĆ ņ¢æņØś ņČ£ĒśłņŚÉ ņØśĒĢ┤ņä£ļÅä ņŗ£ņĢ╝Ļ░Ć ņēĮĻ▓ī ļéśļ╣Āņ¦ĆĻĖ░ ļĢīļ¼ĖņŚÉ ņ¦ĆĒśłņŚÉ ņ¢┤ļĀżņøĆņØä Ļ▓¬ņØä ņłś ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ĒĢ┤ļČĆĒĢÖņĀü ņÜöņØĖ ņØ┤ņÖĖņŚÉļÅä ņŗ£ņłĀņ×ÉņØś Ļ▓ĮĒŚśĻ│╝ ņłÖļĀ©ļÅä ļśÉĒĢ£ ĒĢ®ļ│æņ”Ø ļ░£ņāØņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņØĖņ×É ņżæ ĒĢśļéśļĪ£, ņĢłņĀäĒĢ£ ņ╣śļŻīļź╝ ņ£äĒĢ┤ņä£ļŖö ņłÖļĀ©ļÉ£ ļé┤ņŗ£Ļ▓Į ņØśņé¼Ļ░Ć ņĀäņŗĀ ļ¦łņĘ©ĒĢśņŚÉ ņŗ£ņłĀņØä ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØ┤ ļ░öļ×īņ¦üĒĢśļŗż[23]. ņŗ£ņłĀĻ│╝ ņŚ░Ļ┤ĆļÉ£ ņČ£ĒśłņØĆ 0~5.6%, ņ▓£Ļ│ĄņØĆ 4~9.3%ņŚÉņä£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļ®░, ļīĆļČĆļČä ļé┤ņŗ£Ļ▓Į ņ¦ĆĒśłņłĀ ļśÉļŖö ļ┤ēĒĢ®ņłĀņØä ĒåĄĒĢśņŚ¼ ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņ╣śļŻīĒĢĀ ņłś ņ׳ņŚłļŗż[4,23,24,26-30].
ņŗØļÅäņĢöņØś ļé┤ņŗ£Ļ▓Į ņ╣śļŻīņŚÉņä£ ļ░śļō£ņŗ£ Ļ│ĀļĀżļÉśņ¢┤ņĢ╝ ĒĢĀ ņĀÉņØĆ ņ╣śļŻī Ēøä ļ░£ņāØĒĢĀ ņłś ņ׳ļŖö Ēśæņ░®ņŚÉ ļīĆĒĢ£ ņśłļ░®Ļ│╝ ļīĆņ▓śņØ┤ļŗż. ļé┤ņŗ£Ļ▓Į ņ╣śļŻī Ēøä Ēśæņ░®ņØĆ 5.4~13.9%ņŚÉņä£ ļ░£ņāØĒĢśļ®░, ĒŖ╣Ē׳ ņĀłņĀ£ Ēøä ņĀÉļ¦ē Ļ▓░ņåÉņØ┤ ņøÉņŻ╝ņØś 75% ņØ┤ņāüņØä ņ░©ņ¦ĆĒĢśļŖö Ļ▓ĮņÜ░ Ēśæņ░®ņØś ņ£äĒŚśņØ┤ ļ¦żņÜ░ ļåÆņ£╝ļ»ĆļĪ£ Ēśæņ░® ņśłļ░®ņØä ņ£äĒĢ£ ņĪ░ņ╣śĻ░Ć ĒĢäņÜöĒĢśļŗż[4,23,24,26-29,31,32]. Ēśæņ░® ļ░£ņāØ ņśłļ░® ļ░Å ņ╣śļŻī ļ░®ļ▓Ģņ£╝ļĪ£ ĒÆŹņäĀĒÖĢņןņłĀņØä ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ņ£╝ļéś ļīĆĻ░£ ļ░śļ│ĄņĀüņØĖ ņŗ£ņłĀņØ┤ ĒĢäņÜöĒĢśļŗż[33-35]. ņØ╝ņŗ£ņĀüņ£╝ļĪ£ ņŖżĒģÉĒŖĖļź╝ ņéĮņ×ģĒĢśņśĆļŗżĻ░Ć ņĀ£Ļ▒░ĒĢśļŖö ļ░®ļ▓ĢļÅä ņé¼ņÜ®ĒĢ┤ļ│╝ ņłś ņ׳ļŗż[36]. ļé┤ņŗ£Ļ▓Į ņĀłĻ░£ļÅäļź╝ ņé¼ņÜ®ĒĢśņŚ¼ Ēśæņ░® ļČĆļČäņØä ņ¦üņĀæ ņĀłĻ░£ĒĢśļŖö ļ░®ļ▓ĢļÅä ņŗ£ļÅäļÉśņŚłņ£╝ļéś ņČ£ĒśłĻ│╝ ņ▓£Ļ│ĄņŚÉ ļīĆĒĢ£ ņŻ╝ņØśĻ░Ć ĒĢäņÜöĒĢśļ®░ ņןĻĖ░ ņä▒ņĀüņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļŹö ĒĢäņÜöĒĢśļŗż[37,38]. ņŗ£ņłĀ Ēøä Ēśæņ░®ņØ┤ ņśłņāüļÉśļŖö ĒÖśņ×ÉņŚÉņä£ ņŗ£ņłĀ ņ¦üĒøä ņĀÉļ¦ēĒĢśņĖĄņŚÉ ĻĄŁņåī ņŖżĒģīļĪ£ņØ┤ļō£ļź╝ ņŻ╝ņ×ģĒĢśĻ▒░ļéś Ļ▓ĮĻĄ¼ ņŖżĒģīļĪ£ņØ┤ļō£ļź╝ ņé¼ņÜ®ĒĢ©ņ£╝ļĪ£ņŹ© Ēśæņ░® ļ░£ņāØņØä ņżäņØ╝ ņłś ņ׳ļŗż[33,39,40]. ņ┤Ø 12Ļ░£ ņŚ░ĻĄ¼, 513ļ¬ģņØä ĒżĒĢ©ĒĢ£ ļäżĒŖĖņøīĒü¼ ļ®öĒāĆļČäņäØ Ļ▓░Ļ│╝ņŚÉņä£ļÅä ĻĄŁņåī ļśÉļŖö Ļ▓ĮĻĄ¼ ņŖżĒģīļĪ£ņØ┤ļō£ļź╝ ņé¼ņÜ®ĒĢ©ņ£╝ļĪ£ņŹ© ļīĆņĪ░ĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢśņŚ¼ Ēśæņ░® ņ£äĒŚśņØä Ļ░Éņåīņŗ£ĒéżĻ│Ā ĒÆŹņäĀĒÖĢņןņłĀ ņ╣śļŻī Ēܤņłśļź╝ ņżäņØ╝ ņłś ņ׳ņŚłļŗż[41]. ĻĘĖļ¤¼ļéś Ēśæņ░®ņŚÉ ļīĆĒĢ£ ņśłļ░® ļ░Å ņ╣śļŻī ļ░®ļ▓ĢņØĆ ņĢäņ¦üĻ╣īņ¦Ć Ēæ£ņżĆĒÖöļÉśņ¢┤ ņ׳ņ¦Ć ņĢŖņ£╝ļ®░, ņØ┤ļ»Ė ņĢīļĀżņ¦ä ļ░®ļ▓ĢļōżņØś ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢśļŖö ņŚ░ĻĄ¼ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņāłļĪ£ņÜ┤ ļ░®ļ▓ĢņŚÉ ļīĆĒĢ£ ņŗ£ļÅäļōżņØ┤ ņŚ¼ņĀäĒ׳ ĒĢäņÜöĒĢśļŗż.
ņŗØļÅäņĢöņØś ļé┤ņŗ£Ļ▓Į ņ╣śļŻīļŖö ņĪ░ĻĖ░ ņŗØļÅäņĢö ļ░Å ļ”╝ĒöäņĀł ņĀäņØ┤ Ļ░ĆļŖźņä▒ņØ┤ ļ¦żņÜ░ ļé«ņØĆ Ēæ£ņ×¼ņä▒ ņŗØļÅäņĢöņØś ņØ╝ļČĆļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ļŗż. ļé┤ņŗ£Ļ▓Į ņ╣śļŻīļź╝ ĒåĄĒĢśņŚ¼ ņ╣śļŻī ĻĖ░Ļ░äņØä ļŗ©ņČĢĒĢśĻ│Ā ņéČņØś ņ¦łņØä ļ│┤ņĪ┤ĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņןĻĖ░ ņČöņĀü Ļ▓░Ļ│╝ņŚÉ ņ׳ņ¢┤ņä£ļÅä ņłśņłĀĻ│╝ ļ╣äĻĄÉĒĢĀ ļ¦īĒĢ£ ņ╣śļŻī ņä▒ņĀüļōżņØ┤ ļ│┤Ļ│ĀļÉśņ¢┤ ņłśņłĀņØä ļīĆņŗĀĒĢśļŖö ĻĘ╝ņ╣ś ļ¬®ņĀüņ£╝ļĪ£ ņŗ£Ē¢ēļÉśĻ│Ā ņ׳ļŗż. ņĀÉļ¦ēĒĢśņĖĄ ņ╣©ņ£żņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ļ”╝ĒöäņĀł ņĀäņØ┤ ņ£äĒŚśņØ┤ ņ”ØĻ░ĆĒĢ£ļŗżļŖö ņĀÉņŚÉ ņ£ĀņØśĒĢśņŚ¼ ņ╣śļŻī ņĀäļץņØä ņłśļ”ĮĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļ®░, ņĀłņĀ£ ņĪ░ņ¦üņŚÉ ļīĆĒĢ£ ļ│æļ”¼ ņĪ░ņ¦üĻ▓Ćņé¼ Ļ▓░Ļ│╝ļź╝ ņĀüņĀłĒĢśĻ▓ī ĒĢ┤ņäØĒĢśĻ│Ā ņČöĻ░Ć ņ╣śļŻī ņŚ¼ļČĆļź╝ Ļ▓░ņĀĢĒĢĀ ņłś ņ׳ņ¢┤ņĢ╝ ĒĢ£ļŗż. ļśÉĒĢ£ ņŗØļÅä ņøÉņŻ╝ņØś 75% ņØ┤ņāüņØä ņĀłņĀ£ĒĢśļŖö Ļ▓ĮņÜ░ ņŗ£ņłĀ Ēøä Ēśæņ░® ļ░£ņāØ Ļ░ĆļŖźņä▒ņØ┤ ļåÆņØīņØä ņŚ╝ļæÉņŚÉ ļæÉĻ│Ā ņśłļ░® ņĪ░ņ╣śļź╝ ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢ£ļŗż.
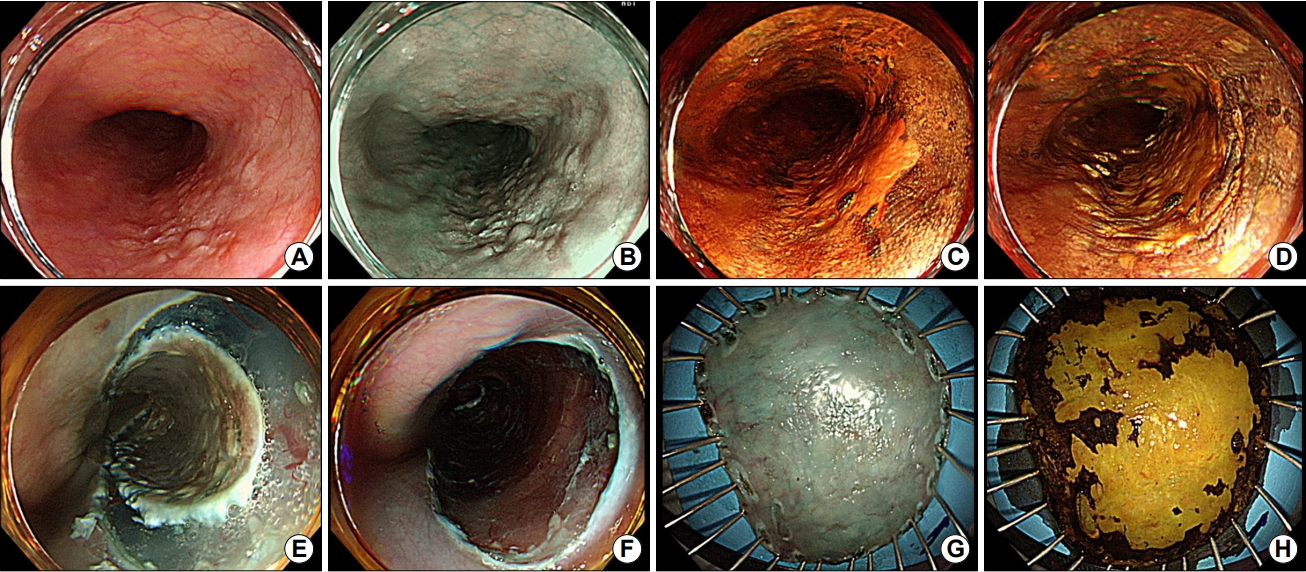
Fig.┬Ā1.
Endoscopic submucosal dissection of superficial esophageal neoplasm. (A) Conventional white light endoscopy shows a fla lesion with mucosal coarsening and surface granularity in the middle esophagus. (B) Non-magnifying endoscopy with narrow band-imaging of corresponding lesion. (C) Chromoendoscopy with iodine staining demarcates the lesion from the non-neoplastic area. (D) Marking of the lesion. (E) Circumferential mucosal pre-cutting after submucosal injection. (F) Artificial ulcer after submucosal dissection. (G) En bloc resection by endoscopic submucosal dissection. (H) Resected specimen after iodine staining.
Table┬Ā1.
Summary of Studies on Endoscopic Resection of Superficial Esophageal Squamous Neoplasms in Korea
| Author | Year | Numbera | Histologic diagnosis | Mean tumor size (mm) | ER | CR | Perforation | Bleeding | Stricture | Median f/u (months) | Survival |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Joo et al [24] | 2014 | 28 | SqCC | 13 (3~26) | 93.0% | 83.0% | 2 (7.1) | 0 | 2 (7.1) | 23 (2~78) | 5Y OS 84% |
| 5Y DSS 100% | |||||||||||
| Lee et al [26] | 2015 | 37 (6) | SqCC | 12 (3~31) | 91.9% | 81.8% | 3 (8.1) | 0 | 2 (5.4) | 22 (4~79) | DSS 100% |
| Kim et al [27] | 2015 | 147 (39) | 30 dysplasia | 15 (2~60) | 80.3% | 86.5% | 12 (9.3) | 2 (1.6) | 8 (6.2) | 35 (8~138) | 5Y OS 94.0% |
| 117 SqCC | 5Y DSS 97.5% | ||||||||||
| Park et al [28] | 2016 | 36 | 10 dysplasia | 17 (3~52) | 97.2% | 91.7% | 2 (5.6) | 2 (5.6) | 5 (13.9) | 31 | DSS 100% |
| 26 SqCC | |||||||||||
| Park et al [29] | 2016 | 261 | 70 dysplasia | 19 (2~75) | 93.9% | 89.7% | 12 (4.6) | 4 (1.5) | 17 (6.5) | 36 (IQR 18~62) | 5Y OS 89.7% |
| 191 SqCC | 5Y DSS 100% |
REFERENCES
1. Cho JW, Choi SC, Jang JY, et al. Lymph node metastases in esophageal carcinoma: an endoscopist's view. Clin Endosc 2014;47:523ŌĆō529.




2. National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN guidelines®). Esophageal and esophagogastric junction cancers. Version 4 [Internet]. [updated 2017 Oct 13; cited 2019 Jun 15]. Available from: http://oncolife.com.ua/doc/nccn/Esophageal_and_Esophagogastric_Junction_Cancers.pdf.
3. Low DE, Bodnar A. Update on clinical impact, documentation, and management of complications associated with esophagectomy. Thorac Surg Clin 2013;23:535ŌĆō550.


4. Min YW, Lee H, Song BG, et al. Comparison of endoscopic submucosal dissection and surgery for superficial esophageal squamous cell carcinoma: a propensity score-matched analysis. Gastrointest Endosc 2018;88:624ŌĆō633.


5. Park BK, Kim GH. How is the incidence of esophageal cancer going in the future? Korean J Helicobacter Up Gastrointest Res 2018;18:76ŌĆō78.

6. Kim DU, Lee JH, Min BH, et al. Risk factors of lymph node metastasis in T1 esophageal squamous cell carcinoma. J Gastroenterol Hepatol 2008;23:619ŌĆō625.


7. Huh CW, Jung DH, Kim JH, Ma DW, Youn YH, Park H. Clinical implication of endoscopic gross appearance in superficial esophageal squamous carcinoma: revisited. Surg Endosc 2018;32:367ŌĆō375.



8. Draganov PV, Wang AY, Othman MO, Fukami N. AGA institute clinical practice update: endoscopic submucosal dissection in the United States. Clin Gastroenterol Hepatol 2019;17:16ŌĆō25; e1.


9. Bae J, Shin IS, Min YW, et al. Endoscopic prediction model for differentiating upper submucosal invasion (< 200 ╬╝m) and beyond in superficial esophageal squamous cell carcinoma. Oncotarget 2018;9:9156ŌĆō9165.



10. Thosani N, Singh H, Kapadia A, et al. Diagnostic accuracy of EUS in differentiating mucosal versus submucosal invasion of superficial esophageal cancers: a systematic review and meta-analysis. Gastrointest Endosc 2012;75:242ŌĆō253.


11. Oyama T, Inoue H, Arima M, et al. Prediction of the invasion depth of superficial squamous cell carcinoma based on microvessel morphology: magnifying endoscopic classification of the Japan Esophageal Society. Esophagus 2017;14:105ŌĆō112.



12. Eguchi T, Nakanishi Y, Shimoda T, et al. Histopathological criteria for additional treatment after endoscopic mucosal resection for esophageal cancer: analysis of 464 surgically resected cases. Mod Pathol 2006;19:475ŌĆō480.



13. Higuchi K, Tanabe S, Koizumi W, et al. Expansion of the indications for endoscopic mucosal resection in patients with superficial esophageal carcinoma. Endoscopy 2007;39:36ŌĆō40.


14. Choi JY, Park YS, Jung HY, et al. Feasibility of endoscopic resection in superficial esophageal squamous carcinoma. Gastrointest Endosc 2011;73:881ŌĆō889; e2.


15. Moon JY, Kim GH, Kim JH, et al. Clinicopathologic factors predicting lymph node metastasis in superficial esophageal squamous cell carcinoma. Scand J Gastroenterol 2014;49:589ŌĆō594.


16. Akutsu Y, Uesato M, Shuto K, et al. The overall prevalence of metastasis in T1 esophageal squamous cell carcinoma: a retrospective analysis of 295 patients. Ann Surg 2013;257:1032ŌĆō1038.


17. Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy 2015;47:829ŌĆō854.



18. Kitagawa Y, Uno T, Oyama T, et al. Esophageal cancer practice guidelines 2017 edited by the Japan esophageal society: part 2. Esophagus 2019;16:25ŌĆō43.



19. Suzuki G, Yamazaki H, Aibe N, et al. Endoscopic submucosal dissection followed by chemoradiotherapy for superficial esophageal cancer: choice of new approach. Radiat Oncol 2018;13:246.



20. Ishihara R, Iishi H, Uedo N, et al. Comparison of EMR and endoscopic submucosal dissection for en bloc resection of early esophageal cancers in Japan. Gastrointest Endosc 2008;68:1066ŌĆō1072.


21. Takahashi H, Arimura Y, Masao H, et al. Endoscopic submucosal dissection is superior to conventional endoscopic resection as a curative treatment for early squamous cell carcinoma of the esophagus (with video). Gastrointest Endosc 2010;72:255ŌĆō264; e2.


22. Yamashina T, Ishihara R, Nagai K, et al. Long-term outcome and metastatic risk after endoscopic resection of superficial esophageal squamous cell carcinoma. Am J Gastroenterol 2013;108:544ŌĆō551.


23. Tsujii Y, Nishida T, Nishiyama O, et al. Clinical outcomes of endoscopic submucosal dissection for superficial esophageal neoplasms: a multicenter retrospective cohort study. Endoscopy 2015;47:775ŌĆō783.


24. Joo DC, Kim GH, Park DY, Jhi JH, Song GA. Long-term outcome after endoscopic submucosal dissection in patients with superficial esophageal squamous cell carcinoma: a single-center study. Gut Liver 2014;8:612ŌĆō618.



25. Kim C, Hong SJ, Han JP, et al. Clinical outcomes of the endoscopic treatments for the early esophageal carcinoma and dysplasia. Korean J Helicobacter Up Gastrointest Res 2014;14:187ŌĆō193.

26. Lee HJ, Lee H, Park JC, Shin SK, Lee SK, Lee YC. Treatment strategy after endoscopic resection of superficial esophageal squamous cell carcinoma: a single institution experience. Gut Liver 2015;9:714ŌĆō719.


27. Kim DH, Jung HY, Gong EJ, et al. Endoscopic and oncologic outcomes of endoscopic resection for superficial esophageal neoplasm. Gut Liver 2015;9:470ŌĆō477.


28. Park JS, Youn YH, Park JJ, Kim JH, Park H. Clinical outcomes of endoscopic submucosal dissection for superficial esophageal squamous neoplasms. Clin Endosc 2016;49:168ŌĆō175.



29. Park HC, Kim DH, Gong EJ, et al. Ten-year experience of esophageal endoscopic submucosal dissection of superficial esophageal neoplasms in a single center. Korean J Intern Med 2016;31:1064ŌĆō1072.



30. Ono S, Fujishiro M, Niimi K, et al. Long-term outcomes of endoscopic submucosal dissection for superficial esophageal squamous cell neoplasms. Gastrointest Endosc 2009;70:860ŌĆō866.


31. Ono S, Fujishiro M, Niimi K, et al. Predictors of postoperative stricture after esophageal endoscopic submucosal dissection for superficial squamous cell neoplasms. Endoscopy 2009;41:661ŌĆō665.


32. Okamoto K, Matsui S, Watanabe T, et al. Clinical analysis of esophageal stricture in patients treated with intralesional triamcinolone injection after endoscopic submucosal dissection for superficial esophageal cancer. Oncology 2017;93 Suppl 1:9ŌĆō14.


33. Isomoto H, Yamaguchi N, Nakayama T, et al. Management of esophageal stricture after complete circular endoscopic submucosal dissection for superficial esophageal squamous cell carcinoma. BMC Gastroenterol 2011;11:46.



34. Ezoe Y, Muto M, Horimatsu T, et al. Efficacy of preventive endoscopic balloon dilation for esophageal stricture after endoscopic resection. J Clin Gastroenterol 2011;45:222ŌĆō227.


35. Lian JJ, Ma LL, Hu JW, et al. Endoscopic balloon dilatation for benign esophageal stricture after endoscopic submucosal dissection for early esophageal neoplasms. J Dig Dis 2014;15:224ŌĆō229.


36. Wen J, Lu Z, Yang Y, et al. Preventing stricture formation by covered esophageal stent placement after endoscopic submucosal dissection for early esophageal cancer. Dig Dis Sci 2014;59:658ŌĆō663.



37. Minamino H, Machida H, Tominaga K, et al. Endoscopic radial incision and cutting method for refractory esophageal stricture after endoscopic submucosal dissection of superficial esophageal carcinoma. Dig Endosc 2013;25:200ŌĆō203.


38. Yano T, Yoda Y, Satake H, et al. Radial incision and cutting method for refractory stricture after nonsurgical treatment of esophageal cancer. Endoscopy 2013;45:316ŌĆō319.


39. Hashimoto S, Kobayashi M, Takeuchi M, Sato Y, Narisawa R, Aoyagi Y. The efficacy of endoscopic triamcinolone injection for the prevention of esophageal stricture after endoscopic submucosal dissection. Gastrointest Endosc 2011;74:1389ŌĆō1393.


-
METRICS

-
- 3 Crossref
- 4,781 View
- 201 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Endoscopic Treatments in Perforation or Fistula in Upper Gastrointestinal Tract2024 March;24(1)
Endoscopic Treatment and Prevention of Acute Variceal Hemorrhage2024 March;24(1)
Differential Diagnosis of Esophageal Ulcers2023 March;23(1)
Considerations for Endoscopic Treatment of Undifferentiated-type Early Gastric Cancer2021 June;21(2)
Initial Treatment for Patients with Achalasia2020 March;20(1)






