위염의 Kyoto 분류와 위암
Kyoto Classification of Gastritis and Gastric Cancer
Article information
Trans Abstract
Identification of patients with a high risk of gastric cancer during gastric cancer surveillance is highly important. Most gastric cancers develop in the background of chronic gastritis associated with Helicobacter pylori (H. pylori) infection. Pathological evaluation using biopsy specimen was proposed to stratify gastric cancer risk in the operative link for gastritis assessment and operative link for gastric intestinal metaplasia assessment staging systems from the West. However, biopsy specimens cannot represent the whole stomach, and endoscopic biopsy confers a risk of bleeding in certain patients. In the Kyoto classification of gastritis proposed by a Japanese study group, five endoscopically visible findings (atrophy, intestinal metaplasia, enlarged folds, nodularity, and diffuse redness) were selected, which are closely related to gastric cancer development due to H. pylori infection. Furthermore, the gastric cancer risk grading system based on the Kyoto classification of gastritis was suggested to identify patients with an increased risk of developing gastric cancer. Although this grading system needs validation to prove its efficacy, it is expected to be useful for most endoscopists who are involved in gastric cancer surveillance.
서 론
2015년 일본소화기내시경학회에서 Helicobacter pylori (H. pylori) 감염 위염을 중점적으로 하는, 조직학적 소견을 대변할 수 있는 새로운 내시경적 위염 분류에 관한 논의가 있었으며[1], 이후 최종적으로 “위염의 Kyoto 분류”가 작성되었고 현재 개정 2판까지의 책자가 출간되었다[2,3]. 위염의 Kyoto 분류는 위점막의 상태를 H. pylori 미감염 점막과 H. pylori 현감염 점막, H. pylori 기감염(제균 후) 점막으로 나누어 진단하기 위하여, 내시경 검사에서 확인할 수 있는 다양한 위염 소견들을 정의하여 각각 H. pylori 감염 상태와 어떻게 연관되는지를 정리하고 있다. 본고에서는 위염의 Kyoto 분류에서 제시하고 있는 다양한 내시경 소견들 중에서 위암의 위험도와 연관된 소견이 무엇이며, 이들을 어떻게 포착하고 위암의 위험도를 계층화할 수 있는지에 대하여 기술하고자 한다.
본 론
1. 위암과 배경 위염의 관계
위암은 만성 위염을 배경으로 하여 발생하는 질환의 하나이다. 만성 위염의 원인에는 H. pylori 감염 외에 자기면역성의 A형 위염이 알려져 있지만, 이는 약 2% 정도에 불과하다[4]. H. pylori가 위점막에 감염되면 위점막의 고유층에 염증세포의 침윤이 시작된다. 림프구의 집적과 여포 형성, 위점막 상피의 상해, 점막 상피의 증식성·과형성 변화 등에 의하여 다양한 파괴와 재생 과정이 반복된다. 시간이 지나면서 점차 고유위선이 서서히 사라지고 위유문선화생이나 장상피화생이 출현하여 위축성 위염으로 변화한다[5].
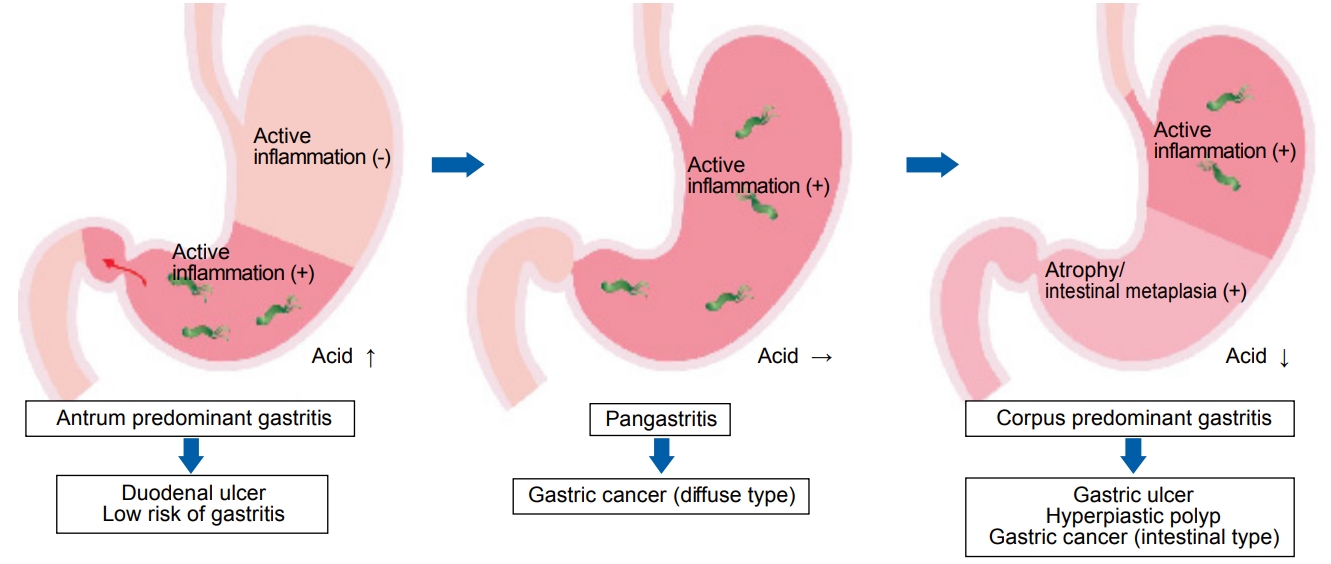
만성 위염은 염증의 소재에 따라 전정부 우위 위염(antrum predominant gastritis), 전체 위염(pan-gastritis), 체부 우위 위염(corpus predominant gastritis)의 3형으로 분류한다. 전정부 우위 위염에서는 산분비가 항진되어 있으며, 십이지장 궤양이 잘 발생하고 위암의 발생은 적다. 전체 위염은 염증이 체부로 확대되고 미분화형 위암이 발생하기 쉬우며, 젊은 층의 위암과 연관성이 강하다. 체부 우위 위염에 동반된 위축과 장상피화생은 분화형 위암의 발생과 깊이 관련되어 있다(Fig. 1) [6,7]. 이러한 관점은 위암 위험도 평가에 기본적인 틀을 제공해 주지만 위암 위험도를 계층화하기는 어려울 수 있다.
한편 유럽을 중심으로 한 연구자들에 의하여 위전정부와 위체부에서 생검을 통한 병리학적 위축 및 장상피화생의 정도에 따라 위암 위험도를 평가한 Operative Link on Gastritis Assessment (OLGA) 분류와 Operative Link on Gastric Intestinal Metaplasia assessment (OLGIM) 분류가 보고되었다. OLGA 분류는 2005년에 OLGA group으로부터 제창되었으며 구체적으로는 전정부 2개, 위각부 1개, 위체부 전벽 및 후벽에서 각각 1개씩 총 5개의 생검을 실시하여 위축의 정도를 평가한다[8]. 조직학적 위점막 위축의 정의는 1) 위저선의 소실과 점막 고유층의 섬유성 비후에 의한 치환, 2) 고유선의 장상피 또는 위유문선에 의한 치환이지만 위축은 병리의사에 의한 평가가 엇갈리기 쉬우며 κ치가 낮다. 그래서 Capelle 등[9]은 위축의 평가가 아니라 장상피화생의 평가로 바꾼 OLGIM 분류를 제창하였다. 이 분류를 이용한 증례 대조 연구에서는 OLGA 분류보다도 OLGIM 분류가 위암과 유의한 관련성이 있음이 밝혀졌다[10]. 체부 위염에서 위암 발생의 교차비는 3.4 (1.4-8.1)이며, 여기에 OLGIM 분류에 따라 평가하면 9.8 (2.6-36.7)로 상승한다고 보고하였다. 그러나 OLGIM 분류의 생검 부위는 전정부 4개, 위각부 2개, 위체부 소만 2개, 위체부 대만 2개, 분문부 2개로 총 12개의 생검을 시행해야 한다는 것이 문제점이다. 실제로 우리나라와 일본에서는 내시경 소견을 중시하는 경향이 있으며 환자 가운데 고령자가 많고 항혈전제 복용 환자의 비율도 높아서 위암의 위험 판정만을 위하여 5개 이상 다수의 생검을 시행하는 것은 내시경 의사에게 부담이기 때문에 OLGA 분류와 OLGIM 분류는 널리 보급되지 않았다. 그러므로 생검을 필요로 하지 않으면서 내시경 소견에만 기초하여 위암 위험도를 등급화하여 평가하는 방법의 개발이 필요하였다.
2. 위암 위험도와 연관된 내시경 소견
일본에서 위암 위험에 관련된 위염의 내시경 소견에 대한 보고가 이루어진 바 있다. 단면 조사 방법에 의한 연구에서 위축성 위염에서 위암 발생의 비교 위험도는 5.13 (95% CI, 2.79~9.42), 위축이 고도로 되면 7.73 (95% CI, 3.95~15.12)으로 증가하였다. 위암의 조직형에 따른 비교 위험도에도 뚜렷한 차이가 있어 위축성 위염에서 분화형 위암의 경우 24.71 (95% CI, 3.46~176.68), 미분화형 위암의 경우는 3.49 (95% CI, 1.77~6.89)였다[11]. 전향적 코호트 방법에 의한 연구에서는 평균 4.4년을 추적관찰하였을 때 위축성 위염이 있는 군에서 위축성 위염이 없는 군에 비하여 위암이 5.73배(95% CI, 0.78~41.90) 많이 발생하였다[12]. 닭살 모양 형태의 림프여포성 위염(lymphofollicular gastritis)은 림프여포 형성이 현저한 특수형 위염으로, 젊은 여성에서 위암의 교차비가 64.2 (95% CI, 16.4~250.9)로 증가하고 주로 미분화형 위암의 위험을 가진다[13]. 또한 위주름의 종대가 미분화형 위암의 위험인자가 되는 것으로 보고되었는데, 위조영술에서 주름의 폭이 4 mm 이하인 경우를 위암 위험도의 1로 보았을 때 5 mm에서는 3.1 (95% CI, 1.7~5.5), 6 mm에서는 8.6 (95% CI, 3.8~19.6), 7 mm에서는 35.5 (95% CI, 7.9~160.8)로 미분화형 위암의 교차비가 증가하였다[14].
3. 위암 위험도와 연관된 내시경 소견의 점수 체계
이상의 연구 결과 등을 바탕으로 위염의 Kyoto 분류에서는 위암 위험을 고려한 내시경 소견으로 위축(atrophy, A), 장상피화생(intestinal metaplasia, IM), 주름의 종대(enlarged folds, H), 닭살 모양의 결절(nodularity, N)이 선정되었다. 한편 H. pylori 제균에 의한 위암의 억제 효과를 고려하여 H. pylori 현감염과 H. pylori 제균 후를 구별하는 소견으로 미만성 발적(diffuse redness, DR)을 포함하여 위암의 위험도를 예측할 수 있는 점수화 체계를 구성하였다(Table 1) [15]. 여기서 H. pylori 제균에 의하여 염증세포 침윤이 소실되면 위점막이 미감염 위점막에 가깝게 회복되므로 내시경 소견을 통하여 위암의 위험도가 감소됨을 예측할 수 있다.
1) 위축(A)
내시경 검사 시 위축은 혈관투영상으로 판정을 하며, 위축의 정도와 범위는 충분히 공기를 주입하여 관찰한다. Kimura-Takemoto 분류를 사용하여 기술하며, 위축은 유문부에서 시작하여 체부 소만, 이후 체부 전체로 확장하므로 범위에 따라 C-1, C-2, C-3, O-1, O-2, O-3의 6단계로 구분한다. C는 closed-type을, O는 open-type을 의미하며, 분문부부터 유문부까지 위축이 연결되지 않은 경우를 closed-type, 연결된 경우를 open-type이라고 분류한다.
위축이 관찰되지 않는 C-0, C-1은 점수 0점, 위축이 경한 C-2, C-3는 점수 1점, 위축이 중등도부터 심한 경우인 O-1에서 O-3은 점수 2점으로 계산한다. 예를 들면 점수 2점의 경우에는 A2로 기재한다.
2) 장상피화생(IM)
장상피화생은 일반 백색광 관찰 및 영상강화내시경(image-enhanced endoscopy, IEE)을 이용한 관찰에서 다른 소견을 보인다. 백색광으로는 특이형 장상피화생이라고 불리는 회백색 융기 병변과 제균 후 나타나는 발적 함몰 병변의 관찰만 가능하다. 그러나 methylene blue를 사용한 색소내시경에서는 특이형 이외의 장상피화생도 청색으로 염색되어 관찰된다. 협대역 영상(narrow band imaging, NBI)에서 선와상피의 표면에 청백색의 선이 보이는 light blue crest가 관찰되면 장상피화생으로 진단할 수 있다[16]. 또한 특이형의 장상피화생에서는 NBI로 관찰 시 점막 상피에 백색 물질이 부착되어 있는 white opaque substance를 볼 수 있다[17]. Linked color imaging에 의한 IEE 관찰에서는 특이형 및 비특이형의 모든 장상피화생을 자색조의 lavender color로 인식할 수 있어 위 내의 장상피화생의 분포를 용이하게 평가할 수 있다[18]. IEE 관찰에서는 이러한 light blue crest, white opaque substance, lavender color의 정도와 범위를 평가한다. 따라서 백색광 관찰 및 IEE 관찰 소견을 구분하여 기재한다.
장상피화생이 관찰되지는 않는 경우는 점수 0점, 장상피화생이 전정부에 국한되어 있는 경우는 점수 1점, 장상피화생이 체부까지 확장되어 있는 경우는 점수 2점이다. 백색광 관찰에서 점수 1점인 경우는 IM1으로 기재하고 IEE 관찰 소견은 괄호 내에 표기한다. 예를 들어, 백색광 관찰 점수 1점, IEE 관찰 점수 2점의 경우에는 IM1(2)로 기재한다. 백색광 관찰에서 제균 후의 지도상 발적을 장상피화생이라고 진단하면 제균 후에 위암 위험 점수가 제균 전보다 증가하는 현상이 일어나는 경우가 있지만, IEE 관찰에서는 그러한 현상이 일어나지 않는다.
3) 주름의 종대(H)
충분한 공기를 주입하여 관찰 시 주름의 폭이 4 mm 이하인 경우는 점수 0점, 5 mm 이상인 경우는 점수 1점이며 H1으로 기재한다.
4) 닭살 모양의 결절(N)
닭살 모양의 결절이 관찰되지 않는 경우는 점수 0점, 관찰되는 경우는 1점이며 N1이라고 기재한다.
5) 미만성 발적(DR)
위축이 없는 체부선 영역을 관찰한다. 숙련되지 않는 경우에는 체부선 영역의 집합세정맥(regular arrangement of collecting venules, RAC)의 관찰 여부를 토대로 미만성 발적을 평가하는 것이 좋다. RAC가 관찰되는 경우는 미만성 발적이 없으므로 점수 0점, RAC가 소실된 경우는 점수 2점, 제균 후와 같이 일부에서 RAC가 관찰되는 경우는 점수 1점으로 한다. 점수 1점인 경우는 DR1로 기재한다.
4. 위암 위험도와 연관된 위염의 Kyoto 분류의 유용성
최근 위염의 Kyoto 분류에 따른 위암 발생 위험도에 대한 임상 평가가 보고되었다. 위암 증례와 비위암 증례의 대조 연구에 의하면 위축, 장상피화생, 닭살 모양의 결절과 미만성 발적은 의미 있게 위암 증례에서 점수가 높게 나타났지만, 주름의 종대와 연관해서는 차이가 관찰되지 않았다. 위암 위험과 연관된 인자를 다변량 분석하면 장상피화생과 위축이 유의한 인자로, 나이와 성을 추가하면 남성과 장상피화생이 남았다[19]. 또 다른 후향적 단면 조사 연구에서는 위축, 장상피화생, 미만성 발적이 위암 발생의 의미 있는 위험인자였고 다변량 분석에서는 위축의 정도와 나이가 유의하였다[20]. 미분화형 암에서는 위축과 젊은 연령이 의미 있는 인자였으며, 주름의 종대는 미약한 연관관계가 있었다.
한편 NBI 확대내시경 영상을 이용하여 위축과 장상피화생을 진단하고 OLGA 분류, OLGIM 분류에 기초하여 위암 발생 위험 판정을 평가하는 연구에서 NBI 확대내시경 영상이 실제적인 생검을 대체할 수 있는지를 조사하였다[21]. 저위험군(stage 0, I, Ⅱ)과 고위험군(stage Ⅲ, IV)의 두 그룹으로 분류하였을 때, NBI 확대내시경과 실제 생검을 기준으로 결정된 집단 간 대응도는 89.1%로 나타나 NBI 확대내시경을 이용한 위암 위험의 계층화가 가능함을 제시하였다(Table 3).
결 론
H. pylori 감염 상태와 위암 발생의 특징을 이해하는 것이 효율적인 위암 검사에 중요하다고 생각된다. 최근에 발표된 위염의 Kyoto 분류는 내시경적 위염 소견을 체계화한 것으로, H. pylori 감염 위염의 진단이 용이하게 되었을 뿐만 아니라 위암의 조기 발견을 위한 선별검사에 유용한 정보를 제공한다. 그러나 위염의 Kyoto 분류에 따른 위암 발생 위험도의 유용성에 대해서는 검증을 계속할 필요가 있으며, 또 그 결과에 따라서는 점수나 항목의 변경이 필요할 수도 있다. 한편 확대내시경의 보급이 점차 확대되는 현실에서 확대내시경을 이용하여 위염의 병기 결정을 하는 노력도 필요해 보인다.
Notes
No potential conflict of interest relevant to this article was reported.