위 MALT 림프종 환자의 위 위축 및 장상피화생의 낮은 유병률
Lower Risk of Gastric Atrophy and Intestinal Metaplasia in Patients with MALT Lymphoma despite Helicobacter pylori Infection
Article information
Trans Abstract
Background/Aims
Atrophic gastritis and intestinal metaplasia are sequential consequences of chronic Helicobacter pylori (H. pylori) infection. These conditions are well known to increase the risk of gastric adenocarcinoma development. Gastric mucosa-associated lymphoid tissue (MALT) lymphoma is also a malignant consequence of H. pylori infection, but the relationship between gastric MALT lymphoma and atrophic gastritis-intestinal metaplasia has not been a focus of interest. We investigated the clinical characteristics of atrophic gastritis and intestinal metaplasia in patients with gastric MALT lymphoma.
Materials and Methods
A study was conducted by reviewing the electronic medical records of patients diagnosed as having gastric MALT lymphoma at an academic institute, the Yeouido St. Mary's Hospital, Seoul, Korea, between January 2001 and December 2018.
Results
Fifty-eight subjects were enrolled consecutively during the study period and analyzed retrospectively. The patients’ mean age was 56.9 years old. The male-to-female ratio was 1.15 (31/27). On histological examination, background atrophic gastritis and intestinal metaplasia were detected in 26.8% (15/58) of cases. Serum pepsinogen I, II and gastrin levels, as serological markers of atrophy, were evaluated in 28 subjects. Three (5.2%) of the 28 cases were compatible with serological atrophic gastritis (pepsinogen I/II ratio of <3 and pepsinogen I level of <70 ng/mL).
Conclusions
In patients with gastric MALT lymphoma, the prevalence of background mucosal atrophy or intestinal metaplasia was 26.8% on histological examination and 5.2% on serological analyses. These rates are lower than those in patients with gastric adenocarcinoma. This result suggests a different carcinogenic pathway of gastric MALT lymphoma from that of adenocarcinoma.
서 론
위 점막연관 림프조직(mucosa-associated lymphoid tissue lymphoma, MALT) 림프종은 비호지킨 림프종에 속하는 악성 종양으로 거대 B세포 림프종(diffuse large B cell lymphoma)과 더불어 가장 흔한 위장관 발생 림프종이다. 위 MALT 림프종의 발생 빈도는 위 악성 종양의 약 2~7%를 차지하며, 위장관 발생 림프종 중에서는 전체의 60~75%를 차지한다[1-3]. MALT 림프종의 발생은 만성적 감염 또는 자가면역 질환에 의한 만성적 항원 자극이 원인으로 추정되고 있으며, 위장에서 발생하는 MALT 림프종은 Helicobacter pylori’ (H. pylori) 감염과 연관되는 것으로 잘 알려져 있다[4,5].
H. pylori는 MALT 림프종과 위선암의 주된 원인이다. H. pylori는 위 점막의 만성 염증을 유발하고, 위축성 위염과 장상피화생은 H. pylori 감염에 따른 위선암 발생의 전구 병변이다. MALT 림프종과 위선암의 상관관계에 대한 특정한 가설은 없으나, MALT 림프종 환자에 대한 관찰 연구에서 위선암의 발생 빈도가 약 0.91%로서 위선암 발생의 상대 위험도가 4.32 (95% confidence interval [CI], 2.64~6.67)인 것으로 보아 두 질환 사이에 연관성이 있음을 시사한다[6]. 그러나 가톨릭대학교 여의도성모병원에서 위선암과 MALT 림프종의 발생을 조사한 결과 두 가지 악성 종양을 모두 진단받은 환자는 없어서 서구의 연구와 일치하는 결과를 얻을 수는 없었다.
한 가지 가설로서 위 MALT 림프종이 위선암의 발생과 공통의 과정을 거친다면 위축성 위염과 장상피화생의 역할에 대하여 검토해볼 필요가 있다. 저자들은 MALT 림프종 환자의 위 점막에서 위선암의 전구 병변인 위축성 위염과 장상피화생이 배경 병변으로 존재하는지 조사하였다.
대상 및 방법
1. 대상
2001년 1월부터 2018년 12월까지 가톨릭대학교 여의도성모병원에서 위 MALT 림프종으로 진단받은 환자의 전산 의무기록을 후향적으로 분석하였다. 이 연구는 가톨릭대학교 여의도성모병원의 기관윤리위원회 승인을 받아 진행되었다(IRB no. SC19RESI0010).
2. 방법
가톨릭대학교 여의도성모병원의 전산 의무기록을 이용하여 위 MALT 림프종으로 진단된 대상 환자의 연령과 성별, 내시경 소견, 병리검사의 결과, H. pylori의 진단 결과, 치료 내용, 치료 기간, 추적검사의 종류와 결과에 대하여 후향적으로 조사하였다. 내시경 검사 결과를 통하여 위 MALT 림프종 병변의 형태를 확인하고 컴퓨터단층촬영검사 결과를 통하여 위벽의 침범 정도, 림프절의 침범 정도를 확인하였다. H. pylori 감염 여부는 요소호기검사, 항-H. pylori IgG 또는 위내시경 생검 조직을 시행하였으며, 이 중 한 가지에서 양성이면 감염이 있는 것으로 판단하였다. 위축성 위염과 장상피화생의 진단은 Sydney system을 이용하여 조직학적으로 평가하였다. 혈청학적 검사는 가스트린, 펩시노겐 I, 펩시노겐 II를 검사하였으며, 펩시노겐 I이 70 ng/mL 미만이고 펩시노겐 I/II 비가 3보다 작은 경우를 위축성 위염으로 판단하였다[7-9].
3. 통계적 분석
연구 대상 환자들의 인구 통계학적 인자들과 임상 특성과 H. pylori 감염 상태, 혈청학적 검사 결과와 조직학적 진단을 연구기관의 전산 의무기록을 이용하여 수집하고 분석하였다. 임상 특성을 파악하기 위하여 연속적인 변수들은 평균과 표준편차를 이용하여 값을 제시하였고, 비연속적인 변수들은 각각의 수치와 백분율을 이용하여 제시하였다. 범주형 변수의 비교에는 카이제곱 검정을 이용하였다. IBM SPSS Statistics ver. 21.0 (IBM Co., Chicago, IL, USA)을 사용하여 통계 처리를 하였으며, P 값이 0.05 미만일 경우를 통계적으로 유의하다고 판단하였다.
결 과
1. 환자 특성
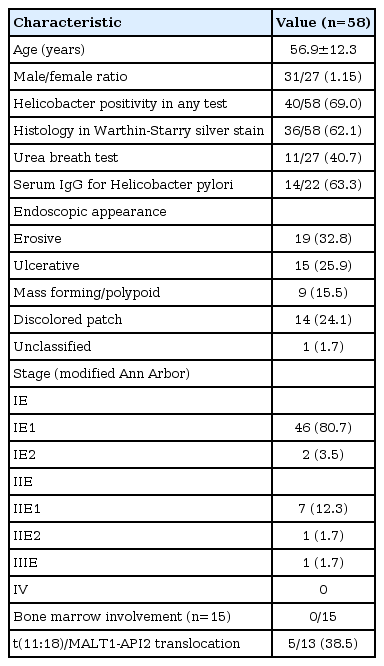
연구 기간인 2001년 1월부터 2018년 12월 동안 총 대상 환자는 58명이었다. 위 MALT 림프종 환자의 평균 나이는 56.9세였으며, 남녀의 비는 31:27 (1.15)이었다. H. pylori 감염이 진단된 환자는 69% (40/58)였다. 내시경 검사에서 보이는 소견은 특정할 수 있는 전형적인 형태 없이 다양하였다. 미란성 병변으로 보이는 경우가 32.8%로 가장 많았으며 궤양성 병변, 백색의 편평형 반, 용종 또는 종괴형의 병변 순으로 나타났다[10,11]. 병기는 modified Ann Arbor 병기를 적용할 때 80.7% (46/58)가 1E1기였으며 전신 파종의 예는 없었다. 유전자 변이 여부는 17명의 환자에서 시행하였으며 t(11:18)/MALT1-API2 전좌 유전자 돌연변이가 있는 경우는 41.2% (7/17)였다(Table 1).
2. 위축성 위염 및 장상피화생의 빈도
연구 기간 중 위 MALT 림프종으로 진단받은 대상 환자 58명 중에서 56명의 조직학적 평가가 가능하였다. 내시경 검사의 육안 소견에서 위체부 위축을 동반한 Kimura-Takemoto 분류의 개방형 위축을 보이는 환자는 없었다. 내시경 조직검사는 Sydney system에서 제안한 방법에 따라 체부의 대만과 소만, 위 각, 전정부의 대만과 소만에서 표준형 생검용 겸자를 이용하여 각각 한 조각씩 채취하였으며, 이를 이용하여 MALT 림프종 병변 외에 배경 점막의 상태를 평가하였다. 조직학적 검사에서 점막의 위축 또는 장상피화생이 진단된 경우는 26.8% (15/56)였다. 조직학적 검사에서 장상피화생을 진단한 환자의 경우에도 다발성의 산재된 백색 반 형태의 점막 변화는 관찰할 수 있었지만 위체부를 침범하는 미만성의 위축성 변화는 명확하지 않았다. 위축성 위염의 진단을 위한 혈청학적 검사는 대상 환자 중 29명에서 시행하였다. 혈청 표지자는 펩시노겐 I, 펩시노겐 II, 가스트린을 측정하였다. 혈청학적 위축성 위염의 절단값인 펩시노겐 I이 70 ng/mL 미만이고 펩시노겐 I/II 비가 3 미만인 경우는 17.2% (5/29)였다. 펩시노겐 I/II 비가 3 미만인 환자의 혈청 가스트린치는 평균 188 pg/mL (범위 49~290 pg/mL)였다. 위축성 위염에 대한 혈청학적 진단과 조직학적 진단의 일치도 κ값은 0.316이었다(Table 2). 혈청학적 위축성 위염의 기준에 합당한 5명의 환자는 모두 H. pylori 감염 양성이었으나, H. pylori 감염 여부가 조직학적 그리고 혈청학적 위축성 위염의 발생에 통계적으로 유의한 수준의 영향을 미치지는 않았다. 조직학적 그리고 혈청학적 위축성 위염의 여부가 위 MALT 림프종의 병기에 영향을 미치지 않았다. 대상 환자 중 14명에서 혈청학적 위축성 위염 여부와 t(11:18)/MALT1-API2 전좌 돌연변이의 여부를 함께 평가할 수 있었다. 혈청학적 위축성 위염이 있는 경우 t(11:18)/MALT1-API2 전좌 돌연변이의 빈도는 66.7% (2/3)로 위축성 위염이 없는 경우의 27.3% (3/11)보다 높았으나 통계적 유의성은 없었다. 반대로 조직학적 위축성 위염 여부와 t(11:18)/MALT1-API2 전좌 돌연변이의 여부를 함께 평가할 수 있었던 17명의 환자에서는 조직학적 위축성 위염이 있는 경우 t(11:18)/MALT1-API2 전좌 돌연변이의 빈도가 20% (1/5)로 조직학적 위축성 위염이 없는 경우의 50% (6/12)보다 낮았으나 통계적 유의성이 없었다.
고 찰
위 MALT 림프종과 위선암은 H. pylori 감염을 공통의 원인으로 하는 서로 다른 악성 종양이다. 일반적으로 H. pylori 감염은 만성 위염을 일으키고 만성 염증의 결과로 위 점막의 위축과 장상피화생이 발생하며, 이후 이형성 과정을 거쳐 선암으로 진행한다. 위축성 위염과 장상피화생의 단계는 유의미한 전암 병변으로서 위선암의 발생 위험도를 약 6~20배 상승시킨다. 반면 위 MALT 림프종은 H. pylori 감염에 의한 만성적인 항원 자극에 의하여 B세포의 종양성 형질 변환이 발생하는 것이 기전이다. 지속적인 항원 자극은 위 점막의 림프구 침윤과 MALT의 발생을 야기한다. 유도된 MALT에서 B세포의 다클론 활성과 팽창 과정은 NFκB의 활성화와 DNA 손상 그리고 유전자 일탈을 림프종으로 발전시킨다[12,13].
위 MALT 림프종 환자에 대한 대규모 관찰 연구는 네덜란드와 포르투갈의 보고가 있다. 포르투갈의 연구는 2,195명의 위 MALT 림프종 환자를 관찰하였고, 관찰 기간 중 20명(0.91%)에서 위선암이 발생하였고, 이는 미국인의 위암 발생률과 비교하여 상대 위험도가 4.32 (95% CI 2.64~6.67)로 높다고 하였다[14]. 네덜란드의 연구는 1,419명의 위 MALT 림프종 환자를 관찰하여 이 중 34명(2.4%)에서 위선암이 발생하는 것을 보고하였고, 네덜란드 일반 인구에 비하여 위 MALT 림프종 환자의 위선암 발생 위험도는 6.11 (95% CI 4.28~8.72)이었다[6]. 일반적으로 알려진 H. pylori 감염에 따른 위선암 발생의 위험도가 약 2배이며 평생 동안 위선암 발생률이 약 1%라는 것을 감안한다면[15,16] 위의 두 보고의 결과는 위 MALT 림프종이 자체가 위선암의 부가적 위험 요인이라는 것을 시사한다. 그러나 두 질환 사이에 H. pylori의 감염이라는 공통 분모 외에 공유하는 종양 발생 경로가 있는지는 알려져 있지 않다. 이러한 이유로 저자들은 위선암 발생의 명확한 경로로 알려진 위축성 위염과 장상피화생의 단계가 위 MALT 림프종에도 존재하는지 확인하고자 연구를 진행하였다.
연구의 결과 위 MALT 림프종 환자의 배경 점막에서 위축성 위염과 장상피화생의 빈도는 위선암을 기준으로 하였던 기대치보다 낮았다. 내시경 검사로 육안적으로 판단하기에 위체부에 명확한 위축성 변화를 동반한 경우는 전체 대상 환자에서 없었다. 육안적 평가는 Kimura-Takemoto 분류를 적용하였으며 개방형 위축이 있는 경우를 위체부의 명확한 위축성 위염으로 판단하도록 하였으나 해당되는 환자는 없었다. 다만, 위 MALT 림프종의 형태가 편평형의 백색 퇴축으로 나타나는 경우에는 마치 위축성 변화와 유사하였으나 조직검사를 통하여 서로 배제할 수 있었다. 조직학적 검사에서 배경 점막에 위축성 위염과 장상피화생이 동반된 경우는 26.8%였으며 혈청학적 검사에서 위축성 위염으로 판단할 수 있는 경우는 17.2%였다. 이러한 결과는 위 MALT 림프종의 발생에 위축성 위염이나 장상피화생이 중계 역할을 하지 않을 것을 시사한다. 또 다른 고려 사항으로 이러한 차이의 원인은 연령 분포에서 기인한 것을 의심할 수 있다. 위 MALT 림프종은 위선암에 비하여 좀 더 이른 연령에서 많이 발생한다. 저자들의 연구에서도 위 MALT 림프종 환자의 평균 연령은 56.9세로 선암의 발생의 알려진 고조기보다 약 10년이 빠르다. 위축성 위염이나 장상피화생의 존재는 위 MALT 림프종의 임상 표현으로서 내시경적 형태나 병기, t(11:18)/MALT1-API2 전좌 돌연변이 동반에도 영향을 미치지 않았다. 다만, 혈청학적 또는 조직학적 위축성 위염이 있는 경우 H. pylori 감염의 빈도가 그렇지 않은 경우보다 높은 경향을 보였으나 통계적 차이를 얻지는 못하였다.
이 연구는 단일 기관에서 58명의 대상 환자에 대하여 수행한 후향 연구로서 본디의 한계를 가지고 있다. 내시경 영상을 촬영하고 기록하는 것은 소속 기관의 표준 지침을 따르기는 하였으나 검사자에 따라 일관성을 가지기 어려웠다. 유전 변이로서 t(11:18)/MALT1-API2 전좌 돌연변이에 대한 평가와 펩시노겐 I과 펩시노겐 II에 대한 검사는 주치의사의 판단에 따라 선별적으로 시행되었다. 이러한 이유로 비교 평가를 위한 연구 대상 자료의 동질성이 충분하지 않은 단점이 있다. 다만, 위 MALT 림프종이 발생률이 낮고 연구 대상을 장기간 전향 모집하는 것이 현실적으로 어렵다는 것을 감안하면 저자들의 연구도 일정한 의미가 있다고 할 수 있다.
저자들의 연구 결과가 위 MALT 림프종과 위선암 사이의 관련성을 부정하지는 않는다. 서구의 연구에서 위 MALT 림프종과 위선암 발생 사이에는 약 5~6년의 기간이 소요되었다. 따라서 저자들의 연구에서 대상의 규모가 작음을 고려하면 위선암의 발생까지는 더 긴 관찰 기간이 필요할 수 있다. 미소생물학과 후생유전학적 연구는 H. pylori 감염뿐 아니라 헬리코박터 외 위장 미생물총의 역할과 상호 작용의 결과가 위 점막에 어떠한 변화를 초래하고 어떠한 지점에서 두 질환의 갈림이 발생하는지에 대한 지식을 제공할 것이다[17,18]. 또한, 위 MALT 림프종에서 위선암의 위험이 증가하는 것에 대해서는 헬리코박터 감염과 위 MALT 림프종 자체에 의한 위험 증가에 더하여 위 MALT 림프종의 치료를 위하여 사용하였던 방사선 조사나 항암 치료가 선암 발생에 영향을 미치는가에 대한 연구도 필요하다.
결론적으로 위 MALT 림프종은 위선암과 함께 H. pylori 감염을 공통의 시발 요인으로 가지고 있지만, H. pylori의 만성 감염에 따른 위축성 위염과 장상피화생은 위 MALT 림프종 환자의 배경 점막에서 약 1/5의 경우만 존재하며, 위축성 위염과 장상피화생의 존재 여부가 위 MALT 림프종의 임상 표현과 예후에 특정한 관련은 없었다. 따라서, 위 MALT 림프종의 발생 경과와 위선암 발생 경로는 서로 독립된 것을 시사한다.
Notes
No potential conflict of interest relevant to this article was reported.