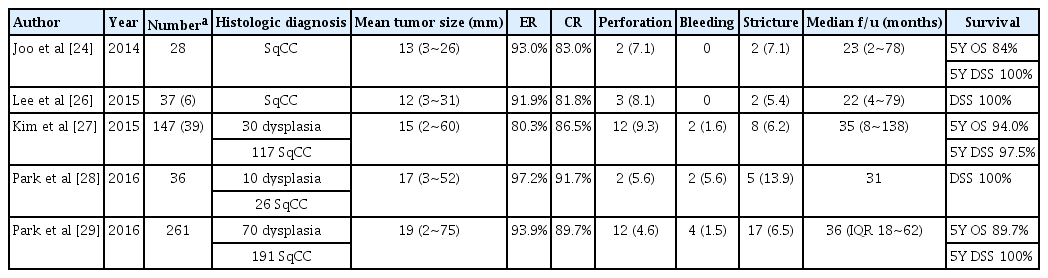
식도암의 내시경 치료
Endoscopic Treatment for Esophageal Cancer
Article information
Trans Abstract
Although surgical resection is the mainstay of treatment for resectable esophageal cancer, it is associated with considerable morbidity and mortality. Endoscopic resection, including endoscopic mucosal resection and endoscopic submucosal dissection, has been considered as a feasible alternative to surgical resection for superficial esophageal squamous cell carcinoma based on its minimal invasiveness and favorable outcomes in suitable indications. The long-term outcomes of endoscopic resection are comparable to those of surgery when tumors are confined to the intraepithelial or lamina propria layer because these tumors have low or no risk of lymph node metastasis. The results of histopathological examination of the resected specimens should be interpreted thoroughly regarding the requirement of additional treatment. Treatment-related adverse events include bleeding, perforation, and stricture. Preventive measures should be taken during and after the procedure, particularly when the mucosal defects account for more than three-fourths of the circumference. In this review, the indications and outcomes of endoscopic treatment for esophageal squamous cell carcinoma are summarized.
서 론
식도암은 진단과 치료 방법의 발전에도 불구하고 예후가 매우 불량한 위장관 암 중의 하나이다. 이는 식도암이 이미 진행된 상태에서 발견되는 경우가 많고 림프절 전이가 흔하기 때문이다[1]. 절제가능한 식도암의 표준 치료는 식도 절제술이지만 수술에 따르는 이환율과 사망률이 높고 수술 후 삶의 질을 회복하기까지 긴 시간이 필요하다는 제한점이 있다[2,3]. 림프절 전이 가능성이 없는 일부 표재성 식도암(superficial esophageal cancer)에 대한 근치적 절제 목적으로 내시경 치료가 시행되고 있으며, 엄격한 적용 기준에 따르면 치료 후 생존율이 수술과 대등한 것으로 보고되었다[4]. 서구에서는 식도 샘암종(adenocarcinoma)이 급격히 증가하고 있으나 우리나라에서 발생하는 식도암은 대부분이 편평세포암종(squamous cell carcinoma)으로[5], 본 원고에서는 편평세포암종의 내시경 치료에 대하여 기술하고자 한다.
본 론
1. 내시경 치료의 적응증
표재성 식도암은 림프절 전이에 관계 없이 점막층과 점막하층에 국한된 식도암으로 정의하며, 그중 림프절 전이가 없으면서 점막에 국한된 식도암을 조기 식도암(early esophageal cancer)이라고 한다. 내시경 치료의 이상적인 목표는 일괄 절제 및 근치적 절제이므로 조기 식도암과 림프절 전이 가능성이 낮은 일부 표재성 식도암이 내시경 치료의 대상이 된다.
치료 전 내시경 초음파, 컴퓨터단층촬영, 양전자 방출 단층촬영 등의 검사를 시행하여 림프절 및 원격 전이 여부를 확인하고 임상 병기를 설정하는 과정이 필요하다[2]. 식도암의 국소침윤 깊이를 예측하는 데에는 내시경으로 관찰된 육안 형태가 중요한 역할을 한다. 육안적 관찰에 따른 0-I형(표면융기형) 또는 0-III형(표면함몰형)에서는 0-II형(평탄형)과 비교하여 점막하 침윤이 더 많고, 편평하지 않은 육안 형태(0-IIa형 또는 0-IIc형) 또한 점막하층으로의 침윤을 시사하므로 내시경 치료의 대상으로는 적합하지 않다[6-8]. 표면이 균일하지 않거나 결절상 또는 과립상이 관찰되는 경우에도 점막하층 침윤 가능성이 높으므로 주의해야 한다[9]. 이외에도 루골 용액을 비롯한 색소 내시경 검사를 통하여 병변의 크기와 범위를 보다 명확하게 파악할 수 있으며, 내시경 초음파와 이미지 증강 내시경 기법을 활용하여 추가적인 정보를 얻을 수 있다[10,11].
식도암의 치료 전략을 수립하는 데 있어 가장 중요한 요소는 국소 림프절 전이 가능성을 예측하는 것이다. 림프절 전이 위험과 연관된 인자로는 병변의 크기, 육안 형태, 림프관 침윤(lymphatic invasion) 등이 알려져 있으며, 특히 식도암의 국소침윤 정도가 림프절 전이와 밀접한 관계가 있다[6,7,12-15]. 표재성 식도암으로 수술을 받은 환자를 대상으로 한 분석 결과 식도암이 상피내(intraepithelial, M1) 또는 점막고유층(lamina propria, M2)에 국한된 경우 0~5.6%에서 림프절 전이가 관찰되었으며, 종양이 점막근층(muscularis mucosa, M3)까지 침범하거나 점막하층으로의 침윤이 200 μm 이내인 경우(submucosa 1, SM1) 림프절 전이의 빈도는 각각 9.0~25.0%, 15.0~53.1%로 증가하였다[6,12,16]. 따라서 점막암 중에서도 림프절 전이 가능성이 거의 없는 상피내 또는 점막고유층에 국한된 경우를 내시경 치료의 절대 적응증으로 정의한다.
일본과 유럽, 미국 가이드라인에서는 종양이 M3 또는 SM1까지 침윤하였더라도 미세혈관 또는 림프관에 암세포 침윤이 없다면 림프절 전이의 위험이 낮으므로 내시경 치료의 상대 적응증 또는 확대 적응증으로 고려해볼 수 있다고 기술하고 있다[8,17,18]. 그러나 침윤 깊이가 증가함에 따라 림프절 전이 위험성이 가파르게 증가하므로 치료 전 평가 결과가 M3 또는 SM1 침윤을 시사한다면 내시경 치료보다는 수술이 추천되며, 수술에 따른 위험이 높은 일부 환자에서 선택적으로 내시경 치료를 시행할 수 있다.
내시경 치료 후 절제 조직에 대한 병리조직학적 검사 결과에 따라 근치적 치료로 판단할 것인지 추가 치료를 시행할 것인지를 결정한다. 식도암이 점막근층을 침윤하였더라도 일괄 완전 절제되었고 분화도가 좋으면서 미세혈관 또는 림프관 침윤이 없다면 추가 치료 없이 조심스럽게 경과를 관찰해볼 수 있다[12,17]. 병변이 불완전 절제되었거나 점막하층 침윤, 미세혈관 또는 림프관 침윤이 확인된 경우에는 항암 방사선 치료 또는 수술과 같은 추가 치료가 필요하다[19]. 그러나 이러한 기준을 일괄적으로 적용하기보다는 환자의 동반 질환과 전신 상태, 수술에 따르는 이환율과 사망률을 고려하여 치료 방향을 결정하는 것이 바람직하다.
2. 식도암의 내시경 치료
내시경 치료의 종류에는 내시경 점막 절제술(endoscopic mucosal resection), 내시경 점막하 박리술(endoscopic submucosal dissection), 아르곤 플라스마 소작술(argon plasma coagulation), 광역동 치료(photodynamic therapy) 등이 포함된다. 병변의 완전 절제 및 절제 후 조직에 대한 병리조직학적검사를 위해서는 점막 절제술 또는 점막하 박리술이 추천되며, 특히 점막하 박리술은 점막 절제술과 비교하여 크기가 크거나 식도 내강을 완전히 둘러싸는 병변까지도 일괄 절제할 수 있어 우선적으로 고려된다(Fig. 1) [20,21].
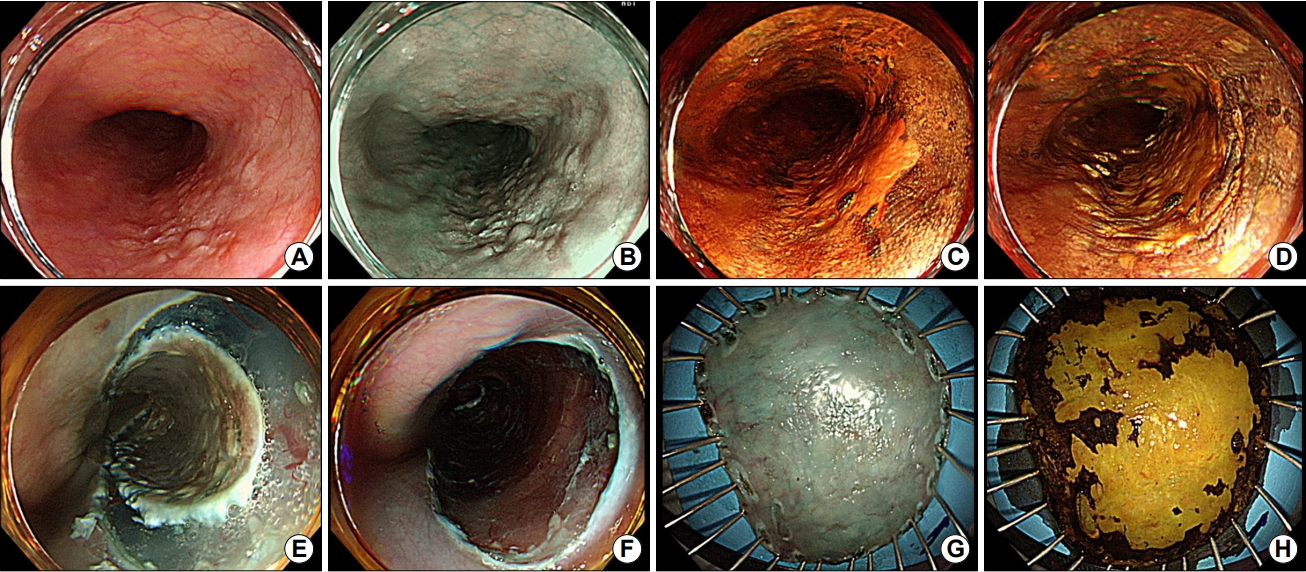
Endoscopic submucosal dissection of superficial esophageal neoplasm. (A) Conventional white light endoscopy shows a fla lesion with mucosal coarsening and surface granularity in the middle esophagus. (B) Non-magnifying endoscopy with narrow band-imaging of corresponding lesion. (C) Chromoendoscopy with iodine staining demarcates the lesion from the non-neoplastic area. (D) Marking of the lesion. (E) Circumferential mucosal pre-cutting after submucosal injection. (F) Artificial ulcer after submucosal dissection. (G) En bloc resection by endoscopic submucosal dissection. (H) Resected specimen after iodine staining.
표재성 식도암의 내시경 절제술 후 치료 성적은 매우 우수하다. 내시경 절제술 후 402명을 평균 50개월간 추적 관찰한 결과 종양이 상피내 또는 점막고유층에 국한된 경우 5년 생존율은 90.5%였으며 점막근층 또는 점막하 침윤이 있는 경우 각각 71.1%, 70.8%로 낮은 생존율을 보였다[22]. 생존율과 전이 위험은 종양의 침윤 깊이와 밀접한 연관이 있었으며, 특히 점막암이라 하더라도 미세혈관 또는 림프관 침윤이 있는 경우 전이 위험이 유의하게 높았다. 다른 연구에서 분석한 표재성 식도암 373예에 대한 점막하 박리술 결과는 일괄 절제, 완전 절제율이 각각 96.7%, 84.5%였으며 근치적 절제 후 5년 무질병 생존율(disease-free survival)은 84.8%였다[23].
국내 연구 결과에서 내시경 절제술 후 일괄 절제율과 완전 절제율은 각각 80.3~97.2%, 81.8~91.7%로 보고되었으며 치료 후 재발 또는 식도암 연관 사망의 빈도는 매우 낮았다[24-29]. 단일 기관에서 시행된 총 261개 병변에 대한 점막하 박리술 결과를 분석한 최근 연구에서 일괄 절제, 완전 절제율은 각각 93.9%, 89.7%였으며 중앙값 35개월 간의 추적 관찰 결과 5년 질병 특이 생존율(disease-specific survival)은 100%였다[29]. 내시경 점막하 박리술과 수술 성적을 비교한 연구 결과도 보고되었는데, 성향 점수 매칭(propensity score matching) 방법을 사용하여 120쌍의 환자를 비교하였을 때 점막하 박리술을 받은 환자의 전체 생존율(overall survival)과 질병 특이 생존율은 93.9%, 91.2%로 수술을 받은 환자의 성적(97.4%, 92.8%)과 비교할 만한 수준으로 나타났다[4]. 치료와 연관된 합병증은 수술을 받은 환자군에서 55.5%, 내시경 치료를 받은 환자군에서는 18.5%로 수술군에서 유의하게 더 많이 발생하여, 내시경 치료를 통하여 삶의 질을 보존하면서 수술과 대등한 정도의 치료성적을 얻을 수 있음을 확인하였다(Table 1).
내시경 치료의 합병증에는 출혈과 천공, 협착이 포함된다. 식도는 내강이 좁고 굴곡이 있으며 심장 박동 또는 호흡에 의한 영향을 받기 때문에 내시경 절제술이 기술적으로 어렵다. 또한 식도 벽은 상대적으로 얇아 천공의 위험이 높으며, 적은 양의 출혈에 의해서도 시야가 쉽게 나빠지기 때문에 지혈에 어려움을 겪을 수 있다. 이러한 해부학적 요인 이외에도 시술자의 경험과 숙련도 또한 합병증 발생에 영향을 미치는 인자 중 하나로, 안전한 치료를 위해서는 숙련된 내시경 의사가 전신 마취하에 시술을 시행하는 것이 바람직하다[23]. 시술과 연관된 출혈은 0~5.6%, 천공은 4~9.3%에서 보고되었으며, 대부분 내시경 지혈술 또는 봉합술을 통하여 성공적으로 치료할 수 있었다[4,23,24,26-30].
식도암의 내시경 치료에서 반드시 고려되어야 할 점은 치료 후 발생할 수 있는 협착에 대한 예방과 대처이다. 내시경 치료 후 협착은 5.4~13.9%에서 발생하며, 특히 절제 후 점막 결손이 원주의 75% 이상을 차지하는 경우 협착의 위험이 매우 높으므로 협착 예방을 위한 조치가 필요하다[4,23,24,26-29,31,32]. 협착 발생 예방 및 치료 방법으로 풍선확장술을 시행할 수 있으나 대개 반복적인 시술이 필요하다[33-35]. 일시적으로 스텐트를 삽입하였다가 제거하는 방법도 사용해볼 수 있다[36]. 내시경 절개도를 사용하여 협착 부분을 직접 절개하는 방법도 시도되었으나 출혈과 천공에 대한 주의가 필요하며 장기 성적에 대한 연구가 더 필요하다[37,38]. 시술 후 협착이 예상되는 환자에서 시술 직후 점막하층에 국소 스테로이드를 주입하거나 경구 스테로이드를 사용함으로써 협착 발생을 줄일 수 있다[33,39,40]. 총 12개 연구, 513명을 포함한 네트워크 메타분석 결과에서도 국소 또는 경구 스테로이드를 사용함으로써 대조군과 비교하여 협착 위험을 감소시키고 풍선확장술 치료 횟수를 줄일 수 있었다[41]. 그러나 협착에 대한 예방 및 치료 방법은 아직까지 표준화되어 있지 않으며, 이미 알려진 방법들의 효과를 비교하는 연구뿐만 아니라 새로운 방법에 대한 시도들이 여전히 필요하다.
결 론
식도암의 내시경 치료는 조기 식도암 및 림프절 전이 가능성이 매우 낮은 표재성 식도암의 일부를 대상으로 한다. 내시경 치료를 통하여 치료 기간을 단축하고 삶의 질을 보존할 수 있으며, 장기 추적 결과에 있어서도 수술과 비교할 만한 치료 성적들이 보고되어 수술을 대신하는 근치 목적으로 시행되고 있다. 점막하층 침윤이 있는 경우 림프절 전이 위험이 증가한다는 점에 유의하여 치료 전략을 수립하는 것이 중요하며, 절제 조직에 대한 병리 조직검사 결과를 적절하게 해석하고 추가 치료 여부를 결정할 수 있어야 한다. 또한 식도 원주의 75% 이상을 절제하는 경우 시술 후 협착 발생 가능성이 높음을 염두에 두고 예방 조치를 시행해야 한다.
Notes
No potential conflict of interest relevant to this article was reported.