 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 19(4); 2019 > Article |
|
Abstract
Background/Aims
Helicobacter pylori (H. pylori) eradication is known to be effective for reducing the size of gastric hyperplastic polyps (HPPs). This study investigated the change in size of gastric HPPs after H. pylori eradication.Materials and
Methods
This was a prospective study that enrolled 25 H. pylori-positive patients diagnosed as having HPPs at Korea University Guro Hospital between July 2015 and July 2016. If the patient wanted to receive eradication therapy, medication was given. If the patients refused eradication, only clinical follow-up was performed. All patients were subsequently followed up with endoscopic examination to determine any change in polyp size.
Results
Eighteen of the 25 H. pylori-positive patients diagnosed as having HPPs were given an eradication regimen, and 17 were confirmed to have achieved successful eradication. Twelve (70.8%) of the 17 patients in the eradication group showed ≥50% reduction in size, while two (25.0%) of the eight patients in the non-eradication group showed 50% reduction. The polyp regression rate was significantly higher in the eradication group (P=0.03). A multivariate analysis revealed that H. pylori eradication (OR, 40.047; 95% CI, 1.112~1442.767; P=0.044) and female sex (OR, 12.947; 95% CI, 1.038~161.503; P=0.047) were significant predictive factors of HPP regression.
과증식 위용종은 위용종 중 가장 흔하게 나타나는 양성 상피성 용종으로 위의 모든 부분에서 발생할 수 있으며 대개 단발성으로 관찰되나 다발성인 경우도 드물지 않다[1]. 크기는 대부분 0.5~1.5 cm이며 대개의 경우 무증상으로 건강검진을 목적으로 위내시경을 시행할 때 우연히 발견된다. 드물게 과증식 위용종으로 인한 위배출 장애 및 위장 폐쇄, 실혈 등의 증상이 나타날 수 있으며, 과증식 위용종의 0.6%에서 19%까지 위선암 및 위이형성으로 변화한다는 보고가 있어 용종의 치료 방향을 설정하는 것이 중요하다[2-7]. 과증식 위용종을 치료할 때에는 용종의 크기가 작고 증상이 없는 경우 대부분 주기적으로 추적 관찰을 하여 그 크기의 변화를 살펴볼 수 있으나, 용종의 크기가 1.0~2.0 cm 이상인 경우, 위용종으로 인한 위배출 장애나 실혈 등의 중요 증상이 동반되는 경우 등에는 내시경적 절제를 하게 되며 필요하다면 수술적 제거도 고려한다[8].
헬리코박터 파일로리균(이하 헬리코박터)은 과증식 위용종의 원인이 되는 만성 위축성 위염의 대표적인 유발인자이며, 위선암의 발생을 증가시키는 것으로 알려져 있다[9]. 외국에서는 과증식 위용종이 발견된 환자에서 헬리코박터 양성이 확인된다면 헬리코박터의 제균 치료를 권장하고 있으나[5] 우리나라의 헬리코박터 제균 치료 임상지침에서는 과증식 위용종에 대한 특별한 권고사항은 없다[10]. 또한 우리나라에서 소화성 궤양, 저등급 점막 연관림프조직(mucosa-associated lymphoid tissue) 림프종, 조기위암 절제술 후, 특발성 혈소판 감소성 자반증의 헬리코박터 제균 치료만이 국민건강보험의 요양급여 기준이며 과증식 위용종은 아직까지 헬리코박터 제균 치료 요양급여 기준에 속하지는 않는 실정이다[11].
본 연구는 전향적 연구로 2015년 7월에서 2016년 7월까지 고려대학교 의료원 구로병원에서 내시경을 통하여 과증식 위용종을 진단받고 헬리코박터 양성인 환자를 대상으로 하였다. 이 연구에 참여한 환자는 모두 서면으로 동의를 하였으며, 본 연구를 진행하는 것에 관하여 본원 임상시험심사위원회의 허가를 받았다(IRB No. GR08138-001).
본원에서 위내시경을 시행하여 발견한 위용종의 내시경 소견에 대하여 2명의 내시경 전문의가 평가하여 과증식 위용종을 진단하였다(JJP, MKJ) [1]. 조직검사에서 과증식 위용종으로 진단되었거나[2], 조직검사에서 염증성 변화만 확인된 경우에도 내시경의 육안 소견상 부드러운 윤곽을 가지고 표면에 광택이 나면서 점액질이 있고 중앙에 미란을 동반하는 전형적인 과증식 위용종의 소견을 보이는 경우 과증식 위용종으로 진단하였다[12,13]. 타원에서 시행한 조직검사 결과에서 과증식 위용종으로 진단된 경우를 제외한 모든 위용종에서 내시경적 생검을 시행하였으며, 헬리코박터 감염 여부의 판단을 위하여 위 전정부 및 체부 점막에서 조직검사를 함께 시행하였다. 또한 필요 시 신속 요소효소분해검사(CLO®; Asan Co., Ltd., Asan, Korea)를 병행하여 헬리코박터 감염 여부를 판단하였다. 과증식 위용종의 크기는 상부위장관 내시경 생검 겸자를 이용하여 측정하였고, 생검 겸자가 완전히 핀 상태를 6 mm, 닫혀 있는 경우를 2 mm로 하여 용종의 크기를 평가하였다(Fig. 1) [15]. 여러 개의 용종이 관찰되는 경우 가장 큰 용종의 직경을 측정하였다.
모집된 환자를 대상으로 헬리코박터 제균 치료에 동의하는 환자에게 제균 치료를 시행하였다. 일차 제균 요법은 7일간의 표준 삼제요법(pantoprazole 40 mg bid, amoxicillin 1 g bid, clarithromycin 500 mg bid)으로 시행하였고, 일차 제균에 실패한 경우에는 비스무스 사제요법(pantoprazole 40 mg bid, metronidazole 500 mg tid, tetracycline 500 mg qid, colloidal bismuth 120 mg qid)으로 7일간 치료하였다. 제균 성공 여부는 제균 치료 4~8주 후에 시행한 요소호기검사 결과로 판정하였다. 제균 치료 12개월 후에 일차 추적 내시경 검사를 시행하였고 필요 시 이차 추적 내시경 검사를 24개월 후에 시행하였다. 추적 내시경 검사 시 처음 시행한 내시경 검사와 같은 방법으로 과증식 위용종의 크기 변화를 평가하였다. 제균 치료에 동의하지 않는 환자는 위와 동일한 방법으로 추적 내시경 검사를 시행하였다.
연구 기간 중 헬리코박터 양성이면서 과증식 위용종이 관찰되는 25명의 환자가 전향적으로 모집되었다. 환자 25명의 평균 나이는 62.9±11.8세였으며 14명(56.0%)이 여성이었다(Table 1). 과증식 위용종이 단발성으로 보인 환자는 19명(76.0%), 다발성인 환자는 6명(24.0%)이었으며, 크기는 6 mm 이하인 경우 5명(20.0%), 6~10 mm 8명(32.0%), 10~15 mm인 경우는 6명 (24.0%), 15 mm 이상인 경우는 6명(24.0%)이었다(Fig. 4). 용종의 위치는 전정부 14명(56.0%), 체부 11명(44.0%)이었으며, 무경성 용종의 형태를 보인 것이 19명(76.0%), 유경성 용종은 6명(24.0%)이었다. 전체 환자 중 3명의 환자가 타원에서 시행한 조직검사상 과증식 위용종으로 진단되었으며, 이를 포함한 14명(56.0%)의 환자가 조직학적으로 과증식 위용종으로 확인되었다. 11명(44.0%)의 환자는 만성 위축성 위염을 동반하였다. 전체 환자 중 18명(72.0%)이 제균 치료에 동의하여 제균 치료를 시행하였고, 7명(28.0%)은 제균 치료에 동의하지 않아 경과 관찰하였다.
25명 중 18명이 제균 치료에 동의하여 이 중 16명(88.9%)이 7일의 표준 삼제요법으로 일차 제균 치료에 성공하였다. 일차 제균 치료에 실패한 2명의 환자는 7일간의 비스무스 포함 사제요법으로 이차 제균 치료를 시행하여 1명이 제균 치료에 성공하였으며(50%), 나머지 1명은 제균 치료에 실패하였다. 최종적으로 17명의 제균군과 8명의 비제균군으로 분류할 수 있었으며, 환자의 연령, 성별, 용종의 위치 및 성상 등은 두 군 간에 유의한 차이를 보이지 않았으나 용종의 개수가 단발성인 환자가 제균군에서 15명(88.2%), 비제균군에서 4명(50.0%)으로 제균군에서 유의하게 많았다(P=0.04).
헬리코박터 제균군에서 과증식 위용종의 완전 소실을 보인 환자가 4명(23.5%), 부분 소실을 보인 환자가 8명(47.1%), 용종의 크기 변화가 없었던 환자가 5명(29.4%)이었으며, 비제균군 (8명)에서는 완전 소실을 보인 환자가 2명(25%), 용종의 크기 변화가 없었던 환자가 6명(75%)이었다(Fig. 5). 헬리코박터 제균 치료를 하였으나 치료에 실패하여 비제균군으로 분류된 1명의 환자에서는 용종의 크기 변화가 없었다. 용종의 완전 소실률은 양 군 간에 유의한 차이가 없었으나(4/17 [23.5%] vs. 2/8 [25.0%], P=0.93), 용종의 부분 소실률은 제균군에서 47.1% (8/17), 비제균군에서 0% (0/8)로 유의한 차이를 보였으며(P=0.01), 완전 소실과 부분 소실을 합산한 용종 소실률은 제균군에서 70.6% (12/17), 비제균군에서 28.6% (2/8)로 제균군에서 유의하게 높았다(P=0.03, Fig. 6 and Tables 2, 3). 과증식 위용종의 크기 및 숫자에 따라서 용종 소실률을 비교하였을 때, 용종의 크기가 10 mm 초과인 경우 제균군(9명) 중 5명에서 용종의 소실을 보였고, 비제균군(3명)에서는 용종의 소실이 나타나지 않았으나 이는 통계적으로 유의하지는 않았다(P=0.09). 10 mm 이하인 경우 제균군(8명) 중 7명, 비제균군(5명)에서는 2명에서 용종의 소실을 보여 제균군에서 용종 소실률이 높았으나 이 또한 통계적으로 유의한 차이는 없었다(P=0.07). 용종이 단발성인 경우 제균군(15명) 중 10명, 비제균군(4명) 중 1명에서 용종의 소실을 보여 제균군에서 용종 소실률이 높았으나 통계적으로 유의한 차이는 없었고(P=0.13), 다발성인 경우에도 제균군(2명) 중 2명, 비제균군(4명) 중 1명에서 용종의 소실을 보였으나 유의한 차이는 나타나지 않았다(P=0.13, Table 3).
과증식 위용종의 소실 여부와 관련된 예측인자를 확인하기 위하여 환자의 나이, 성별, 용종의 개수, 크기, 위치, 모양, 헬리코박터 제균 여부에 대하여 회귀분석을 시행하였다. 단변량 분석에서 여성 및 헬리코박터 제균이 유의한 예측인자로 나타났고, 다변량 분석에서도 여성(OR, 12.947; 95% CI, 1.038~161.503; P=0.047) 및 제균 여부(OR, 40.047; 95% CI, 1.112~1,442.767; P=0.044)가 통계적으로 유의한 인자였다(Table 4).
본 연구는 헬리코박터 제균에 따른 과증식 위용종의 소실 여부를 전향적으로 관찰한 연구로서, 용종 소실률은 제균군에서 70.6%, 비제균군에서 28.6%로 제균군에서 유의하게 높았으며(P=0.03), 여성 및 헬리코박터 제균 여부가 용종 소실의 예측인자로 유의하게 나타났다(P=0.047, P=0.044). 본 연구는 헬리코박터 제균이 과증식 위용종의 효과적인 치료로서 고려될 수 있음을 전향적으로 고찰한 연구로서 그 임상적 의의가 있다고 하겠다.
과거 헬리코박터 제균 치료가 과증식 위용종의 소실을 유발함을 보여주는 여러 연구가 진행된 바 있다. 과거의 관찰 연구에서 헬리코박터 제균 치료를 시행한 160예의 약 90%에서 용종의 부분 소실 및 완전 소실을 보여준 연구가 있으며, 222예의 과증식 위용종 중 73%에서 제균 치료 3개월 후에 용종 크기가 감소하였다[16,18]. 그러나 후향적으로 의무기록을 관찰한 연구로서의 제한점이 있었다.
이전 연구에서는 연령 및 성별, 용종의 위치, 크기 등이 과증식 위용종 소실의 유의한 인자로서 제시된 바 있다[5,19]. 본 연구에서는 다변량 분석에서 헬리코박터 제균 여부와 여성이 통계적으로 유의한 예측인자로 분석되었다. 그러나 두 인자의 신뢰구간이 1.112~1,442.767, 1.038~161.503로 크게 관찰되었는데, 이는 표본의 수가 25명으로 적었기 때문으로 생각된다. 추후 대상 환자수를 늘리는 등의 추가 연구가 필요할 것이다.
본 연구의 계획 단계에서는 참여한 환자군을 제균군과 비제균군으로 무작위 배정하여 연구를 시행하고자 하였으나, 대부분의 환자가 제균 치료 없이 경과 관찰하는 것에 동의하지 않았기 때문에 무작위로 배정할 수 없었다. 따라서 제균 치료에 동의하는 환자들에게는 제균 치료를, 제균 치료에 동의하지 않는 일부 환자에서는 경과 관찰하였고, 이로 인하여 양 군 간에 임상적 특징이 편향된 한계점이 있었으며, 실제로 양 군 간 용종수에서 유의한 차이를 보였다. 그러나 기타 연령, 성별, 용종의 위치, 용종의 성상 등의 임상 특성은 양 군 간에 유의한 차이는 없었다.
연구에 참여한 모든 환자에서 위용종에 대하여 내시경적 생검을 시행하였으나 14명(56.0%)에서만 조직학적으로 과증식 위용종으로 진단되었고 11명(44.0%)에서는 만성 활동성 위염으로 나타났다. 과증식 위용종은 조직학적으로 선와 상피가 길게 늘어지고 확대되며 구조적으로 뒤틀린 모양을 하고 있고 부종을 동반한 점막 고유층이 함께 관찰되나,19 실제 일반적인 용종에서 조직검사를 시행하였을 때 조직병리 소견이 일치하지 않는 경우가 20~40%까지 보고되고 있어 병리학적 진단에는 다소 이견이 있다[20]. 본 연구에서는 과거 연구 사례에 기반하여 조직 생검 외에도 특징적인 내시경 소견으로 과증식 위용종을 진단하였는데, 내시경상 부드러운 표면과 윤곽을 보이고 광택이 나면서 점액질을 동반하며 반구형의 모양을 가지거나 기둥에 매달려 있는 모양을 하고 중앙에 미란이 같이 관찰되면 과증식 위용종에 포함시켰다[12,13].
본 연구에 포함된 과증식 위용종 환자 중 76.0% (19/25)가 단발성 용종이었고 52.0% (13/25)가 10 mm 이하의 크기를 보였다. 용종이 단발성이거나 크기가 작을 경우에는 생검을 시행하는 것으로 용종의 소실이 발생할 가능성이 있으며 본 연구에 포함된 환자에서는 모두 내시경적 생검을 시행하였다. 과증식 위용종을 단발성과 다발성, 10 mm 이하와 10 mm 초과로 분류하여 각각 제균군과 비제균군 사이의 용종 소실 여부를 비교 하였으나 모두 통계적으로 유의한 차이는 없었다. 그러나 10 mm 초과의 과증식 위용종의 경우 제균군에서 55.6% (5/9)가 용종의 부분 소실 및 완전 소실을 보였고, 비제균군에서는 부분 혹은 완전 용종 소실을 보인 과증식 위용종은 관찰되지 않았다. 다발성의 경우에도 통계적 유의성을 보여주지는 못하였으나 제균군에 속하는 모든 환자에서 용종의 소실이 나타났고 비제균군에서는 4명 중 1명에서만 용종의 소실이 있었다(Table 3). 요약하면 용종의 크기에 상관없이 헬리코박터 제균군에서 비제균군에 비하여 더 흔하게 용종이 소실되는 경향이 있었으나, 본 연구의 환자의 수가 적어 통계적 유의성을 보여주지 못한 것으로 판단되어 향후 대규모 환자를 포함하는 후속 연구가 필요할 것으로 생각된다.
과증식 위용종은 위장의 만성적인 염증이 위 상피세포를 자극하게 되고 이로 인하여 점막이 과도하게 재생하여 발생하는 것으로 알려져 있다. 따라서 위장의 만성적인 염증이 존재하는 상태, 즉 만성 위염, 악성 빈혈 등이 유발인자가 될 수 있으며 궤양 및 미란에 인접하는 부위나 위장문합술을 시행한 곳에서 주로 발견된다[21,22]. 과증식 위용종의 악성 변화에 대해서는 아직 확립된 연구가 없어 무증상일 때의 치료는 아직 논란의 여지가 있다[3,5,6]. 미국의 가이드라인에서는 과증식 위용종이 0.5 cm 이상일 경우에 악성이 될 위험성이 있다고 하여 용종절제술을 통하여 그 병리 결과를 확인할 것을 권고하고 있다[23]. 우리나라에서는 일반적으로는 용종이 커지면서 악성으로 변할 위험성이 증가한다고 하여 2 cm 이상의 용종에 대해서는 대부분 용종절제술을 시행하고 있다. 임상적으로 크기가 1 cm 이하인 용종들은 내시경적 추적 관찰을 통하여 그 크기 변화를 확인하여 추후 치료를 결정하고, 1~2 cm 사이의 용종들은 환자의 상태에 따라 내시경적 절제를 하거나 조직 생검을 시행하여 성상을 확인하게 된다[8]. 과증식 위용종의 크기가 증가하거나 그성상이 변할 경우 결국 내시경적 절제를 고려하게 되는데, 용종의 크기가 충분히 크지 않거나 그 수가 많을 때에는 용종절제술을 시행하는 것에 어려움이 있다. 또한, 용종절제술은 시술 중 출혈 및 천공 등의 합병증이 발생할 위험이 있으며 환자에게 경제적, 사회적인 부담을 줄 수 있다. 이러한 상황에서 헬리코박터 제균 치료를 통하여 용종을 소실시킬 수 있다면 불필요한 내시경적 절제를 줄일 수 있을 것이다.
과증식 위용종의 크기 변화 외에도 조직의 면역염색 소견이 용종의 악성 변화에 영향을 끼친다는 연구 결과가 있다. 과거의 연구에서는 과증식 위용종에서 상피내 이형성증으로 변화한 경우의 41%, 악성 신생물로 변화한 경우의 50%에서 p53 단백질 발현과 Ki-67 항원 증식이 관찰되었다[24]. 현재 임상에서 과증식 위용종의 크기를 기준으로 용종절제술을 시행하고 있으나 추후에는 과증식 위용종의 면역형광염색 결과를 참고하여 용종절제술의 적응증을 확립할 수도 있을 것이다.
헬리코박터 감염에 의한 과증식 위용종 발생의 기전은 아직 명확하게 밝혀지지 않았다. 과거의 연구에서는 헬리코박터가 위 점막에서 interleukin-1 beta 및 간세포 증식인자의 분비를 증가시키고 이로 인하여 표피세포와 선와 상피의 증식이 야기되어 과증식 위용종이 발생할 수 있다고 발표된 바 있다[22]. 헬리코박터 제균 치료를 하였을 때 이러한 기전을 차단하여 과증식 위용종의 소실 및 위 점막내 염증의 호전 등의 효과를 기대할 수 있으며, 이 기전에 대한 추가적인 연구가 필요하다.
본 연구에서는 헬리코박터 제균 치료를 하지 않은 2예에서 내시경적 추적 관찰 시 과증식 위용종의 완전 소실을 보인 경우가 존재하였다. 제균 치료를 하지 않았음에도 불구하고 자연적으로 용종이 소실되는 현상에 대한 기전은 명확히 밝혀져 있지 않아 이에 대한 추가 연구가 필요하다. 헬리코박터 제균 이외에 용종의 소실에 유의한 영향을 미치는 인자가 있다면 헬리코박터 제균 치료군을 한정하는 것이 가능하고, 제균 치료로 인한 부작용 및 환자의 경제적 부담을 줄이는 데에 기여할 수 있다. 본 연구에서는 여성이 과증식 위용종의 소실에 유의한 인자로 확인되었으나 이에 대한 기전은 명확하지 않다. 대상 환자를 확대시킨 추가 연구를 통하여 과증식 위용종 소실의 예측인자를 파악할 수 있을 것이다.
본 연구의 제한점은 다음과 같다. 첫째, 헬리코박터의 제균 치료 여부를 무작위로 배정하지 못하였다. 이에 따르는 양 군 간의 임상적 특징의 차이가 예상되었으나, 실제로는 용종의 개수 외에는 통계적으로 유의한 차이가 없었다. 둘째, 제균 치료를 동의하지 않은 사람들은 기저 질환으로 인하여 헬리코박터 제균에 의한 약 부작용이나 순응도가 우려되는 환자들이 대부분이었다. 셋째, 대상 환자의 수가 25명으로 적었기 때문에 통계 분석에 어려움이 있었다. 넷째, 헬리코박터 제균 치료 후 제균이 확인된 환자에서 추적 내시경을 시행하였을 때 헬리코박터 재감염에 대한 검사를 시행하지 않았다. 헬리코박터 치료 후에도 재감염이 가능하며 외국에서는 1년에 약 0.5~2.5%, 우리 나라에서는 1년에 9.1%까지 재감염이 발생한다고 하여[25] 이에 의한 오차가 발생할 가능성이 있었다. 결론적으로 과증식 위용종에서 추후 무작위 배정을 통한 다기관 연구가 필요하며, 결과에 따라 현재 우리나라의 보험급여 기준에서 헬리코박터 양성인 과증식 위용종 환자를 포함시키는 것을 적극적으로 고려할 근거로 삼을 수 있을 것이다.
Fig. 1.
Endoscopic measurement of a gastric hyperplastic polyp. (A) Closed forceps: 2 mm. (B~D) Open forceps: 6 mm.

Fig. 2.
Endoscopic finding showing polyp regression, with ≥50% reduction in size. (A) Before H. pylori eradication. (B) After H. pylori eradication.
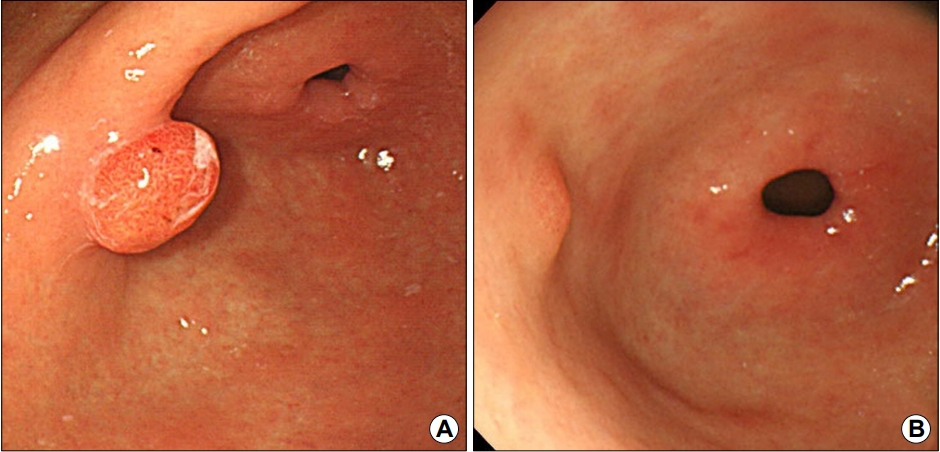
Fig. 3.
Endoscopic finding showing no polyp regression, with <50% reduction in size. (A) Before H. pylori eradication. (B) After H. pylori eradication.
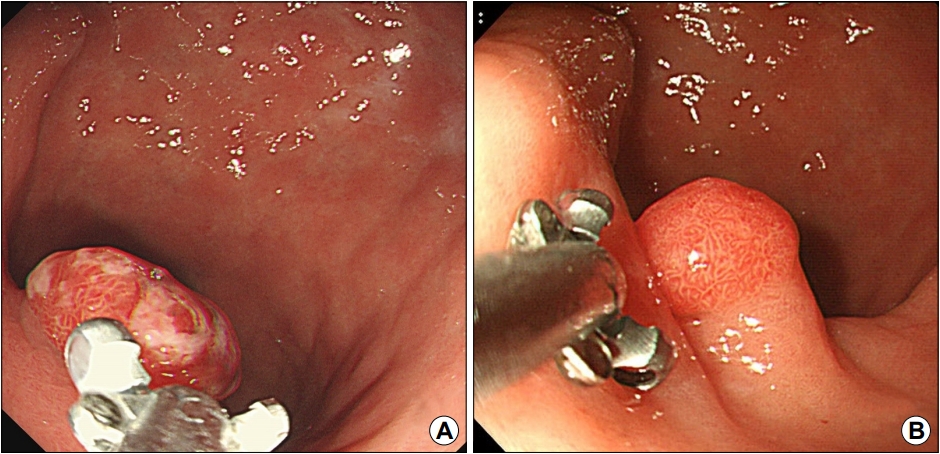
Fig. 4.
Endoscopic findings of hyperplastic polyps with different sizes. (A) 5 mm, (B) 10 mm, (C) 15 mm, and (D) 20 mm.
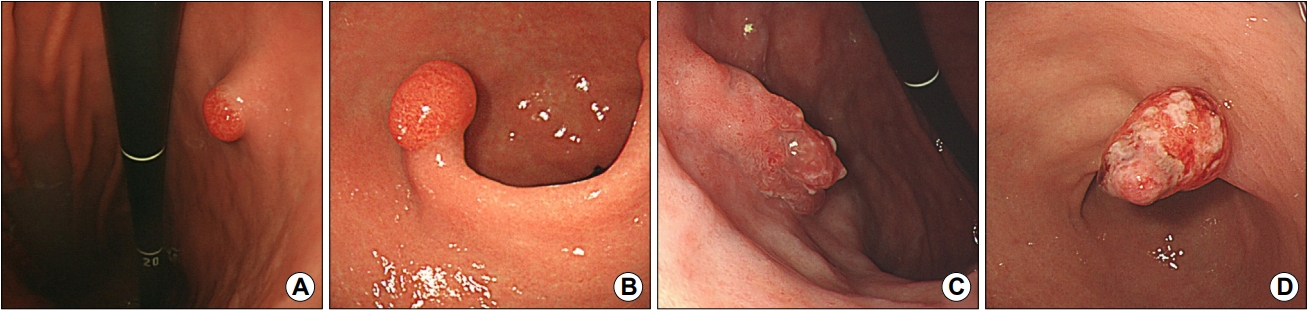
Fig. 5.
Study flow. Classification of patients and polyp regression rates. H. pylori, Helicobacter pylori.
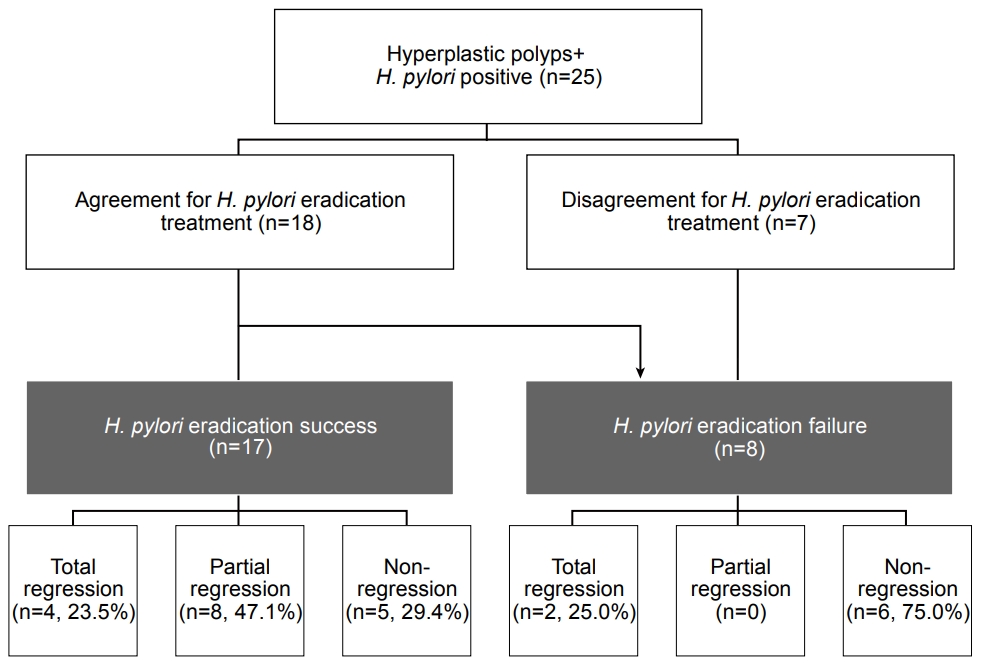
Table 1.
Baseline Characteristics of the Patients
Table 2.
Comparison of Patient Characteristics between the Eradication and Non-eradication Groups
Table 3.
Comparison of Polyp Regression Rates between the Eradication and Non-eradication Groups
Table 4.
Predictive Factors of Polyp Regression
REFERENCES
1. Stolte M, Sticht T, Eidt S, Ebert D, Finkenzeller G. Frequency, location, and age and sex distribution of various types of gastric polyp. Endoscopy 1994;26:659–665.



2. Ahn JY, Son DH, Choi KD, et al. Neoplasms arising in large gastric hyperplastic polyps: endoscopic and pathologic features. Gastrointest Endosc 2014;80:1005–1013; e2.


3. Daibo M, Itabashi M, Hirota T. Malignant transformation of gastric hyperplastic polyps. Am J Gastroenterol 1987;82:1016–1025.

4. Dirschmid K, Platz-Baudin C, Stolte M. Why is the hyperplastic polyp a marker for the precancerous condition of the gastric mucosa? Virchows Arch 2006;448:80–84.



5. Goddard AF, Badreldin R, Pritchard DM, Walker MM, Warren B; British Society of Gastroenterology. The management of gastric polyps. Gut 2010;59:1270–1276.


6. Hizawa K, Fuchigami T, Iida M, et al. Possible neoplastic transformation within gastric hyperplastic polyp. Application of endoscopic polypectomy. Surg Endosc 1995;9:714–718.



7. Orlowska J, Jarosz D, Pachlewski J, Butruk E. Malignant transformation of benign epithelial gastric polyps. Am J Gastroenterol 1995;90:2152–2159.

8. Ji F, Wang ZW, Ning JW, Wang QY, Chen JY, Li YM. Effect of drug treatment on hyperplastic gastric polyps infected with Helicobacter pylori: a randomized, controlled trial. World J Gastroenterol 2006;12:1770–1773.



9. You WC, Zhang L, Gail MH, et al. Gastric dysplasia and gastric cancer: Helicobacter pylori, serum vitamin C, and other risk factors. J Natl Cancer Inst 2000;92:1607–1612.


10. Kim SG, Jung HK, Lee HL, et al. Guidelines for the diagnosis and treatment of Helicobacter pylori infection in Korea, 2013 revised edition. Korean J Gastroenterol 2013;62:3–26.


11. Koh JS, Joo MK. Helicobacter pylori eradication in the treatment of gastric hyperplastic polyps: beyond National Health Insurance. Korean J Intern Med 2018;33:490–492.




12. Kume K, Hirakoba M, Murata I, Yoshikawa I, Otsuki M. Disappearance of both MALT lymphoma and hyperplastic polyps in the stomach after eradication of Helicobacter pylori. Am J Gastroenterol 2001;96:2796–2797.


13. Oberhuber G, Stolte M. Gastric polyps: an update of their pathology and biological significance. Virchows Arch 2000;437:581–590.



14. Saccá N. Hyperplastic gastric polyps and Helicobacter pylori. Scand J Gastroenterol 2003;38:904.


15. Lim SA, Yun JW, Yoon D, et al. Regression of hyperplastic gastric polyp after Helicobacter pylori eradication. Korean J Gastrointest Endosc 2011;42:74–82.
16. Nam SY, Park BJ, Ryu KH, Nam JH. Effect of Helicobacter pylori infection and its eradication on the fate of gastric polyps. Eur J Gastroenterol Hepatol 2016;28:449–454.


17. Nam SY, Park BJ, Ryu KH, Nam JH. Effect of Helicobacter pylori eradication on the regression of gastric polyps in National Cancer Screening Program. Korean J Intern Med 2018;33:506–511.



18. Shim CS, Lee DW, Cho JY, Jin SY, Kim HJ, Kim DW. Pathologic classification and evaluation of gastric benign polypoid lesions on endoscopy. Korean J Gastrointest Endosc 1997;17:604–611.
19. Shaib YH, Rugge M, Graham DY, Genta RM. Management of gastric polyps: an endoscopy-based approach. Clin Gastroenterol Hepatol 2013;11:1374–1384.



20. Muehldorfer SM, Stolte M, Martus P, Hahn EG, Ell C, Multicenter Study Group Gastric Polyps. Diagnostic accuracy of forceps biopsy versus polypectomy for gastric polyps: a prospective multicentre study. Gut 2002;50:465–470.



22. Yasunaga Y, Shinomura Y, Kanayama S, et al. Increased production of interleukin 1 beta and hepatocyte growth factor may contribute to foveolar hyperplasia in enlarged fold gastritis. Gut 1996;39:787–794.



23. ASGE Standards of Practice Committee, Sharaf RN, Shergill AK, et al. Endoscopic mucosal tissue sampling. Gastrointest Endosc 2013;78:216–224.


-
METRICS

-
- 1 Crossref
- 6,616 View
- 104 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
The Recurrence of Helicobacter pylori Infection: Recrudescence Versus Reinfection2023 December;23(4)
Vonoprazan-based Dual and Triple Therapy for Helicobacter pylori Eradication2023 September;23(3)







