내시경으로 관찰된 식도 결핵 궤양에서 견인성 식도 게실의 형성 과정
Sequential Endoscopic Findings of a Tuberculous Esophageal Ulcer that Developed into a Traction Diverticulum
Article information
Trans Abstract
Esophageal diverticula are uncommon lesions that are usually classified according to location, layers of the wall, and underlying pathogenesis. A true traction esophageal diverticulum, which is commonly seen in the middle one-third of the thoracic esophagus, occurs secondary to mediastinal inflammatory lesions, such as those caused by tuberculosis. Esophageal tuberculosis usually develops secondary to tuberculous lymphadenitis or lung lesion; it manifests with various endoscopic findings such as single or multiple ulcers, elevated lesions with ulcers at the center, extrinsic compressions, fistulas, and rarely, anthracosis. Its shape can vary greatly depending on disease progression and treatment. Herein, we report sequential endoscopic findings of a tuberculous esophageal ulcer that turned into a depressed lesion with black-pigmentation, finally developing into a typical traction esophageal diverticulum in a patient with mediastinal lymphadenitis.
서 론
식도 게실은 식도 내강으로부터 바깥쪽으로 돌출되어 주머니 형태의 공간이 생기는 질환으로, 발생 부위(인두 식도부, 식도 중간부, 횡경막 상부), 게실 벽을 구성하는 조직(진성, 가성) 또는 발생 기전(압출성, 견인성)에 따라 분류된다[1]. 대부분이 식도 내압의 증가에 의하여 점막 및 점막하층이 근육층 사이로 밀려 나오는 압출성 가성 게실로 인두 식도부 및 횡격막 상부 게실이 이에 해당된다. 식도 중간부에서 종격동 림프절의 염증 반응 때문에 식도벽 전층이 견인되어 발생하는 진성 게실은 결핵이 가장 흔한 원인이며, 드물게 히스토플라즈마증, 유육종증, 비호 지킨 림프종, 폐암과 연관되기도 한다[1-5]. 식도 결핵은 내시경검사 시 단발성 혹은 다발성 궤양, 중심부에 궤양을 동반한 융기형 병변, 외부 압박, 누공 그리고 드물게 탄분증 등의 다양한 소견을 보이고 치유되면서 진성 게실을 형성하기 때문에 질환의 시기에 따라 그 모양이 매우 다르게 나타날 수 있다[6-8]. 저자들은 종격동 림프절염에 동반한 식도 결핵 환자에서 융기형 식도 궤양이 전형적인 견인성 식도 게실로 진행하는 과정을 순차적으로 내시경으로 확인하였기에 문헌 고찰과 함께 보고하는 바이다.
증 례
65세 여자가 내원 5개월 전부터 시작된 삼킴통증으로 내원하였다. 환자는 30년 전 폐결핵으로 6개월간 항결핵제를 복용 후 완치 판정을 받은 과거력이 있었다. 흡연력은 없었고 직업력을 포함하여 탄분에 노출된 병력은 없었다. 내원 당시 혈압은 130/90 mmHg, 맥박은 70회/분, 호흡수는 20회/분, 체온은 36.5℃였다. 급성 병색은 보이지 않았고 두경부 진찰에서 촉지되는 림프절 등 특이 소견은 보이지 않았다. 복부는 편평하였고 정상적인 장음이 청진되었으며, 복부의 압통 및 반발통은 없었다. 원인 평가를 위하여 시행한 상부위장관 내시경 검사에서 앞절치로부터 26~29 cm 하방 중부 식도에 선상의 궤양이 가장 자리는 비후되어 융기된 병변 형태로 관찰되었다(Fig. 1A, B). Lugol 용액을 도포하였을 때 뚜렷한 탈색 부위는 관찰되지 않았다(Fig. 1C). 식도 궤양에서 시행한 조직검사에서 점막하층에 만성 육아종성 염증 소견이 관찰되었으나 항산균은 발견되지 않았다(Fig. 2). 흉부 전산화단층촬영에서 우중엽에 국소적 무기폐 소견과 우측 폐문부(hilar) 및 기관분지부하(subcarinal) 림프절 종대 소견이 관찰되었다(Fig. 3). 이상의 결과를 바탕으로 종격동 림프절염이 동반된 식도 결핵으로 진단하였지만 환자는 항결핵제 복용을 거부하였다. 항결핵 약물 치료 없이 소화기 항궤양 약제만 복용하면서 관찰하는 도중 삼킴통증은 호전되었다. 8개월째 시행한 추적 내시경 검사에서 기존의 궤양과 주변의 비후성 병변이 함몰성 병변으로 변형되어 있었으며, 종주성 섬유화 융기와 점막하 흑색소 침착이 함몰부의 기저에서 관찰되었다(Fig. 4A). 이후 환자는 치료에 동의하여 6개월간 항결핵제를 복용하였다. 약물 치료가 종결된 진단 14개월째에 시행한 추적 내시경 검사에서 기저 종주성 융기 병변과 색소 침착은 감소하였고 균질한 섬유화로 이루어진 함몰은 더 진행된 상태였다(Fig. 4B). 진단 25개월 및 40개월째 시행한 추적 내시경 검사에서는 완전히 형성된 견인성 식도 게실이 크기 변화없이 유지되는 것을 관찰할 수 있었다(Fig. 4C, D).
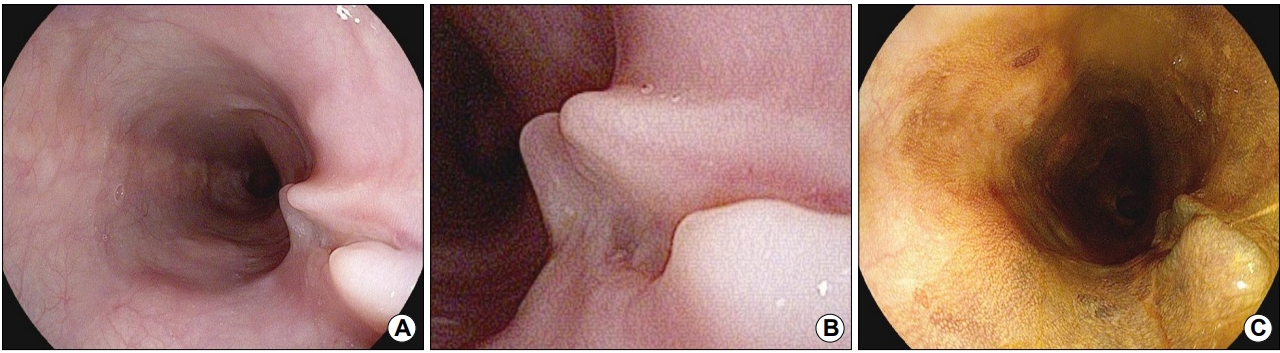
(A, B) Upper endoscopy revealing a linear ulcerative lesion with a smooth surface and elevated margin on the right side of the mid-esophagus. (C) The lesion is stained well by Lugol solution.
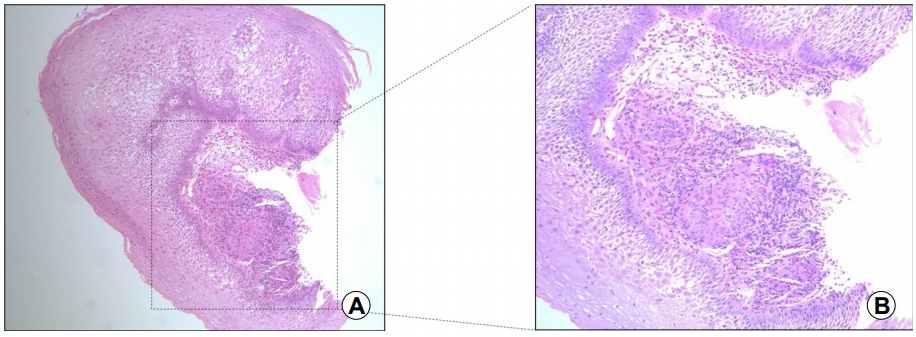
(A) Endoscopic biopsy revealing chronic granulomatous inflammation in the mucosa and submucosa of the esophageal wall (H&E, ×100). (B) Granuloma is formed with a nodular collection of epithelioid macrophages surrounded by a rim of lymphocytes (H&E, ×200).
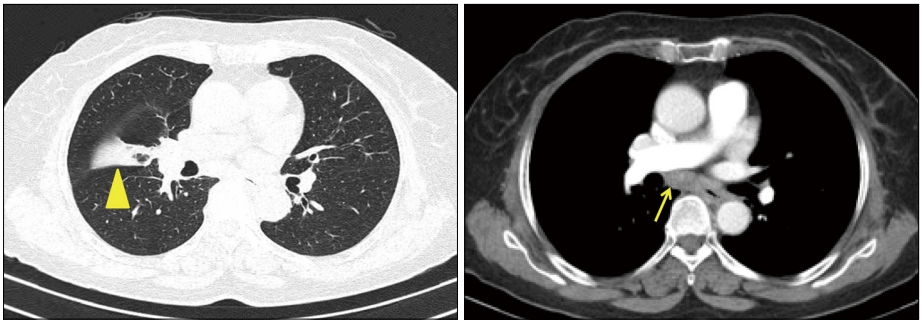
Chest contrast CT showing focal atelectasis in the right middle lobe (arrowhead) and subcarinal lymphadenopathy (arrow).
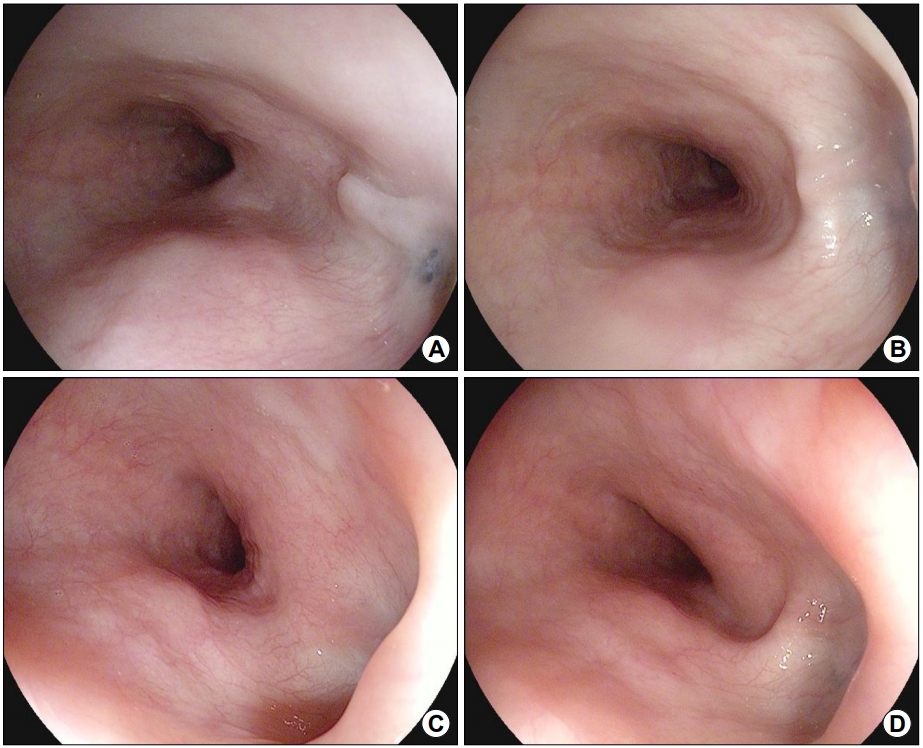
Sequential endoscopic findings. (A) At 8 months after diagnosis without treatment, the previous ulcerative lesion is seen to have changed to a depressive area with linear fibrotic ridge and black pigmentation at the base. (B) At 14 months after diagnosis, i.e., 6 months after the initiation of antituberculosis medication, the lesion is seen to have changed into an outpouching lesion with a more even fibrotic base. (C, D) At 25 and 40 months after diagnosis, a wide traction diverticulum with a smooth mucosal surface on the base is seen.
고 찰
식도 결핵은 드문 질환으로 감염 경로에 따라 일차성과 이차성으로 나눌 수 있다[9]. 대부분 이차성 식도 결핵으로 종격동 림프절, 폐, 척추 등의 인접 구조물에서 전파된 경우이고, 일차성 식도 결핵은 신체 다른 부위에 결핵의 증거가 없는 경우로서 매우 드물다[2,6,7]. 식도 결핵의 임상 증상은 체중 감소, 발열, 오한, 권태감 등의 전신 증상과 흉통, 삼킴곤란, 기침 등의 국소 증상으로 다양하다[9,10]. 이 중 가장 흔한 증상인 삼킴곤란은 결핵에 의한 식도 침범, 종격동 림프절염에 의한 식도 압박, 종격동 섬유화에 의한 압박 및 식도 운동 이상으로 발생한다[9,11]. 활동성 염증 병변이 치유되어 견인성 식도 게실이 만들어진 경우는 게실의 입구 부위가 넓기 때문에 증상이 유발되는 경우는 드물다[1]. 진단은 내시경, 식도 조영술, 흉부 전산화단층촬영, 조직검사 및 항결핵제에 대한 치료 반응에 의하여 이루어진다. 결핵이 의심되는 병변에서 얻은 조직 검체에서 건락성 괴사를 동반한 육아종 염증 소견, 거대세포 혹은 상피모양세포, 항산균 등 결핵의 특징적인 소견이 관찰되면 진단에 도움이 된다. 조직검사에서 항산균 염색이나 균 배양 혹은 PCR을 시행하지만 이러한 검사에서 양성으로 확인되지 않고 만성 육아종만 관찰되는 경우가 흔하고, 한 번의 내시경 조직검사를 통한 진단율은 50% 정도로 낮아 반복적인 조직검사가 필요할 수 있다[10]. 이러한 소견은 비결핵 항산균 감염, 진균 감염, 브루셀라증, 매독 등에서도 나타날 수 있어 진단에 주의를 요한다[12]. 본 증례의 경우 만성 육아종성 염증 소견과 항결핵제 복용 이후 염증이 치유되는 것으로 식도 결핵을 진단할 수 있었다. 내시경 조직검사만으로 진단이 되지 않았을 경우 대부분의 식도 결핵에서 관찰되는 종격동 림프절에 대한 초음파내시경 유도하 세침 흡입 검사가 진단을 위하여 필요하다[13]. 이에 대하여 Fritscher-Ravens 등[14]은 민감도 86%, 특이도 100%, 양성 예측률 100%, 음성 예측률 91%로 높은 진단율을 보고하였다. 경구 섭취 시 기침이 발생한 경우는 기관식도 누공을 의심할 수 있는데 식도 조영술로 조영제의 식도 외 누출의 소견을 확인할 수 있다[7,9]. 흉부 전산화단층촬영은 폐 및 림프절 병변이나 기관식도 누공 같은 합병증을 찾는 데 도움이 된다[15]. 결핵 치료는 세균학적 또는 임상적으로 결핵으로 진단된 환자에게서 시작한다. 식도 결핵의 치료는 비수술적 치료에 반응하지 않는 종격동 농양, 대량 출혈 및 천공이나 식도 협착이 심한 경우에는 수술적 치료가 필요한 경우가 있으나[16,17] 기관식도 누공을 포함한 대부분에서는 항결핵제만으로 잘 치유된다[18]. 식도 결핵의 치료 기간은 뚜렷하게 제시된 지침은 없으나 6~12개월로 다양하며 예후는 좋은 것으로 알려져 있다[10,17,19].
식도 결핵의 내시경적 소견은 궤양형, 비후형, 과립형 등으로 다양하고 비특이적으로 식도암 등과 혼동될 수 있다[6]. 식도 궤양이 가장 흔하며, 대개 중부 식도에 명확하면서도 불규칙한 경계의 소견을 보이는 궤양 소견과 융기된 주위 정상 점막 조직으로 마치 산봉우리와 같은 형태로 보인다[6,7,10,12]. 종격동 종괴로 인한 식도 압박 소견이나 식도 협착, 게실 등의 소견도 비교적 흔한 것으로 보고되었다[12]. 본 증례에서도 처음 진단 당시 병변은 산봉우리 같은 융기된 병변의 중앙에 종주성 궤양이 관찰되었다. 그러나 치료를 하지 않고 추적 관찰하던 중 궤양 병변은 소실되고 그 부위가 섬유화된 함몰 병변으로 바뀌었으며, 중심부에 점막하 흑색소가 침착된 것이 관찰되었다. 비록 조직 검사를 시행하지는 않았으나 이 병변은 식도 결핵 시 드물게 관찰되는 식도 탄분증(anthracosis)으로 생각되었다[8,20]. 기관 내에 흑색 색소 침착이 되는 탄분증은 분진 흡입이나 결핵과 연관되는데[21], 식도 탄분증은 흔하지 않으며 탄분 노출 병력이 없는 환자의 경우 결핵이나 육아종성 질환과 연관되어 몇 개의 증례만 보고되었다[8]. 하지만 식도 탄분증의 경우 탄분 노출, 결핵 혹은 육아종성 질환과 관련 없이 무증상 환자에서 우연히 발견되는 경우도 있다[22]. 본 환자의 경우 탄분 노출력이나 흡연력은 없었는데, 이러한 경우 여자 환자에서 탄분증이 발생할 수 있는 원인으로는 아시아 지역에서 석탄이나 나무 같은 biomass를 태워 요리를 하면서 환기가 충분하지 않은 경우가 제시되었다. 터키의 한 연구에서는 biomass smoke에 의한 기관지 탄분증과 결핵이 동반된 예를 보고하였다[23]. 식도 탄분증 병변에 대한 조직검사에서는 탄분 색소를 포함한 대식세포가 관찰된다. 발생 기전은 불명확하나 폐 탄분증의 일부로 발생하거나 식도 주위 림프절염 및 결핵 감염 부위와 식도가 직접 접촉하여 발생하는 것으로 추정된다[8,10,24]. 식도 절제술을 시행하였던 한 증례에서는 식도 근층의 탄분증 병변과 식도 주위 림프절의 탄분증 병변이 식도 외막에 의하여 분리되어 독립적으로 존재하는 경우도 보고되었다[25]. 식도 탄분증은 식도 흑색종과의 감별이 필요한데, 내시경적으로 식도 흑색종은 종괴를 형성하는 용종 형태로 발생하며 주로 하부 식도에서 관찰된다[8]. 이와 달리 식도 탄분증은 견인 게실의 바닥에 평평한 색소 침착 형태로 발생하며 대부분 중부 식도에서 관찰된다[10]. 흑색종과의 감별을 위해서는 조직검사가 필요하지만 본 증례에서는 이미 식도 결핵으로 진단된 환자에서 전형적 융기형 궤양이 견인 게실로 진행하면서 식도벽이 얇아져 있었고 내시경 소견이 탄분증에 합당한 소견이어서 시행하지는 않았다. 그러나 만약 선행하는 식도 결핵 병변의 관찰 없이 색소 침착 병변을 처음 발견한다면 조직검사가 필요할 것이다[8]. 또한 본 증례에서 융기성 궤양이 항결핵제 치료를 하지 않았음에도 색소 침착이 동반된 함몰성 병변으로 변화되었는데, 이는 식도 결핵의 자연 경과를 보여주는 일부의 소견으로 생각된다. 비슷한 증례로 Nishiyama 등[8]은 색소 침착을 동반한 식도의 함몰성 병변이 관찰되어 종격동 림프절에 대한 초음파내시경 유도하 세침흡입 검사를 통하여 결핵을 진단한 바 있다. 이와는 달리 결핵으로 진단된 융기성 식도 궤양이 항결핵제 치료 후 호전되어 평탄해진 부위에 색소 침착이 되고 초음파내시경 검사에서 식도벽이 복구되면서 림프절 종대가 호전되거나 과거 결핵 치료 병력이 있는 환자에서 기관지 탄분증과 함께 식도 함몰성 색소 침착 병변이 관찰된 경우도 보고되었다[26,27]. 그러므로 중부 식도에서 색소 침착이 동반된 견인 게실이 관찰된 경우 결핵으로 인한 염증 변화를 원인 중 하나로 고려할 수 있지만 현재 감염을 의미하지 않기 때문에 활동성 여부 판단을 위한 검사와 초음파내시경을 통한 종격동 림프절에 대한 확인이 필요하다.
식도 결핵 병변의 치료에 따른 내시경적 변화 과정에 대해서는 잘 알려져 있지 않은데, 저자들은 종격동 림프절염에 동반한 이차성 식도 결핵 환자에서 전형적인 융기형 식도 궤양이 색소 침착이 동반된 함몰형 병변을 거쳐 완전한 견인성 식도 게실이 발생하는 과정을 내시경을 통하여 순차적으로 확인하였기에 보고하는 바이다.
Notes
No potential conflict of interest relevant to this article was reported.
