위축성 위염과 장상피화생의 자연 경과
Natural Course of Atrophic Gastritis and Intestinal Metaplasia
Article information
Trans Abstract
Atrophic gastritis (AG) and intestinal metaplasia (IM) are considered the main precursor lesions of gastric cancer, and the risk of gastric cancer in the gastric mucosa increases in the presence of AG and IM. The development of intestinal-type gastric adenocarcinoma represents the last step of an inflammation-metaplasia-dysplasia-carcinoma sequence, called the Correa cascade of multistep gastric carcinogenesis. The incidences of both AG and IM tend to increase with age. Helicobacter pylori is regarded the most important factor in the development of IM; the progression of AG to IM is also affected by numerous environmental factors and individual genetic factors. Therefore, understanding the natural course of AG and IM is very important, especially in areas with a high prevalence of gastric cancer such as Korea.
서 론
위암은 세계적으로 다섯 번째로 흔히 발생하는 암종으로, 전체 암으로 인한 사망 중 세 번째로 흔한 사망 원인이다[1]. 위암은 우리나라를 포함한 동아시아, 동유럽, 중앙 및 남아메리카 지역에서 발병률이 높다. Helicobacter pylori (H. pylori) 감염, 흡연, 음주, 비만, 과도한 염분 섭취, 위암의 가족력 등과 전암성 병변으로 위축성 위염, 장상피화생 등이 위암의 위험 요인으로 알려져 있다[2,3].
위암은 Lauren’s criteria에 따라 조직학적으로 미만형(diffuse type)과 장형(intestinal type)으로 나뉜다 [4]. 미만형 위암은 명확한 종괴 형성 없이 위벽의 비후를 유발하는데, 젊은 사람에게 흔하고 전암성 병변과 관련 없이 발생하며 유전적인 소인이 크게 작용하는 것으로 알려져 있다. 반면, 장형 위암은 종양세포들이 관상 구조를 형성하는 종양으로, 흔히 궤양을 형성하고 위전정부에서 주로 발생한다. 장형 위암은 남성과 노년층에 많이 발생하며, 우리나라나 일본과 같이 위암 발생이 많은 지역의 주된 조직 형태로서 환경적인 요인이 주로 작용하는 것으로 알려져 있다. 실제로 위축성 위염 환자들을 주기적으로 위내시경 검사를 통하여 추적 관찰하면 위점막이 점차 장상피화생의 과정을 거쳐 세포 이형성을 초래하고 궁극적으로 장형 위암으로 발전하는 경우를 경험할 수 있다[5].
위축성 위염과 장상피화생은 만성 위염과 관련이 있다. 만성 위염은 초기에는 점막의 표층과 분비샘에 국한되나 염증이 진행하면서 분비샘의 구조가 더욱 파괴되어서 점막의 위축 및 화생성 변화가 생기게 된다. 국내 보고에 따르면 위에 궤양이나 암 등의 특별한 병변이 없는 대조군에서 위축성 위염의 유병률은 전정부에서 42.5%, 체부에서는 20.1%였고, 장상피화생의 유병률은 전정부에서 28.6%, 체부에서는 21.2%였다[6]. 위축성 위염과 장상피화생 모두 연령이 증가하면서 증가하는 경향은 확실하나 H. pylori 감염 여부로 구분하여 분석한 결과 H. pylori 감염자에서 비감염자보다 위축성 위염과 장상피화생의 유병률이 모두 의미 있게 높으면서 연령에 따른 증가 현상을 보인 반면, 비감염자에서는 유병률의 증가 경향이 낮았고 위축성 위염의 경우 나이에 따른 증가 소견이 관찰되지 않았다. 또한 위축성 위염과 장상피화생은 남자에서 여자보다 유병률이 더 높았다[7]. 본고에서는 위선암의 발생 과정은 위축성 위염, 장상피화생, 이형성증의 단계를 거쳐 위선암으로 진행한다는 Correa 가설을 바탕으로 위축성 위염과 장상피화생의 자연사에 대하여 정리해보고자 한다.
본 론
1. Correa 가설
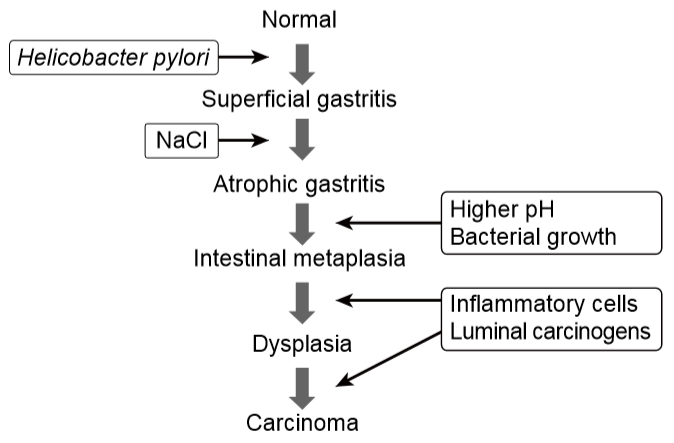
Correa 가설이란 1975년 Pelayo Correa가 발표한 가설로 사람에서의 위암 발생은 여러 단계와 여러 변수가 관여하는 과정이라고 하였다[8]. 정상 위의 변화는 표재성 위염으로 시작하여 위축성 위염, 장상피화생을 거쳐 이형성증과 장형 위암의 순서로 진행하며, 각 단계마다 영향을 주는 인자들이 존재한다는 것이다(Fig. 1).
만성 위염과 관련된 인자로는 H. pylori 감염과 과도한 염분 섭취가 있다. H. pylori 감염이 세포 복제의 증가와 다형핵 백혈구의 지속적 유입을 통하여 위암 발생에 원인이 된다는 것이 알려져 있다. 과도한 염분 섭취로 위점막의 손상을 일으키면 이를 복구하는 과정에서 염증성 변화가 일어나게 된다. 실제로 동물실험에서 과도한 염분 섭취는 위점막의 위축을 유발하였다. 이것은 과도한 염분 섭취가 표재성 위염과 위축성 위염 두 단계 모두에 영향을 준다는 것을 뜻한다.
위축성 위염에서 장상피화생으로의 진행은 조직학적으로 확인할 수 있는 형태학적 변형을 말한다. Correa는 니트로소 화합물이 이러한 변형의 매개체로서 역할을 할 것이라고 제시하였다[9]. 위축성 위염에서는 위산을 분비하는 벽세포(parietal cell)의 소실로 인하여 위 내 pH가 높아지면서 혐기성 세균의 증식이 일어난다. 혐기성 세균은 질산염을 아질산염으로 환원시키고, 환원된 아질산염은 다른 질소 함유 화합물과 반응하여 니트로소 화합물 및 다른 발암 물질을 형성한다. 이 과정은 자연에 존재하는 항산화 물질들에 의하여 억제될 수 있다. 여러 연구들에서 과일 및 채소 섭취와 위암 발생 간에 음의 상관관계가 있는 것으로 나타났는데, 이것은 과일과 채소에 함유된 아스코르브산이 항산화 물질로서 역할을 하기 때문이다[10-12]. 이밖에 이형성증과 위암의 발생에 영향을 주는 인자로 베타-카로틴이 있다. 카로티노이드는 암 발생의 후기 단계에서 활성 산소를 포획하여 안정화시키고 틈새이음(gap junction)을 통한 세포 간 커뮤니케이션을 활성화시켜 발암원들의 역할을 억제한다.
2. 위축성 위염
위축성 위염은 만성적인 염증세포 침윤의 결과로 위점막 상피의 선 구조(glandular structure)가 소실되어 섬유 조직이나 화생 조직으로 대체된 상태이다[13]. 메타분석 연구에서 위축성 위염의 연간 발생률은 0~10.9%였다[14]. 위축성 위염은 장형 위암의 발생 위험을 약 6배 증가시키며, 위축의 정도와 범위에 비례하여 위암의 위험도가 증가한다[15].
위축성 위염의 발생은 원인에 따라 A형과 B형으로 구분한다. A형 위염은 주세포(chief cell)에 대한 자가항체가 발생하여 선 구조가 파괴되는 자가면역 기전에 의한 것으로 드물게 발생하며 주로 위체부에 위축성 위염을 일으킨다. 체부 위축성 위염은 악성 빈혈과 동반되며 위암의 위험이 증가한다. B형은 주로 H. pylori 감염에 의하여 발생하고 전정부에서 시작하여 체부 쪽으로 진행하여 다발성 위축성 위염으로 불리기도 하며 점차 장상피화생으로 진행한다. H. pylori에 감염된 모든 사람에서 위축성 위염이 같은 정도로 발생하는 것이 아니며, 감염된 균주의 독성인자와 숙주인자가 영향을 미친다[6]. 대표적인 세균 관련 요인은 cagA와 vacA 유전자이고, 숙주 요인으로는 나이, cagA에 대한 숙주 반응에 관련된 유전자(PTPN11), 면역 반응(interleukin [IL]-1β/IL-1RN/IL-2/IL-3/TKR-4/CD14) 그리고 많은 유전자들의 다형성(genetic polymorphism), 위 부분 절제에 의한 가스트린 분비 감소 등이 제시되었다[16-20]. 위점막의 위축이 진행함에 따라 H. pylori 균 수가 급격히 감소하는데, 염증의 정도는 H. pylori 균 수에 비례한다. 초기 전정부에만 염증이 있는 시기에 H. pylori 균의 양이 가장 많고, 만성인 경우 점막 고유층으로의 염증세포의 심한 침윤 및 다핵구에 의한 위 상피 침윤이 관찰된다. 환경적 요인은 음식과 기호품 등이 포함되는데, 소금에 절인 음식, 과다한 탄수화물 섭취, 색소가 부족한 채소(무, 양파, 양배추 등), 비타민C 결핍 등이 위축성 위염 유발에 관여한다고 알려져 있다[15]. 염증이 점차 진행하게 되어 위 전체를 차지하는 pangastritis의 발생은 약 15~20년이 소요되는 것으로 알려져 있고, 고령으로 갈수록 흔하여 70세 이상에서는 거의 대부분에서 존재한다.
3. 장상피화생
화생이란 하나의 계열로 분화된 세포가 다른 계열의 분화 세포로 이행하는 현상이다. 장상피화생은 염증 반응이 오래 지속되어 위점막의 정상적인 구조물들이 파괴된 상태에서 위점막의 샘 상피가 소장의 상피 형태로 화생하면서 원래의 위 상피에는 존재하지 않았던 파네트세포와 술잔세포가 상피에 존재하는 상태이다.
장상피화생의 정확한 발생 기전은 완전히 밝혀져 있지 않으나 장관 특이적인 전사인자인 CDX 유전자 발현이 장상피화생과 이형성 및 위암으로의 진행에 중요한 역할을 한다고 알려져 있다[21]. 정상 위점막에서는 CDX1과 CDX2가 발현되지 않으나 위 장상피화생에서는 CDX1과 CDX2가 발현되며, Kang 등[22]의 연구에 따르면 H. pylori 감염군의 위 조직에서 비감염군에 비하여 CDX2의 발현이 유의하게 높았다. 또한 장상피화생 정도가 심해짐에 따라 CDX1과 CDX2의 발현이 증가하였고 CDX2는 불완전형 장상피화생에서 의미 있게 높았다.
장상피화생은 형태에 따라 세 가지로 구별한다. 제I형은 완전 장상피화생으로 MUC1, MUC5AC와 MUC6 등 위 상피의 mucin은 소실되고 소장과 같이 솔가장자리(brush border)를 가지는 흡수 상피, 파네트세포 그리고 sialomucin 양성 술잔세포를 포함한다. 제II형은 불완전 장상피화생으로서 대장의 상피와 유사하여 흡수세포가 거의 없고 술잔세포는 sulfomucin 양성이다. 제III형은 중간 형태로서 두 가지의 특성을 모두 가지고 있으며 위암의 위험 증가와 연관되어 있다. 장형 위암의 약 80%는 제II형과 제III형의 장생피화생과 연관되어 발생한다[23-25]. 그러나 장상피화생과 위암 발생의 관련성에 대하여 위암이 장상피화생에서 직접 발생하는 것인지 혹은 장상피화생이 위암 발생을 예측하는 단순 표지자인지는 불분명하다. 화생이 완료된 상피는 비증식성이며 체세포 분열이 끝난 상태이기 때문에 완전 장상피화생은 선암이나 이형성과는 다르다. 실제로 완전 장상피화생의 위암 발생 위험도는 매우 낮으며, 완전 장생피화생의 표지자인 CDX2 발현이 증가하는 위암의 예후는 양호한 편이다[26]. 반면 불완전 장상피화생은 위암 발생의 위험 요인으로 장상피화생의 전체 범위가 넓어질수록 위암 발생이 증가한다[15].
위체부의 주세포가 소실되고 발생하는 화생으로서 장상피화생 외에 spasmolytic polypeptide-expressing metaplasia (SPEM)도 알려져 있다. SPEM은 위점막을 보호하고 치료하는 역할을 하는 trefoil family of peptide (TFF) 중 위 상피세포에서 분비되는 trefoil factor 2 (TFF2, spasmolytic polypeptide)를 발현하는 화생으로써 TFF2가 증가할수록 위선암의 발병률이 높아지는 것으로 알려져 있다[27]. 따라서, SPEM은 종양의 전구 단계로 생각되며 장형 위선암의 발생 위험과 관련이 있다[28].
국내에서 시행된 9.4년 동안 추적한 코호트 연구에서 장상피화생이 있을 경우 위선암 발생률은 장상피화생이 없었던 경우보다 10.9배 증가하였다는 보고가 있다[29]. 국내에서 시행된 설문조사 연구 결과 위축성 위염과 장상피화생이 있는 경우 대다수 내시경 의사들이 매년 내시경으로 추적검사를 하는 것으로 나타났다[30]. 지금까지의 임상 연구들은 주로 위점막의 위축이나 장상피화생의 변화에 초점을 맞추어 위암 발생의 위험성을 평가해왔다. 최근에는 보다 덜 침습적인 방법으로 위암 발생의 위험성을 예측하려는 연구들이 시도되고 있다. 위액 내 마이크로비옴을 분석하여 위암 발생과의 관련이 있는 위 내 미생물 세균총을 분석하려는 연구들이 있었지만 아직까지 제한적이다[31,32]. 혈청 pepsinogen (PG)은 H. pylori 양성인 환자에서 위점막의 위축 정도와 유의한 상관관계가 있고, PG I 수치와 PG I/II 비는 위암 발생을 예측하는 데 좋은 지표가 될 수 있다[33,34]. 그러나 제균 치료를 시행한 경우 유용하지 않은 것으로 알려져 있다[35]. 혈장 ghrelin은 H. pylori 유무와 관련 없이 위점막의 위축 정도를 잘 반영하는 것으로 알려져 있지만 아직 연구가 부족한 실정이다[36,37]. 최근 혈액 기반의 새로운 바이오마커를 이용한 연구들이 진행되고 있다. 혈액 내 다양한 종양세포에서 유래되는 cell-free DNA나 microRNA 등이 종양표지자로서 암의 조기 발견에 활용될 수 있지만 분석 기술 개발이 필요한 실정이다[38-40]. 그러나 이러한 방법이 비용-효과 측면에서 얼마나 유용한지에 관한 연구는 부족한 실정이다[41]. 그러므로 장상피화생이 있는 환자 중에서 위선암으로의 진행을 예측할 수 있는 인자들을 찾는다면 위선암을 예방하고 치료하는 데 도움이 될 것이다.
위암 발생률이 낮은 네덜란드에서 시행된 연구 결과에 따르면 위축성 위염, 장상피화생, 저도 이형성증, 고도 이형성증일 경우 연간 위암 발생률은 각각 0.1%, 0.25%, 0.6%, 6%였다[42]. 스웨덴에서 진행된 대규모 코호트 연구에서는 암이 발병하지 않은 상태에서 위 조직검사를 시행한 405,172명을 대상으로 위암 발병률을 조사한 결과 위축성 위염, 장상피화생, 이형성증일 경우 위암 발생 위험도(hazard ratio)는 각각 4.5배, 6.2배, 10.9배였다[43]. 장상피화생이 있는 환자들을 대상으로 진행한 연구에서는 불완전 장상피화생이 위선암의 발생 위험을 높인다는 결과를 보였다. 2016년 스페인에서 시행된 연구에서 내시경 검사 시 전암성 병변을 가지고 있는 것으로 진단된 649명을 대상으로 위암 발생률을 관찰한 결과, 연간 인구 1,000명당 위암 발생률이 완전 장상피화생은 2.76명, 불완전 장상피화생은 5.76명이었으며, 위험도 또한 불완전 장상피화생이 2.75배 높았다[44]. 그러므로, 장상피화생은 위암의 전암성 병변으로 적절한 추적과 치료가 필요하다고 하겠다.
장상피화생의 발생은 H. pylori 감염과 그로 인한 만성 염증에 의하여 일어나는 것으로 알려져 있다. 2,455명의 환자들을 조사한 한 역학조사에서 H. pylori에 감염된 환자들의 43.1%에서 장상피화생이 있었으나 H. pylori 감염이 되지 않은 환자에서는 6.2%에서만 장상피화생이 있는 것으로 나타났다[45]. 또 다른 연구에서 H. pylori에 감염된 환자들을 10년 동안 추적 조사하였을 때 49%에서 장상피화생이 발생하였으나 H. pylori 감염이 없는 환자에서는 장상피화생이 발생하지 않았다[46]. 그러나 다른 연구에서 H. pylori에 감염된 환자들 중 30%에서만 장상피화생이 발생하였고, 이 중 7%에서만 위선암이 발생하였다[11]. 따라서, H. pylori 감염 환자들이 모두 장상피화생으로 진행하는 것은 아니며 균 감염 이외에도 다른 인자들이 장상피화생의 발생에 작용할 것으로 생각된다. cagA, vacA s1, vacA m1, babA2와 같은 H. pylori 독성인자가 장상피화생으로의 진행에 영향을 미치는 것으로 알려져 있으며, 개개인의 유전적 감수성도 장상피화생으로의 진행에 영향을 미칠 것으로 생각된다[47,48]. 또한 위선암 환자의 가족에서 장상피화생의 발병률이 더 높다는 연구가 있는데[49] H. pylori에 감염된 환자들에서 IL-1β와 IL-1RN의 polymorphism이 있는 경우 장상피화생으로 진행하는 비율이 높은 것으로 알려졌다[50]. 이러한 인자들 이외에도 과도한 염분 섭취, 흡연과 같은 환경적 인자들도 장상피화생의 발생과 밀접한 관련이 있는 것으로 알려져 있다[51,52].
결 론
위염에서 위암으로 진행되는 과정은 오랜 기간에 걸쳐 단계적으로 진행되며, 만성 위축성 위염, 장상피화생, 위선종의 단계를 거쳐 일부에서 마침내 위선암으로 진행된다. 위축성 위염과 장상피화생은 위암 발생의 위험을 높이는 독립 요인으로서 정확한 진단과 위험 평가를 통하여 적절한 관리가 필요하다. 따라서, 위축성 위염과 장상피화생의 범위와 정도, 위암 가족력 여부, H. pylori 감염이 있는 경우, 남성, 음주 등의 위험 요인이 있는 경우 지속적인 감시의 고려 대상이 된다. 과거 장상피화생으로 진행하면 제균 치료로 호전될 수 없다는 "point of no return"의 개념이 등장한 후 지금까지 제균 치료가 위축성 위염과 특히 장상피화생을 개선시키는지에 대해서는 많은 논란이 있어 왔다[53-56]. 최근 연구에서는 H. pylori 제균 후 위축성 위염이나 장상피화생이 일부 호전된다는 것을 확인하였다[57]. 또한 조기 위암으로 내시경 절제술을 시행한 후에 제균 치료를 한 경우 위축성 위염뿐만 아니라 장상피화생도 호전이 있다는 보고도 있다[58]. 현재 많은 가이드라인에서 위축성 위염과 장상피화생 환자에 대한 H. pylori 제균 치료를 권고하고 있다[59-61]. 그러므로 이미 위축성 위염과 장상피화생으로 진행한 경우라도 H. pylori 감염이 있다면 제균 치료를 하는 것이 바람직할 것이다. 또한 위암 예방을 위하여 위점막의 위축과 장상피화생의 범위에 따라 적절한 수준의 감시 프로그램을 적용하여 관리하는 것이 중요하다.
Notes
No potential conflict of interest relevant to this article was reported.