조기 위암의 내시경 절제 후 발생하는 이시성 위암
Metachronous Gastric Cancer Occurring after Endoscopic Resection of Early Gastric Cancer
Article information
Trans Abstract
Endoscopic resection (ER) has been widely used as a curative treatment for early gastric cancers (EGCs). Especially endoscopic submucosal dissection has several merits such as high en bloc and curative resection rates for EGCs and preservation of the entire stomach. However, ER has the inevitable limitation that the possibility of newly developing gastric cancers in the preserved stomach is still present. Metachronous gastric cancer (MGC) is defined as a newly developed gastric cancer occurring at a previously uninvolved site ≥1 year after the index ER of EGCs. The incidence of MGC is 3.3~15.6% and increases over time after ER. Old age, male sex, current smoking, severe atrophy and intestinal metaplasia, persistent Helicobacter pylori (H. pylori) infection, differentiated-type histology, and multiple initial gastric cancers are risk factors of MGC. As H. pylori eradication could reduce the risk of MGC after ER of EGCs, H. pylori eradication is strongly recommended for the prevention of MGC after ER of EGCs. Most MGCs are found at an early stage on regular surveillance endoscopy after ER and successfully treated with ER, with excellent long-term outcomes.
서 론
최근 조기 위암의 치료법으로 내시경 점막하 박리술(endoscopic submucosal dissection, ESD)과 같은 내시경 절제술(endoscopic resection, ER)이 널리 사용되고 있다. ESD는 병변의 위치와 크기에 상관없이 높은 일괄 절제율(en bloc resection rate) 및 근치 절제율(curative resection rate)을 가능하게 하며, 조기 위암의 ESD의 장기 치료 성적, 즉 5년, 10년 생존율(overall survival rate)은 수술적 절제와 거의 대등한 것으로 보고되고 있다[1,2]. 그리고 외과적 위 절제술과 비교하여 ESD는 최소 침습적인 치료법으로, 위 자체를 보존한다는 장점을 가지고 있다. 하지만 이러한 장점에도 불구하고 ER 후 보존된 위에서 시간이 지날수록 새로운 위암이 생기는 경우가 적지 않다는 문제점이 있다. 특히, 조기 위암에 대한 ER 시행 후 1년이 지난 이후에 원발 위암 부위와 관련성이 없는 부위에 새롭게 발생하는 위암을 이시성(metachronous) 위암이라고 정의한다. 본고에서는 이러한 이시성 위암의 발생 빈도, 위험인자, 병변의 특징 및 치료 방법에 대하여 기술하고자 한다.
본 론
1. 이시성 위암의 발생 빈도
통상적으로 위암에 대하여 외과적 위 절제술을 시행한 경우 이시성 위암의 빈도는 0.9~3.0%로 알려져 있다[3-5]. 이에 반하여 조기 위암에 대한 ER 시행 후에는 암의 발생 모지인 위축성 위염이나 장상피화생이 잔존 위에 지속적으로 존재하기 때문에, 이론상으로도 이시성 위암의 빈도는 위 절제술의 경우보다 높을 것을 예측할 수 있다. 실제로 조기 위암에 대한 ER 시행 후 발생하는 이시성 위암의 빈도는 추적 기간에 따라 다르지만 종합해보면 3.3~15.6%로 위 절제술의 경우보다는 높다(Table 1) [6-19]. 이러한 자료를 토대로 조기 위암에 대한 ER 시행 후 발생하는 이시성 위암의 연간 평균 발생률을 계산해보면 약 2.5~3.5%이며, ER 시술 후 10년까지 선형으로 증가하는 경향을 보인다[5]. 실제로 1,527명 환자를 대상으로 평균 82개월간 이시성 위암의 빈도를 조사한 연구에 의하면, 5년, 7년, 10년 동안 이시성 위암의 누적 발생률은 각각 9.5%, 13.1%, 22.7%였다[8]. 10년 이상의 장기간 추적 관찰 연구에서는 이시성 위암의 빈도는 10년이 지나면 증가 경향이 둔화된다고 보고하였다[20]. 따라서 조기 위암에 대한 ER 후 최소 10년 동안은 매년 감시(surveillance) 내시경 검사가 필요할 것이다.
2. 이시성 위암의 위험인자
이시성 위암의 발생과 관련된 위험인자로 남성, 고령, 흡연, 심한 위축성 변화, 장상피화생, 지속적인 Helicobacter pylori (H. pylori) 감염, 혈청 pepsinogen I/II ≤3, 장형(intestinal type) 위암 및 처음 발견 시 다수의 위암이 존재한 경우가 보고되고 있다(Table 2) [8,9,11-16,19]. 이 중 고령, 남성 및 흡연은 일반인에서도 위암의 위험인자이다. 또한 Correa와 Piazuelo [21]의 가설에 따르면 만성적인 H. pylori 감염이 있는 경우 시간이 지남에 따라 만성 위염, 위축성 위염, 장상피화생, 이형성 과정을 거쳐 장형 위암이 발생할 수 있다. 상기에서도 기술한 바와 같이 ER은 위 자체를 보존하는 치료법이기 때문에 조기 위암에 대한 ER 후에도 장형 위암의 위험인자가 되는 조직학적 변화가 남아 있을 수밖에 없다. 그러므로 이시성 위암의 위험인자는 장형 위암의 위험인자와 비슷할 수 밖에 없을 것이다. 마찬가지로 위의 광범위한 위축성 변화의 진단에 유용하다고 알려진 혈청 pepsinogen I/II 비도 이시성 위암의 위험인자로 보고되고 있다[15].
3. 이시성 위암의 내시경 소견
위의 위축성 변화는 전정부에서 체부의 소만 측으로 진행하기 때문에 이시성 위암은 위의 하부 1/3 부위에 주로 호발한다(Fig. 1) [13]. 이시성 위암을 가진 대부분의 환자들은 배경 위점막 상태로 심한 위축성 위염과 장상피화생을 가지고 있는 경우가 많다(field cancerization). 따라서 이시성 위암은 처음 발견된 조기 위암의 조직형이 장형 즉, 분화형(differentiated type)일 때 많이 발생하며, 또한 이시성 위암의 조직형도 대부분 분화형이다[22]. 이러한 심한 위축성 위염과 장상피화생의 배경 점막 외에도, 위암의 빈도를 줄이기 위한 H. pylori 제균 치료는 H. pylori 감염으로 인한 위점막 내의 염증을 감소시키기 때문에 이시성 위암의 조기 발견과 경계 평가를 어렵게 한다(Fig. 2). 특히, H. pylori 제균 후에는 위축 영역의 장상피화생을 가진 점막이 발적으로, 반대로 비위축 영역의 위저선 점막은 미만성 발적의 소실로 백색으로 보이게 된다. 이러한 색조역전현상으로 인하여 장상피화생 부위가 지도상 발적(map-like redness)으로 관찰되는 경우가 많으므로[23] 이러한 부위에서 이시성 위암을 찾으려는 노력이 필요하다. 또한 제균 치료 후 발견되는 이시성 위암의 일부는 비종양성 상피로 덮여 있어 더욱 더 진단이 어렵다[24]. 실제로 이시성 위암은 대개 조기 위암에 대하여 ER 시행 후 추적 내시경 검사 시 발견되는 경우가 대부분이므로, 크기가 2 cm 이하의 작은 점막암으로 나타난다[5]. 그러므로 ER 후 추적 내시경 검사 시 이시성 위암을 발견하기 위해서는 좀 더 많은 시간을 투자해야 하며, 의심스러운 경우는 적극적인 조직검사가 필요하다.
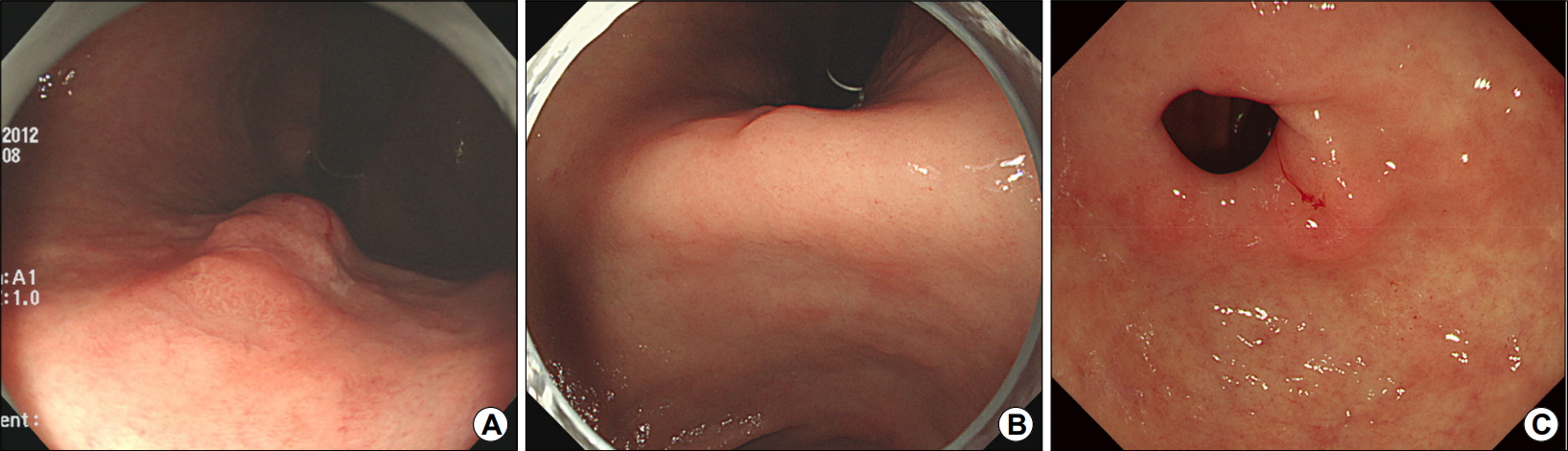
An example of a metachronous gastric cancer occurring after endoscopic submucosal dissection of an early gastric cancer. (A) An 81-year-old man underwent endoscopic submucosal dissection of an early gastric cancer (first cancer) of the upper body. (B) The metachronous gastric cancer (second cancer) is found at the gastric angle on the follow-up endoscopy 18 months later. (C) The metachronous gastric cancer (third cancer) is found at the prepylorus on the follow-up endoscopy 7 years later.
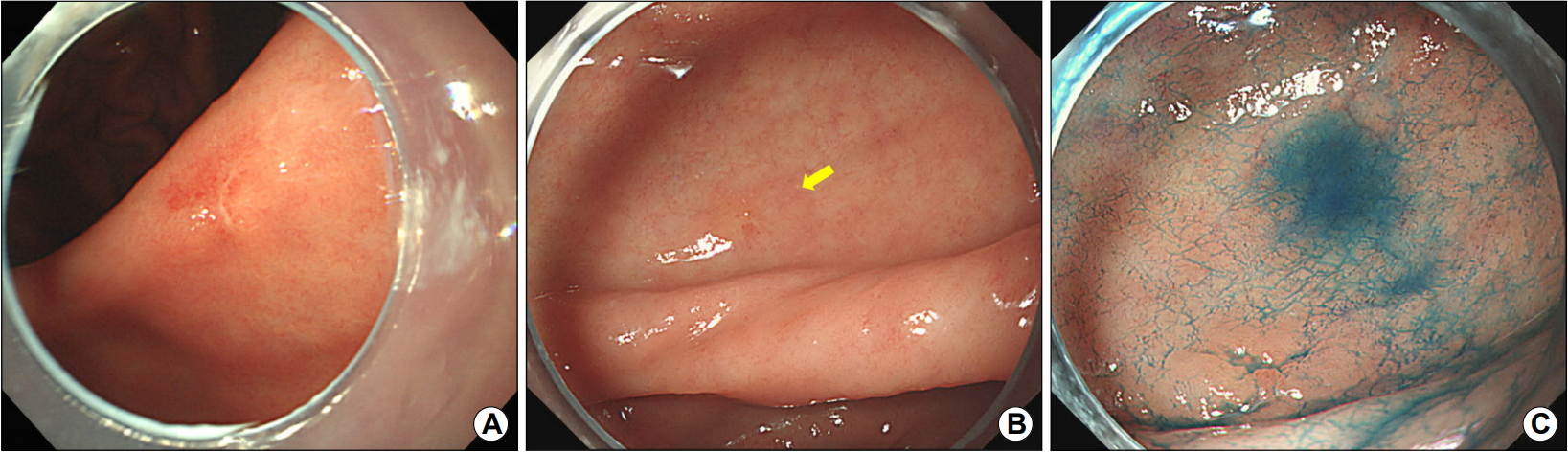
An example of a metachronous gastric cancer occurring after Helicobacter pylori (H. pylori) eradication. (A) A 48-year-old woman underwent endoscopic submucosal dissection of an early gastric cancer at the gastric angle and then achieved successful H. pylori eradication. (B) The metachronous gastric cancer is found at the gastric antrum (arrow) on the follow-up endoscopy 12 years later. The cancer and its margin are difficult to recognize. (C) Indigo carmine chromoendoscopy image clearly depicts the cancer.
4. 이시성 위암의 치료
이시성 위암은 처음 발견되는 조기 위암과 동일한 치료 방침을 적용할 수 있다. 전술한 바와 같이 이시성 위암은 대부분 크기가 작은, 분화형 조직형의 점막암이므로 ER로 치료할 수 있다. 일반적인 조기 위암의 경우처럼 근치적 절제가 이루어진 경우 이시성 위암에 대한 ER의 장기 치료 성적은 우수하다. 여러 연구를 종합해보면 이시성 위암의 근치적 절제율은 89~99%이며, 5년 및 10년 질병 특이 생존율(disease-specific survival rate)은 각각 99%와 93%로 보고하고 있다[8,11,13]. 당연히 조기 위암에 대한 ESD의 확대 적응증을 벗어난 경우는 외과적 위 절제술이 필요하다. 최근 발표된 국내 연구에 의하면 다변량 분석 결과 낮은 체질량지수와 처음 발견 시 다수의 위암이 존재한 경우 이시성 위암 발생 시 수술이 필요한 경우가 많았다[17].
전통적으로 위암으로 인한 위 절제술을 시행한 경우는 술 후 대부분의 림프절 및 원격 전이가 5년 이내에 발생하고, 잔존 위의 감소로 인하여 이시성 위암의 발생률이 낮기 때문에 위암의 치료 성적은 흔히 5년 생존율과 질병 특이 생존율로 평가를 하고 있다. 하지만 이시성 위암을 ER로 치료한 경우는 또 다른 이시성 위암의 위험 요소가 여전히 남아 있으므로, 정기적인(적어도 1년 간격의) 감시 내시경 검사가 평생 필요할 것이다.
5. H. pylori 제균 치료와 이시성 위암
H. pylori 제균 치료가 이시성 위암의 발생 감소에 도움이 되는가에 대해서는 의견이 분분하다. 여러 연구에서 H. pylori 제균 치료가 조기 위암의 ER 후 이시성 위암의 발생을 항상 감소시키지 않는다고 제시하고 있다[16]. 이는 장상피화생을 동반한 심한 위축성 변화가 있는 위점막의 변화는 흔히 말하는 ”point of no return”이므로, 이러한 경우는 H. pylori 제균 치료만으로는 위암의 발생을 예방할 수 없다는 사실에 기인하고 있다. 이와는 반대로 많은 연구에서 지속적인 H. pylori 감염이 이시성 위암의 위험인자이며, 13개의 연구를 포함한 메타분석(3,863명)에 의하면 H. pylori 제균 치료가 이시성 위암의 발생률을 효과적으로 줄일 수 있음이 밝혀졌다(pooled risk ratio 0.46, 95% CI 0.37~0.57, P<0.001) [25]. 11개의 후향적 코호트 연구와 3개의 무작위 대조군 연구를 포함하는 최근의 메타분석(7,273명)에서도 H. pylori 제균 치료가 이시성 위암의 발생 예방에 효과적임을 보고하였다(hazard ratio 0.65, 95% CI 0.50~0.86, P=0.002) [26]. 따라서 조기 위암의 ER 후 이시성 위암을 예방하기 위한 목적으로 H. pylori 제균 치료가 강력하게 추천되고 있다.
결 론
조기 위암에 대한 ER을 시행받은 환자들에서 이시성 위암의 발생 빈도는 높으며, 적어도 10년간은 선형으로 증가하는 경향이 있다. 물론 일반적인 경우와 동일하게 H. pylori 제균 치료가 이시성 위암의 발생 빈도를 감소시킬 수는 있지만 배경 위 점막에 위축성 변화와 장상피화생이 남아 있기 때문에 여전이 이시성 위암의 위험도는 존재한다. 그러므로 이시성 위암을 조기에 발견하기 위해서는 정기적인 감시 내시경 검사가 필수적이며, 이를 위해서는 이시성 위암에 대한 환자 개개인의 위험 요인에 따라 계층화 및 추적 기간의 조절이 필요하다. 하지만 아직 이에 대해서는 체계화된 가이드라인 없는 실정으로, 현 시점에서는 적어도 1년 1회 정도의 감시 내시경 검사가 권장된다.
Notes
No potential conflict of interest relevant to this article was reported.