부식성 식도염 과거력이 있는 환자에서 진단된 식도 암육종 1예
Esophageal Carcinosarcoma in a Patient with Corrosive Esophagitis
Article information
Trans Abstract
Esophageal carcinosarcoma is a rare type of esophageal cancer characterized by both carcinomatous and sarcomatous components. Its endophytic growth tendency into the esophageal lumen leads to a higher curative resection rate. However, lymph node metastases in esophageal carcinosarcoma occur at a relatively early stage. We report a case of esophageal carcinosarcoma in a 52-year-old man who had dysphagia for 2 months and a history of ingestion of glacial acetic acid in adolescence. His endoscopy and chest CT results showed an 8.5-cm-sized ulcerative polypoid mass with multiple lymph node metastases in the mid-esophagus. Biopsy revealed an interweaving spindle cell proliferation with squamous dysplasia. Immunohistochemical staining showed positive expressions of vimentin and cytokeratin. Even though the patient received concomitant chemoradiotherapy with a stent insertion, he died 7 months after diagnosis. We herein present a case of corrosive esophagitis followed by esophageal carcinosarcoma that suggested the possibility of an association between the two diseases.
서 론
식도 암육종(carcinosarcoma)은 매우 드문 종류의 악성 종양으로 모든 식도 종양의 약 1~2%를 차지한다[1]. 조직학적으로 암종 요소와 육종 요소가 동시에 발견되어 암육종, 방추세포암종(spindle cell carcinoma), 가성육종(pseudosarcoma), 가성육종성암종(pseudosarcomatous carcinoma) 등 여러 가지 용어가 사용되어 왔으나 최근 면역조직학적 연구 등에서 육종 요소가 암종 기원임을 시사하는 증거들이 제시되어 암육종은 편평세포암종(squamous cell carcinoma)의 특별한 형태로 생각되고 있다[2,3]. 주로 식도 내강으로 성장(exophytic growth)을 하며, 비교적 일찍 증상이 발생되고 이에 따라 근치적 절제율이 높다고 알려져 있으나[4,5], 조기에 림프절 및 원격 전이가 일어나 장기적인 예후는 편평세포암종과 비교하여 좋지 않다[1,6,7]. 저자들은 청소년기 빙초산에 의한 식도 손상 과거력이 있는 52세 남자가 삼킴곤란으로 내원하여 식도 암육종으로 진단된 증례를 경험하였기에 문헌 고찰과 함께 보고하는 바이다.
증 례
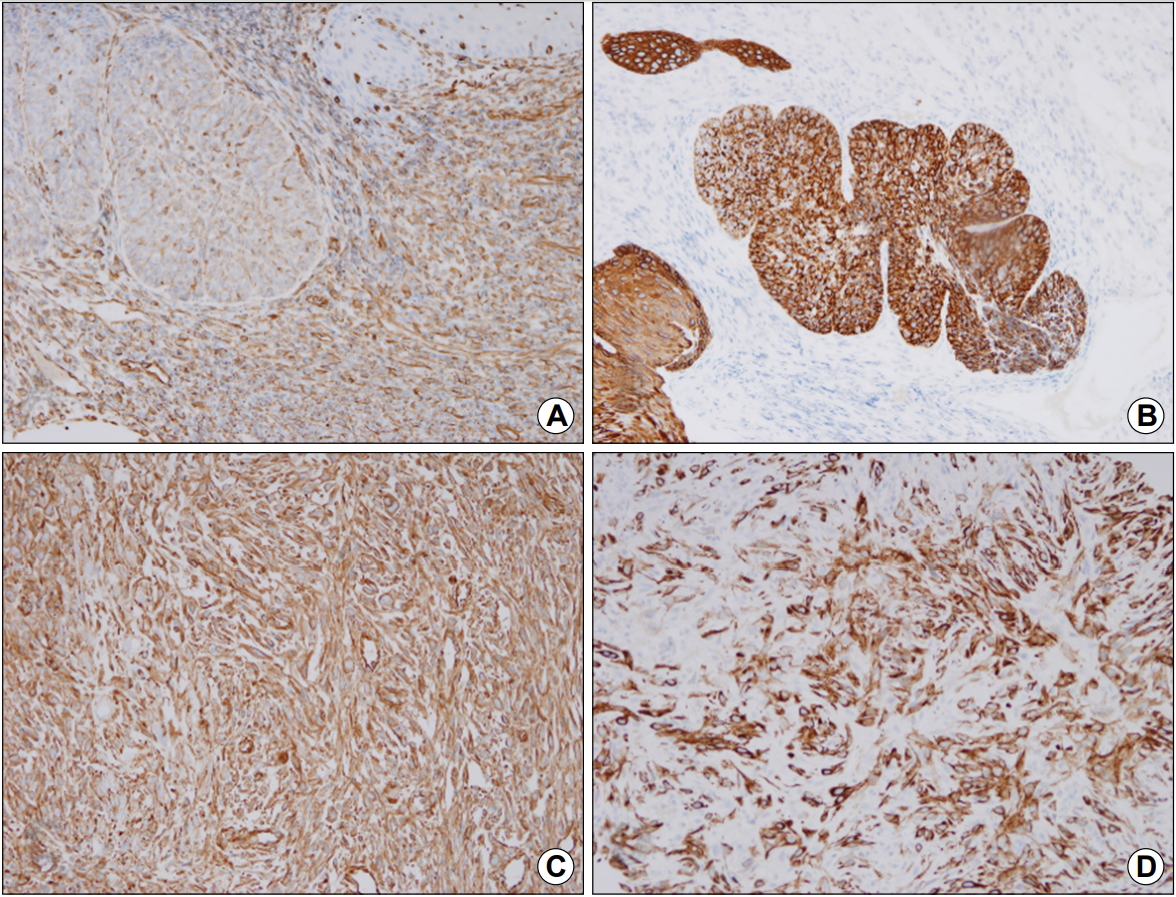
52세 남자가 두 달 전부터 악화되는 삼킴곤란으로 내원하였다. 증상 초기에는 고형식을 삼키기 어려웠으나 2주 전부터는 유동식도 삼키기 어려워졌다. 과거력에서 청소년기에 빙초산을 음독하여 부식성 상부위장관 점막 손상으로 치료받았으며, 하루 1갑씩 30년의 흡연력 및 일주일에 3번 이상 소주 1병의 음주력이 있었다. 내원 당시 혈압은 120/90 mmHg, 맥박수 80회/분, 호흡수 18회/분, 체온은 36.8℃였다. 신체 진찰에서 촉진되는 림프절 비대는 없었으며, 흉부와 복부 검사에서 특이 이상 소견은 없었다. 말초혈액검사 소견은 백혈구 15,780/mm3, 혈색소 15.4 g/dL, 혈소판 459,000/mm3였고, 혈청 생화학검사는 공복 혈당 93 mg/dL, BUN 31.9 mg/dL, creatinine 1.35 mg/dL, AST 17 IU/L, ALT 6 IU/L, 총 빌리루빈 0.71 mg/dL, 총 단백 7.5 g/dL, 알부민 3.7 g/dL였다. 단순 흉부 및 복부 X-선 검사에서 특이 이상 소견은 없었다. 내시경 검사 시 상절치로부터 25 cm 부위 중부식도에 약 3 cm 크기의 표면에 궤양을 동반한 용종형 종괴가 관찰되었으며, 이 종괴로 인하여 식도 내강은 좁아져 있었다(Fig. 1). 흉부 CT에서는 중부식도에 8.5 cm 크기의 종괴가 관찰되었고, 우측 식도 옆 림프절, 우측 기관 옆 림프절, 기관분기부하 림프절이 커져 있었다(Fig. 2). PET에서는 CT에서의 병변 및 림프절 비대가 모두 열소(maximal standardized uptake value 14.2)로 관찰되었다. 조직검사에서 육종과 편평상피암종이 혼재되어 있었으며(Fig. 3), 면역화학조직염색에서 육종 부분은 간질세포 표지자인 vimentin과 상피세포 표지자인 cytokeratin 양측에서 양성을 보였고, 편평상피암종 부분은 cytokeratin에 양성이었다(Fig. 4). 최종 TNM 병기는 T4N3M0였다. 증상 완화를 위하여 식도 스텐트를 삽입하였고, 이후 동시화학방사선요법(55 Gy, 5-fluorouracil+cisplatin)을 시행하였으나 3개월 후 기관식도 누공이 발생하고 전신 상태가 좋지 않아 중단하였고, 진단 7개월 후 발생한 흡인성 폐렴 및 패혈증으로 사망하였다.
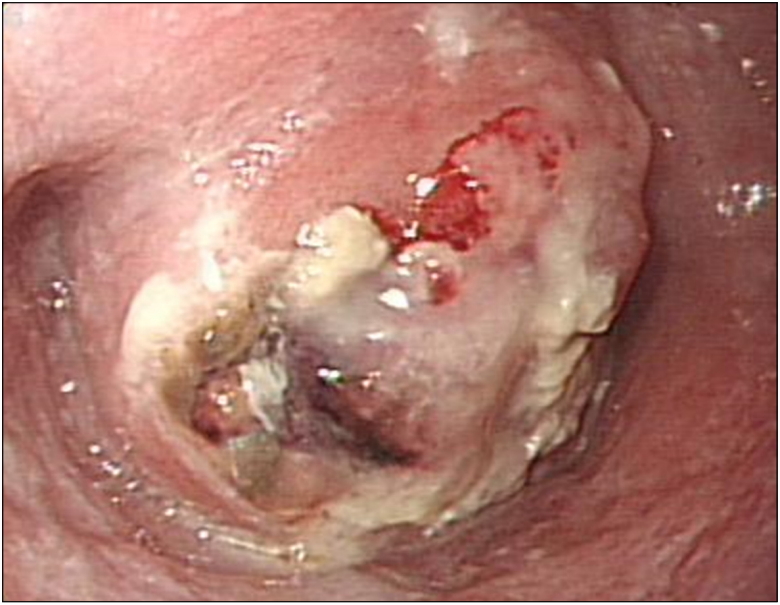
Upper endoscopy findings showing a 3-cm-sized polypoid mass with an ulceration, obstructing the esophageal lumen at the mid-esophagus.
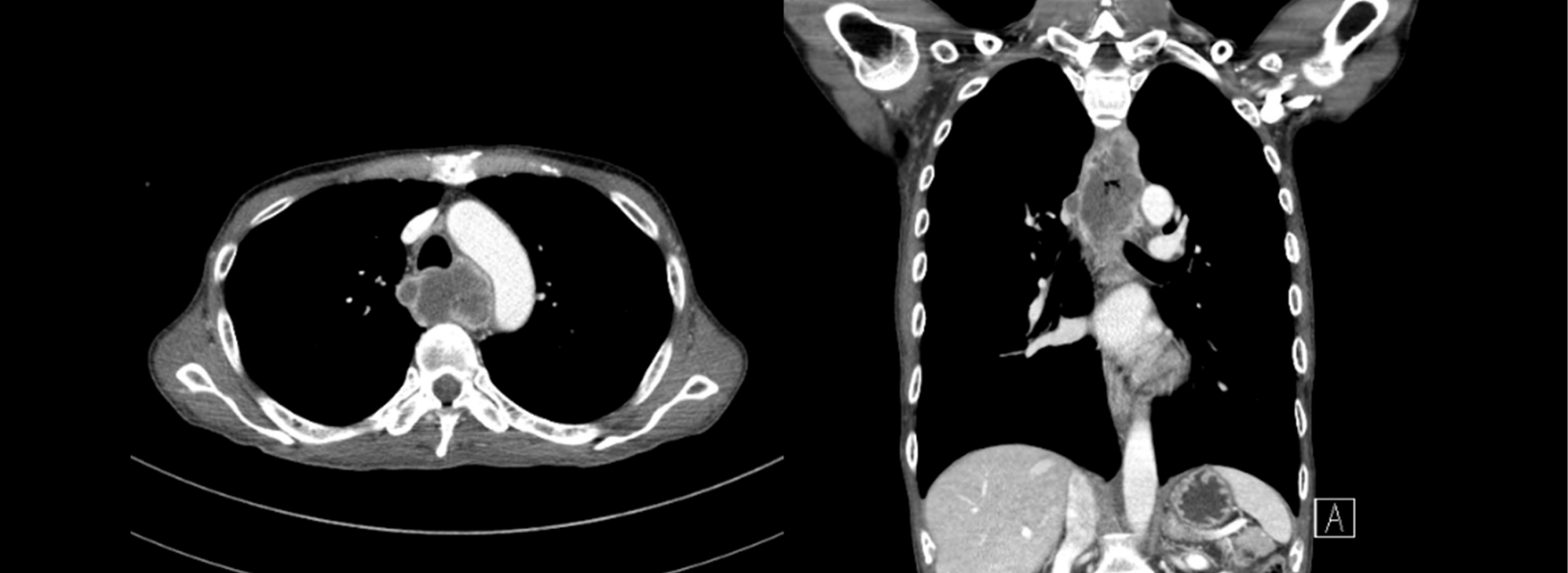
Chest CT findings showing a fungating mass (approximately 8.5 cm in length) with multiple lymph node metastases at the mid-esophagus.
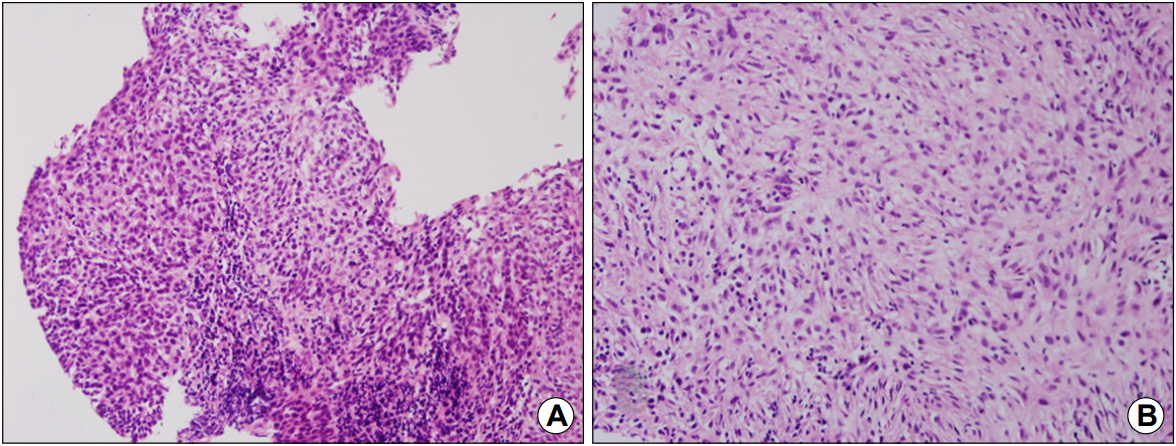
Microscopic findings showing (A) a differentiated squamous cell carcinoma component (H&E, ×200) and (B) an interweaving cell proliferation with pleomorphism and hyperchromatism in the spindle cell component, consistent with sarcoma (H&E, ×200).
고 찰
암육종은 암종 요소와 육종 요소가 동시에 발견되는 매우 드문 악성 종양으로, 자궁, 유방, 갑상선, 식도, 위, 폐, 후두 등 여러 장기에서 보고되고 있다. 1865년 Virchow [8]가 암종 요소와 육종 요소가 동시에 발견되는 종양에 대하여 기술하였으며, 식도에 발생한 암육종은 1904년 Hansemann [9]에 의하여 처음 보고되었다. 국내에서는 1984년 Yang 등[10]에 의하여 보고된 이후 총 17건의 증례 보고가 있었다. 육종 요소의 조직 기원에 대해서는 방추성 세포 요소는 악성 종양에 대한 반응이라는 가설(pseudosarcoma), 육종 요소와 암종 요소가 독립적으로 암성 변화를 일으켰다는 충돌 가설(collision concept) 그리고 육종 요소가 암종 요소로부터 화생되었다는 이형성 가설(metaplastic concept)이 있어 왔으며, 이로 인하여 가성육종, 암육종, 방추세포암종, 가성육종성암종 등 여러 가지 용어가 사용되어 왔다. 최근 면역조직화학적 연구에서 상피세포 표지자인 cytokeratin과 간질세포 표지자인 vimentin 양측 모두 양성 소견을 보여, 육종 요소와 암종 요소가 동일세포에서 기원하였다는 증거를 제시하였고, 이후 전자현미경적, 분자유전학적 연구들에서 육종 요소가 암종 요소에서 기원하였다는 증거들이 화생성 가설을 뒷받침하고 있다[2,3,11]. 본 증례는 병리조직 소견에서 암종 부분과 육종 부분의 직접적인 이행 부위는 확인되지 않으면서 암종 부분에서 cytokeratin만 양성 소견을 보여 일부 충돌 가설을 지지하지만, 육종 부분에서 cytokeratin과 vimentin 양측에 양성 소견으로 화생성 가설 또한 지지하고 있어 조직 기원에 대한 결론을 내리기는 어려울 것으로 생각된다.
암육종은 50대 이상의 흡연 및 음주력이 있는 남성에서 호발한다. 식도에 발생하는 암육종의 경우 주로 용종양 종괴를 형성하여 진행하는 양상의 삼킴곤란을 유발하며, 이를 주 증상으로 병원에 내원하는 경우가 흔하다. 이외 흉통, 위장관 출혈, 체중 감소 등을 동반할 수 있다. 식도 암육종의 약 60%는 중부식도에서, 30% 가량은 하부식도에서, 10% 가량만이 상부식도에서 발생한다[12]. 본 증례에서는 약 40년 전 빙초산에 의한 부식성 상부위장관 점막 손상 과거력이 확인되었다. 일반적으로 부식성 식도 손상은 편평세포암종의 발병률을 1,000~3,000배 높인다고 알려져 있으나[13] 암육종 발생에 영향을 미치는지에 대하여는 알려진 바 없다. 다만, 국내에서도 Oak 등[14]에 의하여 유사한 증례가 보고된 바 있어 두 질환 사이에 연관성이 있을 가능성이 있다. 이에 대하여는 더 많은 연구가 필요할 것으로 생각된다.
종양의 위치, 형태, 병기에 따라 치료 방법을 결정하는데, 근치적 절제가 가능한 경우 종양의 광범위 절제술 및 림프절 박리가 최선의 치료이다. 10~20 mm 이내의 점막 또는 점막하층에 국한된 병기에서는 림프절 전이 혹은 원격 전이 가능성이 낮아 내시경 점막하 박리술과 같은 국소 절제술을 고려할 수 있다[15,16]. 진행된 병기이거나 수술적 치료가 어려운 상황에서는 항암 치료 또는 동시화학방사선요법을 시행할 수 있다[17]. 본 증례에서는 광범위한 림프절 전이가 동반되어 근치적 절제가 어려워 동시화학방사선요법을 시행하였다.
식도 암육종은 주로 식도 내강으로 성장을 하여 편평세포암종에 비하여 증상이 일찍 발생하는 경향이 있어 조기에 진단되며, 근치적 절제 가능성이 높아 예후가 좋다는 보고가 있다[4,5]. 하지만 Sano 등[6]은 T1 병기의 편평세포암종 환자보다 T1 병기의 암육종 환자에서의 생존율이 낮다고 보고하였으며, Kuo 등[7]에 따르면 암육종은 조기에 림프 침윤과 원격 전이가 발생하여 예후가 불량하다고 하였다. 또한, 5년 생존율에 있어서 편평세포암종과 차이가 없다는 보고도 있다[1]. 저자들은 빙초산에 의한 식도 손상 과거력이 있는 환자에서 식도 암육종을 진단하였기에 문헌 고찰과 함께 보고하는 바이다.
Notes
No potential conflict of interest relevant to this article was reported.