십이지장에 발생한 사구종양 1예
Glomus Tumor of the Duodenum
Article information
Trans Abstract
Glomus tumor is a benign tumor derived from the vascular wall of the arteriovenous anastomosis complex. Glomus tumors in the gastrointestinal tract are rare, especially those in the duodenum. Most gastrointestinal glomus tumors are found incidentally on endoscopy during routine health checkup and sometimes because of bleeding. We experienced a case of duodenal glomus tumor diagnosed after surgical resection of an incidental subepithelial tumor in the duodenum. Herein, we report the characteristic endoscopic ultrasonography, contrast-enhanced CT, and histopathological findings of duodenal glomus tumor.
서 론
사구종양(glomus tumor)은 온도의 변화에 따라 혈류를 조절하는 신경근동맥 수용체인 사구(glomus body)의 변형된 평활근 세포인 사구세포(glomus cell)에서 발생하는 종양으로, 모든 연부 조직 종양의 2% 미만을 차지하며 흔히 30세 미만의 환자에서 단일 병변으로 나타난다[1]. 위장관의 사구종양은 위, 식도, Vater 팽대부, 대장 등 다양한 위치에서 발생할 수 있으며, 이 중 위에서 가장 흔하게 발생하나 십이지장에서의 발생은 매우 드물다[2]. 32명의 환자를 대상으로 한 증례 연구에 따르면, 대부분의 위장관 사구종양은 상부위장관의 출혈로 발견되거나 상부위장관 내시경 검사 시 우연히 발견된다[3]. 저자들은 검진에서 우연히 발견된 십이지장 상피하 종양으로 내원한 43세 여자에서 수술 후 십이지장 사구종양으로 진단된 1예를 경험하였기에 내시경 초음파 검사(EUS), CT 및 조직 소견의 특징을 문헌 고찰과 함께 보고하는 바이다.
증 례
평소 특이 병력이 없던 43세 여자가 타 의료기관에서 건강검진 목적으로 시행한 상부위장관 내시경 검사에서 십이지장 상피하 종양이 발견되어 추가 검사를 위하여 내원하였다. 과거력에는 특이 소견이 없었고, 아버지가 소세포폐암으로 진단된 가족력이 있었다. 내원 시 활력징후는 정상이었으며, 복부 진찰 및 신체검진에서 특이 소견을 보이지 않았다. 일반 혈액 검사에서 혈색소 13.9 mg/dL, 백혈구 6,690/mm3, 혈소판 221,000/mm3였으며, 혈청 생화학 검사에서 AST/ALT 49/81 IU/L, 알부민 4.7 g/dL, 총 빌리루빈 1.4 mg/dL, 혈중 요소질소 11.2 mg/dL, 혈중 크레아틴 0.86 mg/dL였다. 혈청 전해질 및 종양 표식자는 모두 정상 범위였고, 심전도 검사와 단순 흉부 촬영은 정상이었다.
내시경 검사에서 십이지장 제3부에 내강으로 돌출된 1.6 cm 크기의 상피하 종양이 관찰되었으며(Fig. 1A), EUS에서 병변은 십이지장벽의 4층에서 기원하는 1.6×1.2 cm 크기의 비균질성 고에코 종양으로, 종양의 주위에 저에코 테두리(halo)가 관찰되었다(Fig. 1B). 복부 CT에서 종양은 동맥기(arterial phase)에 복부대동맥과 하대정맥의 중간 정도의 조영증강을 보이고 문맥기(portal phase)까지 지속되는 과혈관성 종괴로 관찰되어 신경내분비세포종양 또는 사구종양의 가능성이 있어 보였으나(Fig. 2), EUS에서 4층에 기원하고 있어 신경내분비세포종양보다는 사구종양의 가능성이 더 높아 보였다.
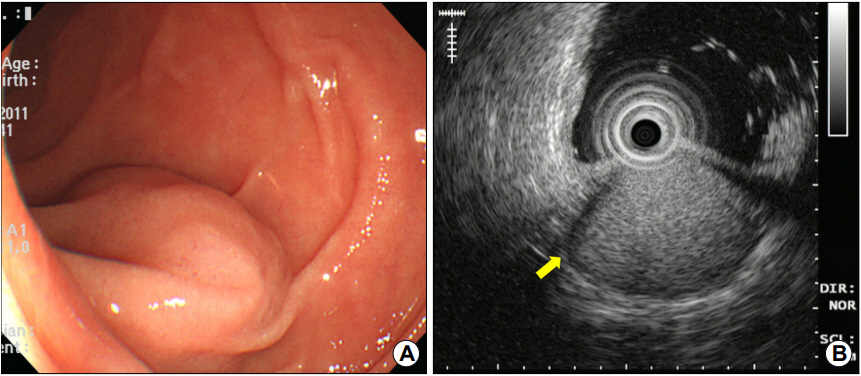
(A) Endoscopy image of a subepithelial tumor with smooth surface at the third portion of the duodenum. (B) Endoscopic ultrasonography image of a 1.6×1.2 cm sized, well-circumscribed, heterogeneously hyperechoic lesion with peripheral halos (arrow) in the proper muscle lay.
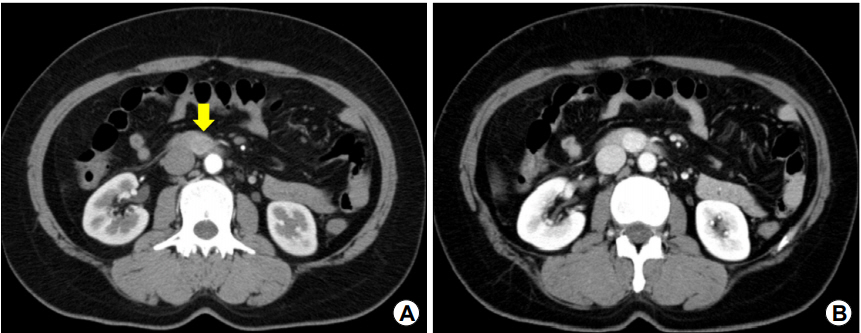
Contrast-enhanced CT findings. (A) A tumor showing moderate enhancement at the third portion of the duodenum in the arterial phase (arrow). (B) More hyperdense enhancement during the portal phase.
병변의 악성도 가능성을 고려하여 췌십이지장절제술(pancreaticoduodenectomy)이 시행되었으며, 절제된 십이지장의 육안 소견에서 근육층에 황갈색의 고형성 종괴가 관찰되었다. 광학현미경 소견에서 종양세포는 섬유에 의하여 분리되는 다양한 크기의 세포 소엽으로 구성되어 있으며, 개개의 종양세포들은 비교적 균일하고 둥근 핵을 가지고 세포질은 투명하거나 경한 호산성을 띄고 있었다(Fig. 3A). 면역조직화학염색에서 chromogranin, cytokeratin, c-kit, CD56에는 음성 소견을, smooth muscle actin (SMA)과 calponin에는 양성 소견을 보여 최종적으로 사구종양으로 진단되었다(Fig. 3B). 환자는 수술 후 특별한 합병증을 보이지 않았으며, 수술 후 32일째 퇴원 후 9년째 재발 없이 외래 추적 관찰 중이다.

Histopathological findings. (A) The tumor consists of small uniform round cells with centrally located nuclei, a pale cytoplasm, and a well-defined cell membrane. The tumor cells show no mitosis or nuclear atypia (H&E, ×400). (B) On immunohistochemical staining, the tumor cells are positive for smooth muscle actin (immunohistochemical staining, ×200).
고 찰
사구종양은 1924년에 Barre와 Masson에 의하여 처음 기술된 사구세포에서 발생하는 양성 종양으로, 남성보다는 여성에서 많이 발생한다[4]. 대개 손가락 끝이나 발가락 끝에 호발하지만 드물게 위장관, 신장, 자궁, 질, 종격동, 기도, 뼈, 천미부 기형종에도 발생하는 것으로 보고되고 있다[3,5-7]. 위장관에 발생 시에는 다른 부위보다 위에서 많이 발생하며[3], 무증상에서부터 가벼운 상복부 불편감, 점막의 궤양에 의한 토혈, 혈변, 오심, 구토 등이 동반될 수 있다[8]. 사구종양의 크기는 대개 2 cm 정도이지만 20 cm 이상의 큰 경우도 있으며[9], 대부분이 점막하층과 고유근층 사이에 위치한다. 조직병리학적으로 사구종양은 피막에 의하여 싸여 있고, 단단한 혈관벽 기원의 사구세포로 구성되어 있다[10].
사구종양은 상피하 종양이므로, EUS가 진단에 중요한 역할을 한다. 대부분 4층(일부에서는 3층)에서 기원하는 비균일 저에코 병변으로 나타나는 것이 특징적이나 본 증례와 같이 고에코 병변으로 보이기도 한다. 대개는 단발성으로 발생하며, 내부에 고에코 반점, 불규칙한 윤곽 등이 있으면 악성을 시사하기도 한다[11]. 종양 주위로 종양보다 더 낮은 에코를 보이는 테두리가 관찰되기도 하며, 이는 사구종양의 특징적인 소견일 수 있다[12]. 하지만 위장관간질종양 및 신경초종의 일부에서도 사구종양의 경우만큼 뚜렷하지는 않지만 저에코 테두리가 관찰될 수 있다[13,14]. 본 증례에서도 고에코 종양의 주위에 저에코 테두리가 관찰되었으며, 이는 사구종양을 둘러싸고 있는 근육층의 비후에 의한 음영으로 여겨진다[3,12]. 조직학적으로 사구종양은 풍부한 혈관 조직으로 구성되어 있기 때문에 CT에서는 강하고 균일한 조영증강을 보이는 게 특징적인데, 이는 다른 간엽성 종양과의 감별점이다. 특히, 문맥기의 종양과 대동맥의 종양 증강의 비율(lesion-to-aorta enhancement ratio)이 0.86보다 높은 소견이 사구종양의 특징적인 CT 소견이다[15].
사구종양의 조직 소견은 다양한 크기의 소엽을 형성하거나 혈관 주위를 따라 군집을 형성하는 사구세포와 불규칙한 혈관 증식을 나타낸다[4,16]. 면역조직화학염색은 사구종양과 다른 상피하 종양, 특히 위장관간질종양과 같은 간엽성 종양과의 감별에 도움을 줄 수 있는데, 사구종양은 SMA, vimentin, H-caldesmon, calponin에는 양성이나 CD117, CD34, S100, desmin, chromogranin, factor VIII related antigen, cytokeratin에는 음성을 나타낸다[11,17].
사구종양은 대부분 양성 종양이지만 드물게 악성화하여 원격 전이를 일으킬 수 있다[3]. 치료는 수술적 제거가 원칙이며, 위장관 사구종양의 경우 발생 부위에 따라 복강경 위 절제술, 췌십이지장절제술 등을 시행한다. 불완전 절제 시에는 국소 재발이 비교적 흔하며, 주로 고유근층에 위치하며 주변 조직과 유착되어 있는 경우가 많아 천공의 위험이 높다는 점 등으로 인하여 내시경 절제술은 부적절할 것으로 생각된다[16]. 대부분의 사구종양은 수술 후의 병리조직 소견으로 진단되기 때문에 수술 전에 EUS, CT 소견만으로 진단이 적절하게 이루어진다면 불필요하게 확장된 수술을 예방할 수 있을 것으로 보인다. 본 증례의 경우도 십이지장 제3부에 발생한 사구종양으로 병변의 악성도 가능성을 완전히 배제할 수 없어 국소 절제술 대신 광범위한 췌십이지장절제술을 시행하였다.
요약하면, 사구종양은 동정맥 문합총의 혈관벽에서 유래하는 양성 종양으로 위장관, 특히 십이지장에 발생하는 경우는 매우 드문 것으로 알려져 있다. 저자들은 검진 상부위장관 내시경 검사 시 우연히 발견된 십이지장 상피하 종양으로 내원한 43세 여자에서 EUS 및 CT 검사 후 수술을 통하여 최종적으로 십이지장 사구종양으로 진단된 예를 경험하였기에 문헌 고찰과 함께 보고하는 바이다.
Notes
No potential conflict of interest relevant to this article was reported.
