내시경 점막하 박리술로 치료한 위바닥샘형 선암 1예
Gastric Adenocarcinoma of Fundic Gland Type Treated by Endoscopic Submucosal Dissection
Article information
Trans Abstract
Gastric adenocarcinoma of fundic gland type is known to originate from the gastric mucosa of the fundic gland region without intestinal metaplasia. It is difficult to detect during endoscopy and diagnose histopathologically. The development of immunohistochemistry has enabled the diagnosis of gastric adenocarcinoma of fundic gland type by gastric phenotype. A 34-year-old man visited us for treatment of a 5 cm-sized low-grade dysplasia in the gastric fundus which was incidentally found during a health check-up endoscopy. Endoscopic submucosal dissection was performed successfully, and the final histopathology showed gastric adenocarcinoma of fundic gland type. Herein, we report a rare case of gastric adenocarcinoma of fundic gland type and its endoscopic and histopathologic findings.
서 론
위암은 전통적으로 Lauren 분류법에 의해 장형과 미만형으로 분류되거나[1] 샘의 형성 경향에 기초한 Nakamura 분류법에 의해 분화형과 미분화형으로 구분되어 왔다[2]. 2007년 일본에서 Tsukamoto 등[3]에 의해 새로운 유형의 으뜸세포(chief cell) 분화를 보이는 위선암이 처음으로 보고되었고, 2010년에는 Ueyama 등[4]에 의해 형태학적 소견과 면역조직학적 소견을 기반으로 위바닥샘형 선암(gastric adenocarcinoma of fundic gland type)이 정의되어 이후 일본의 위암분류에서 새로운 형태의 위암으로 포함되었다[5]. 2012년 국내 연구에 의하면 6,000예가 넘는 위암 치료의 증례 중 3예만이 위바닥샘 분화를 보이는 위선암이었으며[6], 2018년까지 전 세계적으로 약 110예의 위바닥샘형 선암 증례가 보고되고 있다[7].
현재까지의 보고에 의하면 위바닥샘형 선암은 일반적으로 만성위염이나 장상피화생이 없는 위바닥샘의 위점막에서 발생하고, 내시경 소견은 크게 상피하종양(subepithelial tumor) 형태와 편평/함몰 형태로 나눌 수 있다고 알려져 있다[8]. 조직학적으로는 mucin (MUC) 6 및 pepsinogen-1과 같은 면역조직화학적 염색에 양성을 보이며, 이는 다른 질환과의 감별진단에 도움이 된다[9].
저자들은 젊은 남자 환자에서 검진 내시경 시 우연히 발견된 저등급샘종(low grade adenoma)에 대해 내시경 절제술을 시행한 후 최종적으로 위바닥샘형 선암으로 진단된 1예를 문헌 고찰과 함께 보고하는 바이다.
증 례
34세 남자가 검진 시 우연히 발견된 위 저등급샘종으로 본원에 내원하였다. 과거력에서 특이 병력이 없었으며, 음주력과 흡연력은 없었다. 가족력에는 할아버지의 위암 병력 외 다른 특이사항은 없었다. 내원 시 환자의 전신 상태는 양호하였고 경부 림프절 종대도 관찰되지 않았다. 복부 촉진에서 압통은 없었으며 만져지는 종괴도 없었다. 검사실 소견에서 말초혈액 검사는 백혈구 6,560/mm3, 혈색소 13.7 g/dL, 혈소판 232,000/mm3이었고, 생화학 검사에서 알부민 4.9 g/dL, CRP 0.05 mg/dL, CEA 1.69 ng/mL, CA 19-9 5.69 U/mL였다.
본원에서 내시경 검사 시 위바닥(gastric fundus) 전벽에 약 5 cm 크기의, 주변 점막과 유사하지만 다소 퇴색을 보이는 융기성 병변이 관찰되었으며(Fig. 1A), 위 전반에 걸쳐 위축성 변화는 관찰되지 않았고 Helicobacter pylori (H. pylori)에 대한 조직검사 및 신속요소분해효소 검사는 음성이었다. 상기 병변에 대해 내시경 점막하 박리술(endoscopic submucosal dissection, ESD)을 시행하기로 계획하였다. 인디고카민 용액 산포 후 병변의 경계 약 5 mm 밖에 아르곤 플라즈마 응고법(argon plasma coagulation)으로 표시한 뒤에 점막하에 생리식염수와 인디고카민 용액이 혼합된 용액을 주입하였다. 이후 flex 나이프(Olympus, Tokyo, Japan)와 IT 나이프(Olympus)를 사용하여 병변을 완전 절제하였다(Fig. 1B-F).

Endoscopic submucosal dissection procedure. (A) An approximately 5 cm-sized, slightly discolored, elevated lesion is seen at the anterior wall of the gastric fundus. (B) Chromoendoscopy with indigo carmine reveals a clearer lesion. (C, D) Circumferential mucosal incision and submucosal dissection are performed. (E) The lesion is completely removed. (F) The resected specimen.
절제조직의 병리 소견에서 5.1×3.8 cm 크기의 IIa 병변으로, 종양은 점막고유층(lamina propria mucosae)을 침범하고 있었다(Fig. 2A). 종양은 경한 핵의 이형성을 가진, 분화가 좋은 원주세포들로 구성되어 있었으며, 이들 세포들은 위저선의 으뜸세포 및 벽세포와 유사하였다(Fig. 2B). 림프관 및 혈관 침윤 소견은 없었으며, 수직 및 수평 절제면에도 암의 침윤 소견은 없었다. 면역조직화학적 검사에서 MUC5AC에는 국소적인 양성 소견, MUC6에는 강한 양성 소견, MUC2와 CD10에는 음성 소견을 보였다(Fig. 2C-F). 상기 소견을 토대로 최종적으로 점막층에 국한된 위바닥샘형 선암으로 진단되었다. 환자는 ESD 후 출혈이나 천공 등 특별한 합병증 없이 시술 2일 후에 퇴원하였으며, 이후 5년간 매년 내시경 검사 및 CT를 시행하였으며 재발 소견은 없었다.
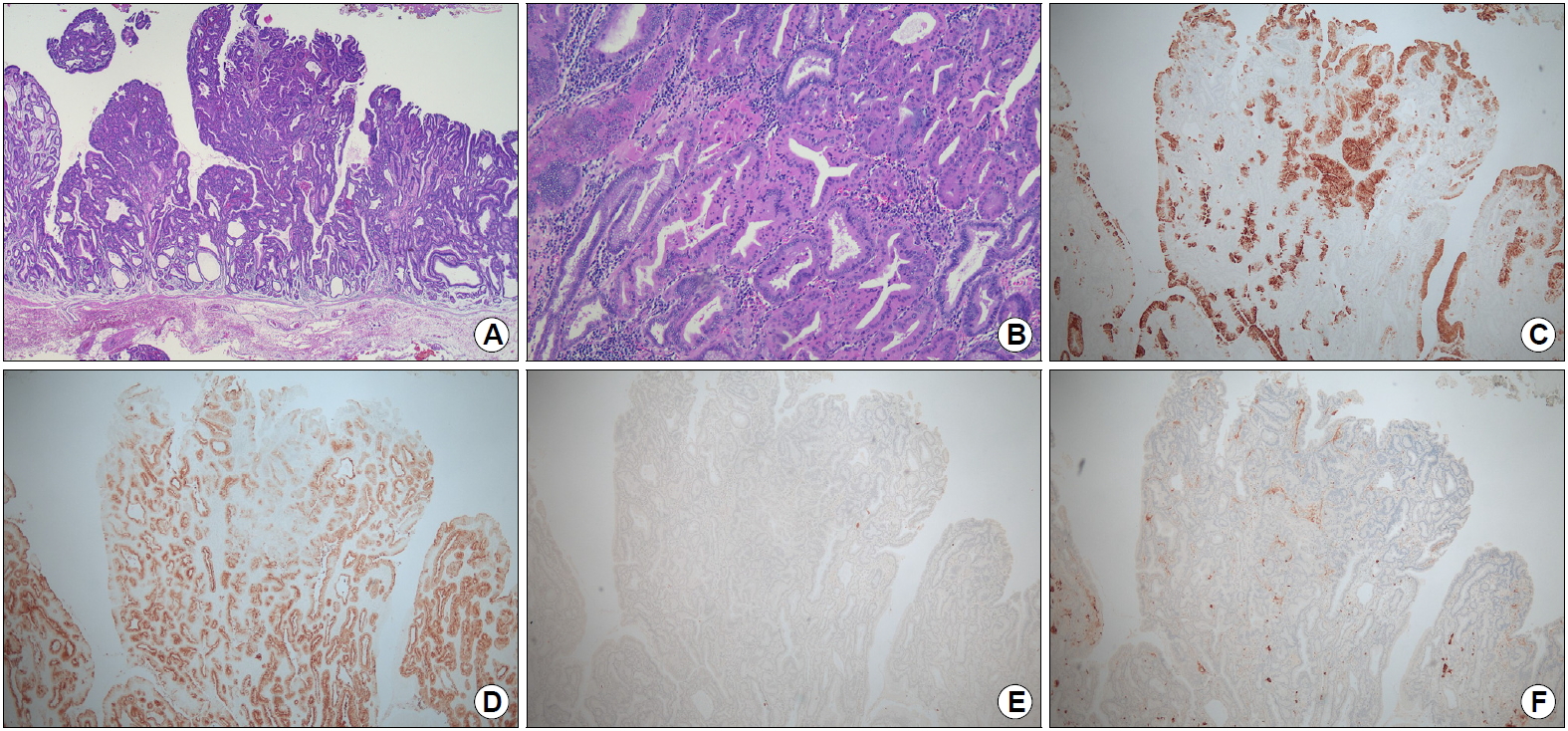
Histopathologic findings. (A) Carcinoma invasion into the lamina propria mucosae (H&E, ×20). (B) The tumor is composed of well-differentiated columnar cells mimicking the fundic gland cells (mixed chief cells and parietal cells) with mild nuclear atypia (H&E, ×100). (C-F) Immunohistochemical staining: carcinoma cells reveal focal positivity for MUC5AC (C), diffuse positivity for MUC6 (D), and negative staining for MUC2 (E) and CD10 (F) (immunohistochemical stain, ×40).
고 찰
최근에 드문 형태의 위암으로 새롭게 정의된 위바닥샘형 선암에 대한 보고는 많지 않지만, 위바닥샘형 선암은 주로 고령 환자의 위 상부 1/3에서 주로 발생하고 남녀비는 1.4:1이며, 위축이 발생하지 않은 정상 위바닥샘의 심부에서 암의 발생이 시작되고 병변의 크기가 작더라도 점막하층으로 침윤하는 경우가 적지 않다고 알려져 있다[9,10]. 하지만 세포의 증식 활성도가 낮고 일부에서만 재발이나 전이가 관찰되기 때문에, 이 형태의 위암은 양호한 예후를 가지는 저등급의 악성 종양으로 간주되고 있다[4]. 또한 위바닥샘형 선암은 대부분 H. pylori 감염이 없는 환자의 비위축 점막에서 생기지만, H. pylori 제균 치료의 기왕력이 있는 환자의 비위축 점막에서의 발생도 보고되고 있다[11]. 본 증례의 경우도 위축이 발생하지 않은 위바닥에서 발생하였고 H. pylori 감염도 없었지만, 이전 보고와는 다르게 34세라는 젊은 연령에서 발생하였다.
위저선형 선암의 특징적인 내시경 소견은 상피하종양 형태, 퇴색조, 표면에 나뭇가지 모양의 확장된 혈관 그리고 위축이 없는 영역에서의 발생이라고 알려져 있다[8]. 평균 종양의 크기는 7.5 mm이며, 약 80%에서는 크기가 10 mm 미만이었다[9]. 본 증례의 경우에는 비위축 영역에서 발생한 퇴색조 병변이었지만, 5 cm 크기의 IIa 병변이었으며 표면에 나뭇가지 모양의 확장된 혈관 소견은 관찰되지 않았다.
위바닥샘형 선암의 병리조직 소견은 고분화형 선암으로, 위바닥샘과 유사한 다소 비전형적인 원주세포들로 구성되어 있다. 그리고 종양이 위바닥샘의 기저부에 있는 으뜸세포에서 주로 기원하기 때문에, 종양의 표면은 비전형적인 선와상피(foveolar epithelium)로 덮여 있는 경우가 많다. 그러므로 내시경 생검 소견 시 이형성 정도가 낮은 병변으로 오인될 수 있다[9]. 본 증례에서도 내시경 생검 결과는 저등급샘종이었고, ESD 후 최종적으로 위바닥샘형 선암으로 진단되었다.
면역조직화학적 검사는 위선암의 점액 표현형(mucin phenotype)의 구분과 기원을 예측하는 데에 도움을 주는데, 위바닥샘형 선암의 경우는 위형 표현형(gastric phenotype)을 보이며, 또한 위바닥샘 마커인 pesinpogen-I 및 H+/K+-ATPase에 양성 소견을 보인다[9]. 특히 으뜸세포의 마커인 pepsinogen-I에 대한 양성 소견은 위바닥샘형 선암의 진단에 특이적인 것으로 알려져 있다[4]. 본 증례에서도 목점액세포(mucous neck cell) 마커인 MUC6에는 양성 소견, 술잔세포(goblet cell) 마커인 MUC2와 장솔가장자리세포(intestinal brush border cell) 마커인 CD10에는 음성 소견을 보여 위형 표현형을 보였다. 선와상피 마커인 MUC5AC의 경우는 초기의 위바닥샘형 선암에서 발현되는 경우는 드물지만 병변의 크기가 큰 경우나 심한 점막하침윤이 발생한 경우에는 발현될 수 있으며, 이는 암세포의 분화가 위바닥샘형에서 선와상피형으로 변화하는 것에 기인된다고 추측되고 있다[4]. 본 증례에서는 MUC5AC에 국소적인 양성 소견을 보였으며, 이는 병변의 크기가 5 cm 정도로 컸기 때문으로 생각된다. 비록 본 증례에서는 pepsinogen-I에 대한 면역조직화학적 검사를 시행하지 못하였지만, 특징적인 H&E 염색 소견 및 점액 표현형에 대한 면역조직화학적 검사 결과를 토대로 위바닥샘형 선암으로 진단할 수 있었다.
일본 위암의 치료 가이드라인에 따르면 위바닥샘형 선암은 일반적인 분화형 위암과 동일하게 종양의 크기가 작고 점막하층의 침윤이 없는 경우에는 내시경 절제술로 치료가 가능하며, 비교적 예후도 양호하다[5]. 하지만 점막하층을 500 μm 이상 침윤한 위바닥샘형 선암의 경우에는 국소 재발이나 장기 생존율에 관하여 보고된 증례의 수가 극히 적고, 일부에서는 림프관 및 혈관 침윤 소견 및 림프절 전이를 보인 예도 있기 때문에[9] 이러한 경우에서는 현시점에서 내시경 수술보다는 외과적 수술을 시행하는 것이 바람직하다.
위바닥샘형 선암은 국내에서 빈도가 드물고 이를 충분하게 인지하고 있는 소화기내과 및 병리의사들도 많지 않다. 또한 위바닥샘형 선암은 위축성 위염이나 장상피화생이 없는 위바닥샘 영역의 점막에 발생하기 때문에, 최근 국내에서의 H. pylori 감염 유병률의 감소 추세를 고려한다면 이러한 형태의 위암의 발생은 서서히 증가할 것으로 생각해 볼 수 있다. 그러므로 위바닥샘형 선암을 조기에 정확하게 진단하기 위해서는 내시경 시행 시 이러한 병변의 특징을 충분히 숙지하고, 만약 위바닥샘형 선암을 시사하는 내시경 소견이 관찰된다면 이에 대해 병리의사에게 정보를 제공하여 추가적인 면역조직화학적 검사를 시행하도록 해야 할 것이다[9].
요약하면 저자들은 검진 목적으로 시행한 내시경 검사에서 우연히 발견된 위 저등급샘종을 ESD로 절제한 뒤 최종적으로 위바닥샘형 선암으로 진단된 예를 경험하였기에 문헌 고찰과 함께 보고하는 바이다.
Notes
Gwang Ha Kim is an editor-in-chief of the Journal but did not involve in the peer reviewer selection, evaluation, or decision process of this article. No other potential conflicts of interest relevant to this article were reported.
