신장 종양에 대한 내시경 초음파 유도하 세침흡인생검
Endoscopic Ultrasound-guided Fine-needle Aspiration Biopsy of a Renal Mass
Article information
Trans Abstract
Traditionally, tissue biopsies of kidney lesions are usually performed with CT or percutaneous ultrasound guidance, but biopsies using EUS have rarely been reported. In this report, we describe a case of renal cell carcinoma (RCC) diagnosed using EUS-guided fine-needle aspiration biopsy. A 75-year-old woman taking aspirin due to stable angina continued to exhibit weight loss and anemia and visited the gastroenterology department. No bleeding was observed on upper and lower gastrointestinal endoscopy. A contrast-enhanced mass was observed in the left kidney, accompanied by 8.9×10.8 cm-sized necrosis suggesting RCC on abdominal CT. Chest CT showed masses in both lungs. We planned to administer targeted therapy after pathological confirmation using EUS. Aspirin was continued, and we performed fine-needle biopsy using a 22-gauge needle three times. No adverse events were observed after the procedure. Pathological examination confirmed RCC, clear cell type, and the patient is currently undergoing treatment with sunitinib. EUS-guided fine-needle aspiration biopsy is safe for liver, pancreatic, or other tumors accessible from the upper gastrointestinal tract. This technique shows fewer adverse events. To the best of our knowledge, there have been no other reports on EUS-guided fine-needle aspiration biopsy to identify RCC in Korea.
서 론
신세포암은 신장 절제술 후 고형 신장 병변의 70~90%를 차지하는 암으로, 모든 암의 2%를 차지한다고 알려져 왔다. 따라서, 전산화단층촬영(CT) 또는 자기공명영상(MRI)에서 신장 신생물이 발견되면 수술적 치료를 고려하게 된다. 하지만 최근 연구에서는 최대 30%의 신장 병변이 수술 시 양성인 것으로 나타났다. 수술 전 생검은 불필요한 수술을 피하고 적절한 치료 전략을 선택하는 데 도움이 될 수 있다[1].
전통적으로 신장 병변의 조직 채취는 전산화단층촬영이나 초음파 유도하 경피적 방법으로 시행되고 있으며, 초음파 내시경을 이용한 조직 채취는 보고된 바가 드물다. 이에 저자들은 asprin 복용 중인 폐 전이 신장암 환자에서 내시경 초음파 유도하 세침흡인생검의 성공적인 조직 채취 증례를 보고하는 바이다.
증 례
75세 여자로 안전형 협심증으로 aspirin을 복용 중이었으며 고혈압, 당뇨의 과거력이 있는 환자였다. 내원 5개월 전부터 72 kg에서 51 kg으로 체중 감소가 있었으며 어지럼증 및 빈혈이 지속되어 본원 소화기내과로 내원하였다. 상부위장관 내시경 및 하부위장관 내시경에서는 출혈이 관찰되지 않았고, 복부 전산화단층촬영에서 신세포암을 시사하는 8.9×10.8 cm 크기의 괴사를 동반하는 조영증강 종괴가 좌측 신장의 상극(upper pole)에 관찰되었으며(Fig. 1), 흉부 전산화단층촬영에서는 양측 폐에 다발성 전이로 생각되는 종괴가 관찰되었다. 영상의학과에 경피적 조직검사를 의뢰하였으나 고령의 환자이고 aspirin 복용 중으로 합병증 발생 가능성 및 종양의 위치가 신장 상극에 위치한 이유로 경피적 조직검사가 어려워, 내시경 초음파 유도하 세침흡인생검을 계획하였다. Aspirin은 중단하지 않았고, 환자는 좌측 측와위를 취하고, midazolam 3 mg을 이용하여 중등도 진정하에 시술을 진행하였다. 선형 내시경 초음파(linear EUS)로 병변을 확인한 뒤 병변을 관찰하면서 22 gauge 바늘에 탐침을 장착하여 병변 내 삽입 후 탐침을 제거하고 20 mL 주사기를 이용하여 음압을 걸어 세침흡인검사 및 조직 채취를 하였고, 부채꼴 모양으로 방향을 다르게 하며(fanning technique) 3회에 걸쳐 시행하였다(Fig. 2). 장비는 Olympus GF-UCT 240 ultrasonic gastrovideoscope (Olympus Co., Tokyo, Japan)를 사용하였다. 내시경의 선단은 위 체부의 후벽에 위치하였고(Fig. 2), 위벽과 조직생검 목표 사이에 다른 해부학적 구조물은 관찰되지 않았다. 색조도플러영상을 이용하여 주요 혈관을 피하여 시술하였고, 시술 후 부작용은 없었다. 병리조직검사에서 신세포암, 투명세포암 유형으로 진단되었고(Fig. 3), 면역화학 염색에서 epithelial membrane antigen 양성, vimentin 양성, CD10 양성, cytokeratin 7 음성, cytokeratin 20 음성, renal cell carcinoma marker 양성으로 확인되었다(Fig. 3). 환자는 혈액종양내과로 의뢰되어 sunitinib 치료 중이다.
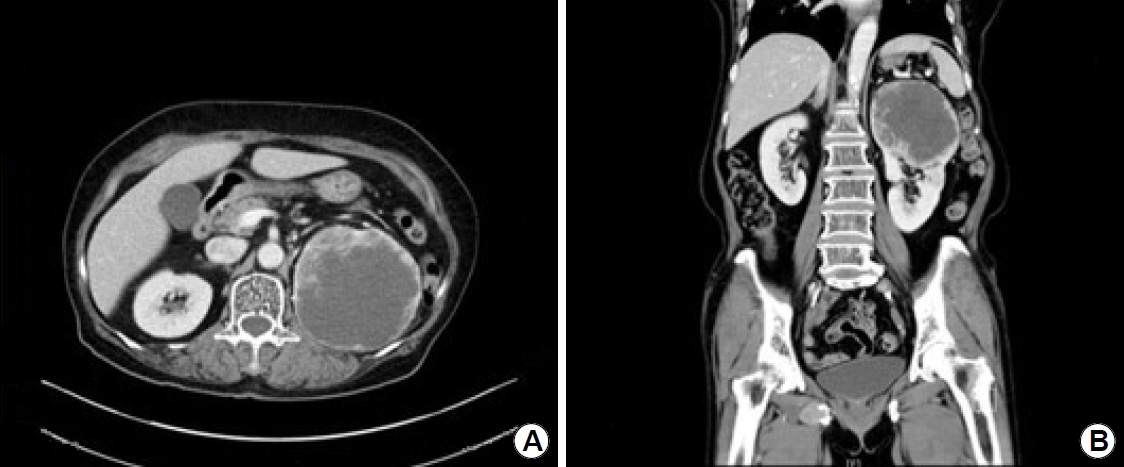
(A, B) A contrast-enhanced mass accompanied by 8.9×10.8 cm-sized necrosis in the upper pole of the left kidney.
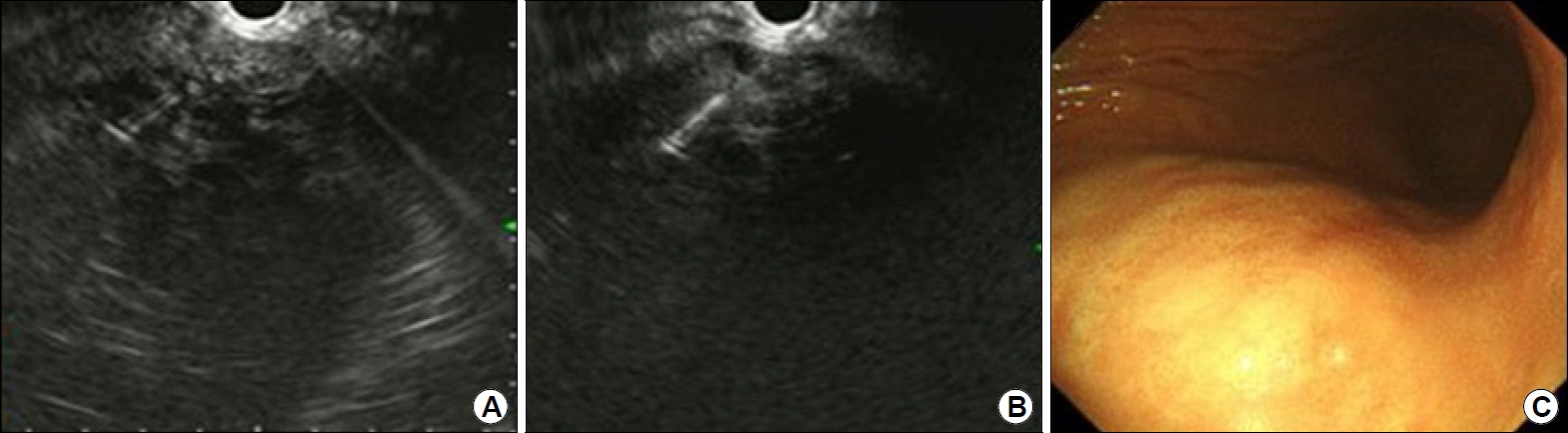
(A, B) An approximately 10-cm low to mixed echoic mass is observed in the left kidney. Using a 22-gauge needle, fine-needle aspiration biopsy is performed three times using a fanning technique. (C) The endoscope is placed on the posterior wall of the upper body of the stomach.
고 찰
신장 종양의 조직 채취는 주로 전산화단층촬영이나 경피적 초음파 유도하에 시행되고 있으며, 초음파 내시경을 이용한 조직 채취는 현재까지 보고된 바가 드물다[2]. 영상학적 기법이 발전하였으나 경피적 생검이 모든 경우 가능한 것은 아니고, 주로 후측 신장에 위치한 경우 접근이 용이하며, 본 증례와 같이 상극에 위치한 경우 경간(transhepatic) 접근 등의 대체적 방법 등이 사용된다. 초음파를 이용한 세침흡인생검은 현재까지 간, 췌장 또는 상부위장관에서 접근 가능한 종양에서 안전한 방법으로 알려져 왔고, 초음파 내시경을 통해 양측 신장 모두에서 조직 채취가 가능하다[3]. 우측 신장 병변의 경우 초음파 내시경 선단을 십이지장의 하행부에 놓고 외측으로 시행할 수 있으며, 본 증례와 같이 좌측 신장의 병변은 위 체부에서 후측방을 보며 시행할 수 있다. 색조도플러영상은 주요 혈관을 피하는 데 도움을 준다[1].
초음파 내시경을 이용한 신장 종양의 세침흡인생검은 현재까지 드물게 보고되었고, 내시경 초음파용 바늘의 선택은 시술 목적, 병변의 위치, 병변의 크기에 따라 다양한 종류의 바늘을 선택할 수 있다[4]. 세침흡인생검을 위한 바늘은 현재까지 3가지(19, 22, 25 G)가 사용 가능하고, 굵은 바늘일수록 조직 채취에 용이하다[1,4].
세침흡인을 이용한 작은 양의 세포 샘플은 저등급 암과 양성 병변을 구분하는 데 적합하지 않아, 중심부 생검(core biopsy)이 조직학적 진단에 선호된다[1]. 본 증례에서는 22 G 바늘을 이용하여 부채꼴 모양으로 3회에 걸쳐 조직검사를 시행하였고, 적절한 조직 검체를 획득하였다. 탐침의 사용 유무는 진단의 정확성에는 유의한 효과가 없다고 알려져 있으나, 바늘이 막히는 것을 막고 혈액으로 인한 조직의 오염을 막는다는 장점이 있는 것으로 알려져 있다. 음압을 이용한 흡입의 경우에도 초음파 내시경 유도하 생검 시 혈액이 오염될 수 있지만, 민감도와 정확도가 증가하는 것으로 보고되고 있다[5].
초음파 유도하 세침흡인검사는 중심부 전방(central anterior)에 위치한 신장 종양에서 가장 선호될 수 있으며, 후방에 위치한 종양은 경피적 방법이 우월하다.
내시경 초음파 유도하 신장 종양의 세침흡인생검 관련 합병증은 다른 위장관 종양의 흡인검사와 비슷하게 출혈, 감염, 혈종, 혈뇨, 기흉, 바늘을 통한 파종성 전이(needle tract seeding) 등이 있을 수 있다. 하지만 관련 합병증의 위험도는 1~6% 미만으로 알려져 있고, 경피적 초음파 유도하 생검에 비해 통증이 적고, aspirin이나 항혈전제 복용 중에도 비교적 안전하게 시행할 수 있다[1,6]. 또한 현장 병리(onsite pathology)가 필요 없고, 더 적은 수의 조직층을 가로지르므로 파종성 전이의 위험성이 낮고, 입원 기간을 최소화할 수 있으며 외래에서 시행할 수 있다는 장점이 있다[1].
내시경 초음파를 이용한 새로운 기법들이 발전됨에 따라, 내시경 초음파를 이용한 신장 종양의 관찰과 조직 채취 또한 이루어지고 있다. 이 기법은 부작용 발생 확률이 낮은 안전한 기법으로 입원 기간을 줄이거나 외래에서 시행할 수 있다는 장점이 있어 앞으로 발전이 더 기대되는 바이다. 저자들은 aspirin 복용 중인 환자의 신장 종양에 대한 내시경 초음파 유도하 세침흡인생검을 안전하고 성공적으로 시행하였기에 증례를 보고하는 바이다.
Notes
No potential conflict of interest relevant to this article was reported.

