상피하종양 형태의 위암
Subepithelial Tumor-like Gastric Cancer
Article information
Trans Abstract
Subepithelial tumor-like gastric cancer (SET-like GC) is a special type of gastric cancer with a relatively low prevalence of approximately 1%. Diagnosing SET-like GC is challenging because the tumor is often covered with normal mucosa. The mechanisms of occurrence of SET-like GC include: 1) excessive infiltration of lymphocytes in the cancer, 2) intensive secretion of mucin by mucinous adenocarcinoma, 3) excessive fibrosis around the cancer, and 4) adenocarcinoma arising from heterotopic gastric glands in the submucosa. It is important to be aware of the endoscopic features of SET-like GC to differentiate it from other subepithelial tumors, to recognize the possibility of SET-like GC, and to make a diagnosis before treatment. In this review, we summarized the epidemiologic and clinicopathologic characteristics of SET-like GC.
서 론
위암은 주로 위점막의 고유층에서 시작하여 발생하는 상피성 병변이 대부분이다. 이러한 종양 중 융기성 형태를 보이는 경우 암의 표면은 주변 점막과 분명히 구별되고, 점막이 높게 올라와 있는 경우가 일반적이다. 하지만 드물게 점막 구조는 유지된 상태에서 점막 심부에 암세포가 침윤되기 시작하여 상피하종양 (subepithelial tumor) 형태를 띠는 특수한 형태의 위암이 존재한다[1]. 상피하종양 형태의 위암은 처음부터 위암으로 의심하기 어려운 경우가 많으며, 이러한 형태의 암에는 특수한 조직형의 위암이 포함될 수 있어 임상적으로 진단이나 치료 결정에 어려움이 있다. 가끔 상피하종양 형태로 발견되는 국소적 Borrmann type 4 위암, 신경내분비세포암, 악성 림프종, 전이성 위암 등도 있지만 상피하종양 형태의 위암의 정의에 포함되지 않아 논의 대상에서 제외하였다. 본고에서는 상피하종양 형태의 위암의 특징과 진단적 접근에 대해서 자세히 알아보고자 한다.
본 론
1. 역학과 임상적 특징
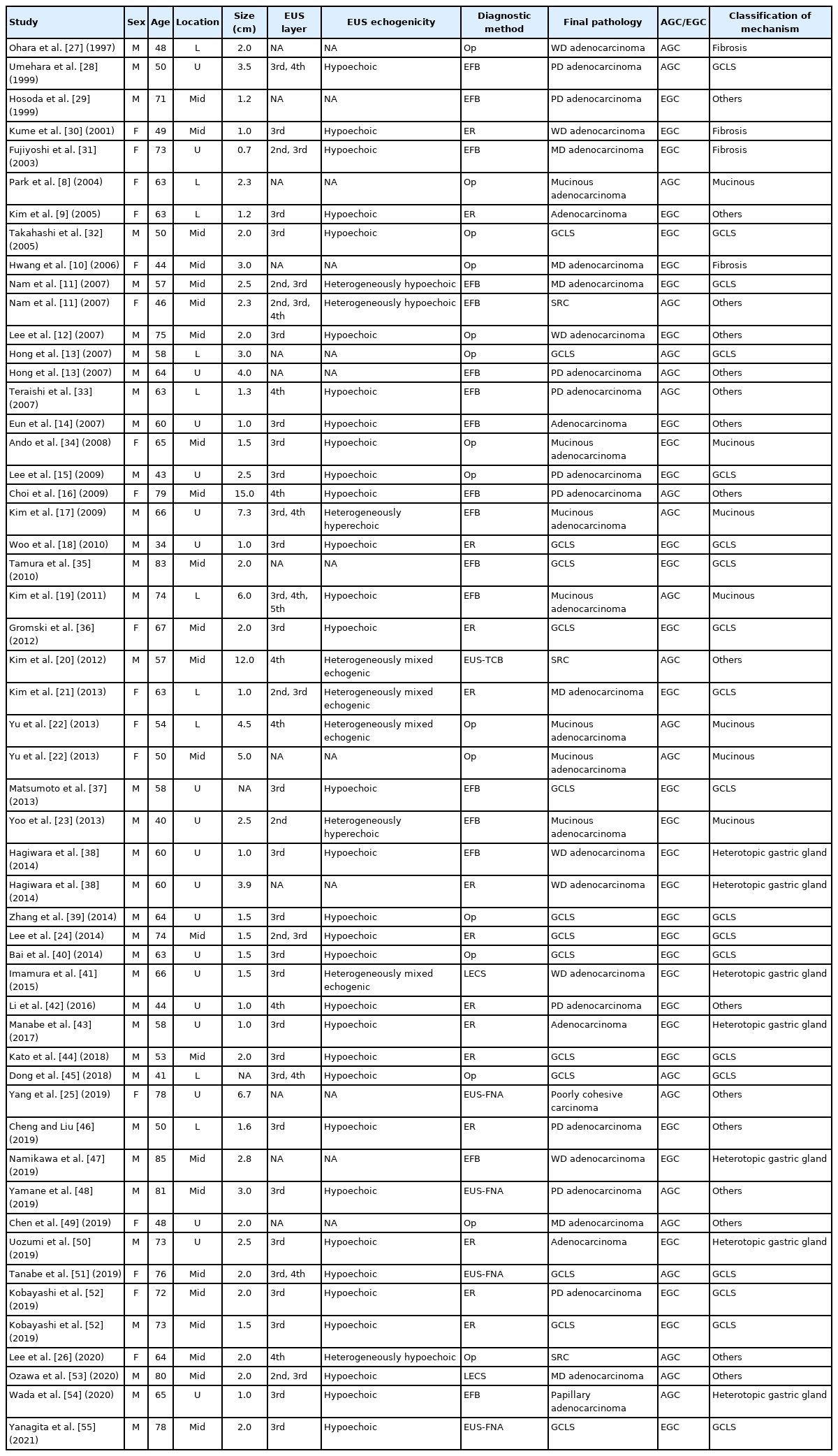
상피하종양 형태의 위암은 융기형 위암 중에서 내시경 검사시 대부분의 점막이 정상 점막으로 덮여 있으면서 암조직이 노출된 부분이 전체 종양의 20~30% 미만인 경우로 정의한다(Fig. 1) [2,3]. 상피하종양 형태의 위암의 정의도 확실히 정립된 것은 아니며, 연구자마다 기준이 다를 수 있다. 또한 대부분의 유병률 연구가 20년 정도 지난 연구이며, 다기관 또는 다국적 연구 결과는 없어 정확한 상피하종양 형태의 위암 유병률을 확인하기는 어렵다. 하지만 보고된 연구들을 살펴보면 상피하종양 형태의 위암의 정의에 따른 유병률은 모든 위암의 0.24~1.27%로 매우 낮다(Table 1) [2-7]. 하지만 대부분의 연구들이 일본에서 시행되었고, 후향적 분석이나 병리학적 소견을 토대로 확인된 증례가 많기 때문에 일부 과소 또는 과대 평가되었을 가능성이 있다. 국내에서는 증례 보고의 형식을 통한 상피하종양 형태의 위암들이 보고되어 왔다[8-26].

A case of subepithelial tumor-like gastric cancer. (A) At the posterior wall of the gastric lower body, a 25-mm-sized, subepithelial lesion with irregular hyperemic central depression is noted. (B) EUS demonstrates a heterogeneously hypoechoic lesion with scattered echogenic foci in the deep mucosal and submucosal layers (courtesy of Gwang Ha Kim from Pusan National Univer- sity College of Medicine).
상피하종양 형태의 위암에 대한 대규모 연구는 없기 때문에 발생 위치를 정확하게 파악하기는 어렵다. 하지만 일본에서 발표된 후향적 연구에 따르면 위를 상부, 중부, 하부로 나눴을 때, 주로 중부와 상부에서 많이 발견되는 것으로 나타났다[3,7]. 지금까지 보고된 증례들을 모아 분석하였을 때, 확인된 53개 증례 중 상부 20예, 중부 23예, 하부 10예로 이전 보고와 비슷하게 상부와 중부에 주로 많이 발견되는 것으로 확인되었다(Table 2) [8-55]. 이 중 우리나라에서 보고된 증례는 총 22개 증례이며 하부 6예, 중부 9예, 상부에 위치한 경우가 7예로 확인되었다. 기전이 명확하지 않은 경우가 많았으며, 주로 점액성 선암(6개 증례)이나 림프구 침윤 위암(6개 증례)이 보고되었다.
본원에서도 조기 위암 형태의 상부에 위치한 점액성 선암과 중부에 위치한 림프구 침윤 위암을 보고하였고, 발병 기전을 특정할 수 없지만 진행성 위암 형태로 중부에서 관찰된 상피하종양 형태의 반지세포암종을 보고하였다[11,23].
2. 발생 기전
상피하종양 형태의 위암의 발생에 대해서 명확히 밝혀진 기전은 없다. 따라서 기전을 확인할 수 없는 증례 보고도 종종 있지만, 암세포가 자라는 과정 가운데 상피하종양 형태로 변형되거나 나타나는 것을 고려해보면 다음 4가지 기전으로 정리해볼 수 있다.
1) 림프구의 과도한 침윤(excessive infiltration of lymphocytes)
첫 번째로 점막 부위의 암세포는 소량이라도, 점막하층 이하의 암세포가 풍부한 간질 주위 림프구 침윤을 유도함으로 상피하종양 형태를 형성하는 경우가 있다. 여러 증례 보고에서도 확인된 것처럼 림프상피종양 암종(lymphoepithelioma-like carcinoma) 또는 림프구 침윤 위암(gastric cancer with lymphoid stroma)이라고 명명되는 특수 형태의 위암이 있다[18,36,37,44]. 이러한 위암의 경우 점막하층에 주로 다량의 림프구 침윤이나 림프 여포의 형성 등이 유도되어 상피하종양 형태를 띠게 되고 점막 표면에는 노출된 위암 부위가 적기 때문에 치료 전 조직 검사로 위암이 진단되지 않는 경우가 있다. 이러한 림프구 침윤 위암의 경우는 80% 이상 Epstein-Barr 바이러스와 연관되어 발생하는 것으로 알려져 있다[56]. Shin 등[57]이 시행한 70명의 조기 림프구 침윤 위암에 대한 연구 결과를 보면, 81.4%에서 Epstein-Barr 바이러스 양성이 확인되었고, 조기 비림프구 침윤 위암에 비해서 점막하층 침윤이 77.1%로 의미 있게 높았으며, 8.6%에서 상피하종양 형태의 위암으로 확인되었다.
2) 점액성 선암에 의한 점액 분비(intensive secretion of mucin by mucinous adenocarcinoma)
두 번째로는 점액성 선암과 같이 암세포가 다량의 점액을 생성하는 종양에서는 심부 침윤부에서도 다량의 점액이 생성됨으로써 상피하종양의 형태를 띠게 된다[11]. 점막하층에 풍부한 점액층의 비율이 점막하층의 비후와 병변의 융기와 연관되어 있는 것으로 알려져 있고[58], 종양 내 세포외 점액량이 50% 이상인 경우 점액성 선암으로 진단할 수 있다[59]. 조기 점액성 선암을 분석한 연구에 따르면, 점액성 위암이 비점액성 위암에 비해서 점막하 침윤의 비율이 83%로 의미 있게 높았고[60], 진행성 위암으로 발견되는 경우가 많았다[61].
3) 위암 주변의 과도한 섬유화(excessive fibrosis around gastric cancer)
위암 주변에 과도한 섬유화가 동반된 경우 암세포가 점막고유층보다 점막근층에 먼저 침윤된 다음 점막고유층 밑으로 성장하여 상피하종양과 구별하기 어려운 육안 소견을 보일 수 있다[27,30]. 이러한 경우 점막 표면 부위는 섬유화 병변만 남아 있어 여러 번 조직 검사를 하더라도 암으로 진단되기 어려워 절제 후 진단되는 경우가 있다[27].
4) 점막하층의 이소성 위선에서 기원한 선암(adenocarcinoma arising from heterotopic gastric glands in the submucosa)
네 번째로는 점막하층의 이소성 위선에서 발생한 선암과 같은 매우 드문 경우도 있다. 이소성 위선은 절제된 1,500예의 위를 분석하였을 때 약 10.7% 정도에서 관찰되었다[62]. 이소성 위선은 선천적으로 점막하층에 존재하는 경우가 있으며, 점막의 반복적인 미란과 재생으로 인해서 상피세포가 점막하층으로 내려가면서 발생할 수도 있다[63]. 이소성 위선에서의 위암 발생 기전과 연관성에 대해서는 명확히 알려진 바가 없지만 하나의 가설로 심재성 낭종성 위염과 같이 지속적인 염증과 재생 가운데 장상피화생과 이형성을 통해 암이 발생하는 것으로 생각하고 있다[64]. 이러한 이소성 위선에서 발생한 위암의 경우도 상피하종양 형태를 주로 보이기 때문에 진단이 어렵고, 대부분 내시경 절제술 또는 수술 후 진단된 증례들이 보고되고 있다[38,41,43,47,50].
3. 진단적 접근
위암의 진단에는 조직학적 소견이 필수적이다. 그러나 이러한 상피하종양 형태의 위암의 경우에는 종양의 대부분이 정상 점막으로 덮여 있기 때문에 일반적인 조직 검사를 통해 진단되는 경우는 30%에 불과하며 수술적 절제 후 진단되는 경우가 흔하다[7,22]. 치료 전에 상피하종양 형태의 위암을 진단하거나 의심하는 것은 불필요한 치료 과정을 줄일 수 있기 때문에 중요하다. 특히 위장관간질종양의 경우 림프절 전이가 매우 드물기 때문에 기본적인 치료 방법에서는 쐐기 절제술 등의 종양 절제술 외 림프절 절제는 추가로 필요하지 않다[65]. 하지만 단순히 비교적 흔한 상피하종양이라고 판단하고 쐐기 절제술이나 종양핵 적출술만 시행하였다가 상피하종양 형태의 위암으로 진단되면 추가적인 근치적 위 절제술과 림프절 절제술을 다시 시행해야 하는 경우가 발생하므로 상피하종양 형태의 위암과 상피하종양의 감별진단은 중요하다[66]. 따라서 환자에게 최적인 치료를 위해서는 임상적으로 자주 관찰되는 상피하종양인지, 아니면 상피하종양 형태의 위암 가능성은 없는지, 의심의 과정을 가지고 접근하는 것이 중요하다.
이러한 치료 전 진단율을 높이기 위해서는 상피하종양과의 감별점을 이해하고 내시경 초음파 검사를 활용하는 방법이 있으며, 필요 시에는 내시경 초음파 유도하 생검이나 점막 절개 생검 등을 통한 적극적인 조직 검사를 고려해야 한다.
1) 상피하종양과의 감별 포인트
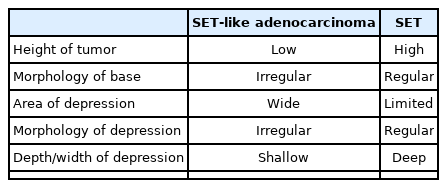
상피하종양 형태의 위암을 내시경적으로 구별하기 위해서는 종양 중앙부를 자세히 관찰하는 것이 중요하다. 특히 중앙부에서 한쪽으로 치우쳐서 보이는 경계가 뚜렷한 비전형적인 미란, 발적, 함몰 등이 있을 때는 단순 상피하종양보다는 상피하종양 형태의 위암을 의심할 수 있다. 또한 변연부의 백태 소견이 불균일한 것도 중요한 소견이다[7]. 일본에서의 상피하종양 형태의 위암과 상피하종양의 비교 연구에 의하면 주로 상피하종양 형태의 위암의 경우 융기의 높이가 상피하종양에 비해 낮고 기저부의 모양과 함몰부의 모양이 불규칙하며, 또한 함몰부가 넓은 대신 얕은 양상을 보이는 것이 상피하종양과의 감별점이었다(Table 3) [67].
2) 내시경 초음파 검사
상피하종양 형태의 위암의 내시경 초음파 소견은 발생 기전에 따라 각각 다르게 나타난다. 먼저 림프양 기질을 동반한 림프구 침윤 위암의 경우에는 주로 제2층부터 제3층에 걸쳐서 비교적 경계가 명료한 균일한 저음영 또는 혼합 음영의 종괴 모양을 보인다[21,24]. 반면, 점액성 선암의 경우에는 암의 진행 정도에 따라 다르지만 제3층과 제4층에 걸쳐, 때로는 제5층까지 침범하는 양상으로 낭종 모양을 보이고 점액의 점도에 따라 무에코 소견이나 혼합 에코 소견을 나타내며, 중간에 격벽이 관찰되는 경우도 있다[19,22]. 마지막으로 점막하층 이소성 위선에서 발생한 위암의 경우에는 종양 바로 아래, 제3층인 점막하층에 무에코 또는 혼합 에코 형태의 낭성 병변이 관찰된다[50,68]. 이러한 내시경 초음파 소견은 제4층인 근육층에서 저음영 종괴 형태로 주로 관찰되는 평활근종, 위장관간질종양, 신경초종 등과 같은 상피하종양과의 감별에 도움이 된다.
3) 컴퓨터단층촬영(CT)
최근에는 3차원적 컴퓨터단층촬영이 상피하종양의 진단과 함께 위암의 진단과 침윤 병기 설정에 도움이 되는 것으로 알려져 있다[69,70]. 하지만 상피하종양 형태의 위암 진단에 있어 내시경 외 컴퓨터단층촬영 등의 영상 검사의 역할에 대한 연구는 많지 않다. 점액성 위선암의 경우 컴퓨터단층촬영에서 점막하층에 점액이 자리잡고 있어 조영제 투여 컴퓨터단층촬영을 하더라도 조영제로 인한 조영증강이 잘 이루어지지 않는 것으로 알려져 있다[71]. 또한 Kim 등[72]이 시행한 연구에 따르면 림프구 침윤 위암의 경우에는 컴퓨터단층촬영에서 상피하종양 형태로 나타나는 경우가 178명 중 17명(9.1%)에서 확인되어 일부에서 진단에 도움이 되었다.
4) 조직학적 진단 방법
일반적으로 상피하종양 형태의 위암의 진단은 대부분 상피하종양의 진단 방법을 응용하여 시행한 경우가 많다. 상피하종양 형태의 위암의 경우에는 정의에서 언급된 것처럼, 일부는 점막 부위에 위암이 노출되어 있어 일반적인 겸자 조직 검사로 진단되는 경우도 있다. 하지만 대부분 첫 조직 검사에서 진단이 되지 않아 겸자 조직 검사를 여러 번 시행하거나 상피하종양의 경우처럼 내시경 초음파 유도하 생검을 진행하게 된다[73]. 상피하종양의 경우는 2 cm 미만인 경우에는 내시경 초음파 소견에 따라 경과 관찰하지만, 2 cm가 넘거나 고위험 소견이 관찰되면 적극적으로 조직 검사를 위해 내시경 초음파 유도하 생검을 시행하고 있다[74]. 하지만 크기가 2 cm 미만인 경우에는 내시경 초음파 유도하 생검의 진단율이 떨어지기 때문에 점막 절개 생검을 시행하기도 한다[75]. 상피하종양에서 점막 절개 생검의 경우, 특히 2 cm 미만인 경우 내시경 초음파 유도하 생검보다 진단율이 높은 것으로 나타났다[75,76]. 최근에는 진단 및 치료 목적으로 내시경 점막하 박리술이나 복강경 및 내시경 협업 수술을 시행하기도 한다[41,44,53].
결 론
상피하종양 형태의 위암은 비교적 드문 형태의 위암으로, 일반적인 조직 검사를 통해서는 진단하기 어려운 경우가 많다. 발생 기전에 따라 내시경 소견이나 질병의 진행 정도가 다르지만, 비교적 오래 전부터 많이 보고된 림프구 침윤 위암이나 점액성 선암의 임상병리학적 특징을 인지하는 것이 필요하겠다. 또한 일반적인 상피하종양과의 내시경적 감별점을 숙지하고 상피하종양 형태의 위암 가능성을 사전에 인지하는 자세가 필요하다. 만약 상피하종양 형태의 위암이 의심된다면 반복적인 조직 검사와 내시경 초음파 유도하 생검, 점막 절개 생검 등을 통해서 치료 전 진단을 내리는 것이 향후 치료 방향 설정에 있어서 중요하다.
Notes
No potential conflict of interest relevant to this article was reported.