 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 21(3); 2021 > Article |
|
ņÜöņĢĮ: 29ņäĖ ļé©ņ×ÉĻ░Ć 4Ļ░£ņøöĻ░ä 7 kgņØś ņ▓┤ņżæ Ļ░ÉņåīĻ░Ć ņ׳ņ¢┤ ņŗ£Ē¢ēĒĢ£ ņ£äļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņŚÉņä£ ņØ┤ņāü ņåīĻ▓¼ņØä ļ│┤ņŚ¼ ļ│æņøÉņŚÉ ņÖöļŗż. ņ▓┤ņżæ Ļ░Éņåī ņØ┤ņÖĖņŚÉ ļŗżļźĖ ņ”ØņāüņØĆ ņŚåņŚłņ£╝ļ®░ ņĢĮļ¼╝ ļ│ĄņÜ®ļĀźņØ┤ļéś ļ│æļĀźļÅä ņŚåņŚłļŗż. ņĪ░ļČĆĻ░Ć ļīĆņןņĢöņ£╝ļĪ£ ņ¦äļŗ©ļ░øņØĆ Ļ░ĆņĪ▒ļĀźņØ┤ ņ׳ņŚłļŗż. ņ£äļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝, ļČäļ¼ĖļČĆņÖĆ ņāüļČĆ ņ▓┤ļČĆņŚÉņä£ ļ¼┤ņłśĒ׳ ļ¦ÄņØĆ ņ×æņØĆ ĒØ░ņāē ĒĢ©ļ¬░ĒśĢ ļ»Ėļ×ĆļōżņØ┤ ļ│┤ņśĆļŗż(Fig. 1A). ņ£äņŻ╝ļ”äņŚÉņä£ļŖö ļŗżļ░£ņä▒ Ēśłņä▒ ļ░śņĀÉņ£╝ļĪ£ ĻĄ¼ņä▒ļÉ£ ņĀÉņāü ļ░£ņĀü(spotty redness)ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż(Fig. 1B). ņ£äĻ░üņØś Ēøäļ▓ĮņŚÉņä£ļŖö ļ»ĖņäĖĒśłĻ┤Ć ņ”ØņŗØĻ│╝ ņØ┤ņĀä ņĪ░ņ¦ü Ļ▓Ćņé¼ļĪ£ ņØĖĒĢ£ ĒØ░ņāē ĒØēĒä░Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż(Fig. 1C). ņĀäņĀĢļČĆņŚÉņä£ļŖö ĻĘĀņØ╝ĒĢ£ ĒśłĻ┤Ćņāü(regular arrangement of collecting venules)ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż(Fig. 1D). ņ£äņ▓┤ļČĆņØś ļīĆļ¦īņĖĪĻ│╝ ņ£äĻ░üņØś Ēøäļ▓ĮņĖĪņŚÉņä£ ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż(Fig. 2). Giemsa ņŚ╝ņāēņŚÉņä£ Helicobacter pylori (H. pylori)ļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░ ņÜöņåīĒśĖĻĖ░ Ļ▓Ćņé¼ļÅä ņØīņä▒ņØ┤ņŚłļŗż. Ēśłņ▓Ł Ļ▓Ćņé¼ņŚÉņä£ ĒĢŁH. pylori immunoglobulin G (IgG) ņłśņ╣śļŖö <5 AU/mLļĪ£ ņØīņä▒, ĒÄ®ņŗ£ļģĖĻ▓É(pepsinogen, PG) I ņłśņ╣śļŖö 36.0 ng/mL, PG II ņłśņ╣śļŖö 9.5 ng/mL, PG I/II ļ╣äļŖö 3.8ļĪ£ ņĀĢņāü ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż. H. pyloriĻ░Ć ņĢäļŗī Helicobacter (non-H. pylori Helicobacter, NHPH) Ļ░ÉņŚ╝ņØä ņ¦äļŗ©ĒĢśĻĖ░ ņ£äĒĢ┤ ĻĘĀņŚ╝ĻĖ░ņä£ņŚ┤ ļČäņäØ(pyrosequencing analysis)ņØä ņŗ£Ē¢ēĒĢśņśĆļŗż(Fig. 3). ņ£äļé┤ņŗ£Ļ▓ĮņŚÉņä£ Ļ┤Ćņ░░ļÉ£ Ļ┤æļ▓öņ£äĒĢ£ ļ│æļ│ĆņØś ņ¦äļŗ©ņØĆ ļ¼┤ņŚćņØĖĻ░Ć?
ĒĢ┤ņäż: H. pylori ņØīņä▒ņ£╝ļĪ£ ņ¦äļŗ©ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņ╣©ņŖĄņĀüņØĖ Ļ▓Ćņé¼ņÖĆ ļ╣äņ╣©ņŖĄņĀüņØĖ Ļ▓Ćņé¼ņŚÉņä£ ļ¬©ļæÉ ņØīņä▒ ņåīĻ▓¼ņØä ļ│┤ņŚ¼ņĢ╝ ĒĢśļ®░, ņĀĢņāü ĒśłĻ┤ĆņāüņØ┤ ļ│┤ņØ╝ Ļ▓ĮņÜ░ņŚÉļŖö H. pylori ļ»ĖĻ░ÉņŚ╝ņ×ÉņØ╝ Ļ░ĆļŖźņä▒ņØ┤ 32.2ļ░░ ņāüņŖ╣ĒĢ£ļŗż[1]. ļ░śļīĆļĪ£ ņāüļČĆ ņ▓┤ļČĆņŚÉņä£ Ļ┤æļ▓öņ£äĒĢ£ ļ░£ņĀüņØ┤ ļ│┤ņØ╝ Ļ▓ĮņÜ░ņŚÉļŖö H. pylori Ļ░ÉņŚ╝ņ×ÉņØ╝ Ļ░ĆļŖźņä▒ņØ┤ 26.8ļ░░ ņāüņŖ╣ĒĢśļ®░, ņØ┤ļŖö ĒÖ£ļÅÖņä▒ H. pylori Ļ░ÉņŚ╝ņØä ņŗ£ņé¼ĒĢśļŖö ĒŖ╣ņ¦ĢņĀüņØĖ ņåīĻ▓¼ņ£╝ļĪ£ NHPH Ļ░ÉņŚ╝ņä▒ ņ£äņŚ╝ņŚÉņä£ ļ│┤Ļ│ĀļÉ£ ņĀüņØ┤ ņŚåļŗż[2]. Helicobacter suis ļō▒ņØś NHPH Ļ░ÉņŚ╝ņØĆ ņĪ░ĻĖ░ņ£äņĢö(early gastric cancer, EGC) ĒśĢĒā£ņØś ņĢģņä▒ ņóģņ¢æ, Ļ▓░ņĀłņä▒ ņ£äņŚ╝, ņåīĒÖöņä▒ ĻČżņ¢æ, ņ£äĻ░üņØä ņżæņŗ¼ņ£╝ļĪ£ ĒĢ£ ļīĆļ”¼ņäØ ļ¬©ņ¢æņØś Ļ▓Įļ»ĖĒĢ£ ņ£äņČĢņä▒ ņ£äņŚ╝, ņĀäņĀĢļČĆņØś ļČłĻĘĀņØ╝ĒĢ£ ļ░£ņĀüņØ┤ļéś ļ»Ėļ×Ć ļō▒ņØĆ ņ£Āļ░£ĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī H. pylori Ļ░ÉņŚ╝ņ▓śļ¤╝ Ļ┤æļ▓öņ£äĒĢ£ ļ░£ņĀüņØ┤ļéś ņŻ╝ļ”ä ļ╣äļīĆļŖö ņ£Āļ░£ĒĢśņ¦Ć ļ¬╗ĒĢ£ļŗż[3].
ņØ┤ ņ”ØļĪĆļŖö ņāüļČĆ ņ▓┤ļČĆņØś ļīĆļ¦īņĖĪņØä ņżæņŗ¼ņ£╝ļĪ£ H. pylori ĒÖ£ļÅÖņä▒ Ļ░ÉņŚ╝ņØä ņŗ£ņé¼ĒĢśļŖö ņĀÉņāü ļ░£ņĀüņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļéś ļ╣äņ╣©ņŖĄņĀüņØĖ Ļ▓Ćņé¼ņÖĆ ņ╣©ņŖĄņĀüņØĖ Ļ▓Ćņé¼ ļ¬©ļæÉņŚÉņä£ H. pylori ņØīņä▒ņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļ®░ NHPHļÅä ņ¦äļŗ©ļÉśņ¦Ć ņĢŖņØĆ ļō£ļ¼Ė Ļ▓ĮņÜ░ņØ┤ļŗż. ļ®┤ņŚŁņŚ╝ņāē Ļ▓░Ļ│╝ņŚÉņä£ CD20 ņ¢æņä▒, CK ļ”╝ĒöäņāüĒö╝ļ│æļ│Ć ņ¢æņä▒, Ki-67 3~5% ņ¢æņä▒, Bcl-2 ņ¢æņä▒, Bcl-6 ņØīņä▒, CD10 ņØīņä▒, CD3 ņØīņä▒ņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņ¢┤ H. pylori ņØīņä▒ņØĖ ņ£ä ļ¦ÉĒŖĖ ļ”╝Ēöäņóģ(mucosa-associated lymphoid tissue [MALT] lymphoma)ņ£╝ļĪ£ ņ¦äļŗ©ĒĢśņśĆļŗż. ĒśłņĢĪ Ļ▓Ćņé¼ņŚÉņä£ ņĀ¢ņé░ĒāłņłśĒÜ©ņåī(lactate dehydrogenase) ņłśņ╣śļŖö 336 IU/L (ņ░ĖĻ│Āņ╣ś 263~450 IU/L)ņśĆņ£╝ļ®░ ĒØēļČĆņÖĆ ļ│ĄļČĆ ņ╗┤Ēō©Ēä░ļŗ©ņĖĄņ┤¼ņśü(CT)ņŚÉņä£ ņ£äņØś ņóīņĖĪ ļ”╝ĒöäņĀłņØ┤ 1.5 cmļĪ£ ņĖĪņĀĢļÉśņŚłļŗż(Fig. 4A, B). ļ│æĻĖ░ļŖö Ann Arbor stage II1E, ĻĄŁņĀ£ņśłĒøäņ¦ĆĒæ£(international prognostic index, IPI)ļŖö ļé«ņØĆ IPI ņ£äĒŚśļÅäļĪ£ ĒīÉļŗ©ļÉśņŚłļŗż. Clonal IgH gene rearrangementļŖö ņŚåņŚłņ£╝ļ®░ apoptosis inhibitor 2 (API2)-MALT lymphoma-associated translation 1 (MALT1) chimera ņ£ĀņĀäņ×ÉņÖĆ ņŚ░Ļ┤ĆļÉ£ ņŚ╝ņāēņ▓┤ ņĀäņ£ä 11q21: t(11;18) (q21;q21)ļÅä ļ░£Ļ▓¼ļÉśņ¦Ć ņĢŖņĢśļŗż.
10% ļ»Ėļ¦īņØś ņ£ä ļ¦ÉĒŖĖ ļ”╝ĒöäņóģņØĆ NHPH Ļ░ÉņŚ╝ņØ┤ļéś ņŚ╝ņāēņ▓┤ ņĀäņ£ä ļśÉļŖö ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖśņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśļŖö H. pylori ņØīņä▒ ļ”╝Ēöäņóģņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ļŗż[4]. Ļ░Ćņן ĒØöĒĢ£ ņøÉņØĖņØĆ NHPH Ļ░ÉņŚ╝ņ£╝ļĪ£ ņØ╝ļČĆļŖö H. pylori ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļ░śņØæĒĢśņ¦Ćļ¦ī[5], API2-MALT1 ņ¢æņä▒ņØ┤ļ®┤ Ļ┤ĆĒĢ┤ņ£©ņØ┤ ļé«ļŗż[6]. ĻĄŁļé┤ņŚÉņä£ Ļ░Ćņן ļ¦ÄņØĆ ņ£ä ļ¦ÉĒŖĖ ļ”╝Ēöäņóģ ĒÖśņ×É 345ļ¬ģņØä ļČäņäØĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö 57.1%ņØś H. pylori ņØīņä▒ ņ£ä ļ¦ÉĒŖĖ ļ”╝ĒöäņóģņØ┤ ņĀ£ĻĘĀ ņ╣śļŻīļĪ£ Ļ┤ĆĒĢ┤ļÉśņŚłļŗż[7]. ļ®öĒāĆļČäņäØ ņŚ░ĻĄ¼ņŚÉ ņØśĒĢśļ®┤ ņĀ£ĻĘĀ ņ╣śļŻī ĒøäņØś H. pylori ņØīņä▒ ņ£ä ļ¦ÉĒŖĖ ļ”╝ĒöäņóģņØś Ļ┤ĆĒĢ┤ņ£©ņØĆ 29.3% (95% CI, 22.2~37.4%)ļĪ£[8], ĒĢ£ĻĄŁņŚÉņä£ Ļ┤ĆĒĢ┤ņ£©ņØ┤ Ļ░Ćņן ļåÆĻ│Ā ņØ╝ļ│ĖņŚÉņä£ Ļ░Ćņן ļé«ļŗż[9]. ņØ╝ļ│ĖņØ┤ ļé«ņØĆ ņØ┤ņ£ĀļŖö ņ╣©ņŖĄņĀüņØĖ Ļ▓Ćņé¼, Ēśłņ▓Ł ĒĢŁH. pylori IgG, ņÜöņåīĒśĖĻĖ░ Ļ▓Ćņé¼ļ┐Éļ¦ī ņĢäļŗłļØ╝ ļīĆļ│ĆĒĢŁņøÉ Ļ▓Ćņé¼ņÖĆ Ēśłņ▓Ł PG Ļ▓Ćņé¼Ļ╣īņ¦Ć ļ¬©ļæÉ ņØīņä▒ ņåīĻ▓¼ņØä ļ│┤ņŚ¼ņĢ╝ H. pylori ņØīņä▒ņ£╝ļĪ£ ņ¦äļŗ©ĒĢśĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż. Ēśłņ▓Ł PG I ņłśņ╣śĻ░Ć 70 ng/mL ņØ┤ĒĢśņØ┤ļ®┤ņä£ PG I/II ļ╣äĻ░Ć 3.0 ņØ┤ĒĢśļĪ£ Ēśłņ▓ŁĒĢÖņĀü ņ£äņČĢņØ┤ ļ│┤Ļ│ĀļÉśļ®┤ H. pylori ņØīņä▒ņØ┤ ņĢäļŗī Ļ│╝Ļ▒░ Ļ░ÉņŚ╝ņ×ÉļĪ£ ļČäļźśĒĢśļ»ĆļĪ£[10], ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ļŖö H. pylori ņØīņä▒ņØĖ ņóģņ¢æņØ┤ ņØ╝ļ│ĖņŚÉņä£ļŖö Ļ│╝Ļ▒░ Ļ░ÉņŚ╝ņ£╝ļĪ£ ņØĖĒĢ┤ ļ░£ņāØĒĢ£ H. pylori ņŚ░Ļ┤Ćņä▒ ņóģņ¢æņ£╝ļĪ£ ņ¦äļŗ©ļÉśļŖö Ļ▓ĮĒ¢źņØ┤ ņ׳ļŗż.
ņ£ä ļ¦ÉĒŖĖ ļ”╝ĒöäņóģņØś ļ│æĻĖ░ļŖö ņ╣śļŻīņŚÉ ļīĆĒĢ£ ļ░śņØæņØä ņśłņĖĪĒĢśļŖö ļŹ░ ņ׳ņ¢┤ņä£ ņżæņÜöĒĢśļ®░, H. pylori ņ¢æņä▒ņØĖ IEĻĖ░ļéś II1EĻĖ░ņØś ņ£ä ļ¦ÉĒŖĖ ļ”╝ĒöäņóģņØĆ ņĀ£ĻĘĀņÜöļ▓ĢņØ┤ļéś ņĀüņØĆ ņ¢æ(25.2 Gy)ņØś ļ░®ņé¼ņäĀ ņ╣śļŻīļĪ£ Ļ┤ĆĒĢ┤ļÉĀ ņłś ņ׳ļŗż[11]. ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļ░śņØæĒĢśļŖö H. pylori ņØīņä▒ ņ£ä ļ¦ÉĒŖĖ ļ”╝ĒöäņóģņØĆ ņŻ╝ļĪ£ ņ£äņØś ņøÉņ£äļČĆņŚÉņä£ ļ░£ņāØĒĢśļ®░ H. pylori Ļ░ÉņŚ╝ņä▒ ņ£ä ļ¦ÉĒŖĖ ļ”╝ĒöäņóģĻ│╝ ņ£Āņé¼ĒĢ£ ĒĢ©ļ¬░ĒśĢ ņĪ░ĻĖ░ņ£äņĢö ņ£Āņé¼ĒśĢ(EGC IIc-like type), ņĀÉļ¦ēĒĢś ņóģņ¢æĒśĢ(submucosal tumor type), ļŗżļ░£ņä▒ ļ»Ėļ×ĆĒśĢ(multiple erosion type), ņĪ░ņĢĮļÅīĒśĢ(cobblestone type), ļČĆļČäņĀüņØĖ ņŻ╝ļ”äļ╣äļīĆĒśĢ(partial giant-fold type), Ēć┤ņāēĒśĢ(discoloration type) ļō▒ņ£╝ļĪ£ Ļ┤Ćņ░░ļÉ£ļŗż[12]. ļ░śļ®┤ņŚÉ ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö H. pylori ņØīņä▒ ņ£ä ļ¦ÉĒŖĖ ļ”╝ĒöäņóģņØĆ ņŻ╝ļĪ£ ņ£äņØś ĻĘ╝ņ£äļČĆņŚÉņä£ ņāüĒö╝ĒĢś ņóģņ¢æņØ┤ļéś ņÜ®ņóģ Ļ░ÖņØĆ ņ£ĄĻĖ░ĒśĢ ļ│æļ│Ćņ£╝ļĪ£ ņ¦äļŗ©ļÉśļ®░ diffuse large B cell lymphomaņÖĆ ņ£Āņé¼ĒĢ£ ļ¬©ņ¢æņ£╝ļĪ£ ņ¦äĒ¢ēĒĢ£ļŗż[13]. ļ░®ņé¼ņäĀ ņ╣śļŻīņŚÉļÅä ļ░śņØæĒĢśņ¦Ć ņĢŖņØä ļĢīļŖö ĒĢŁņĢö ņ╣śļŻīļéś rituximabĻ│╝ Ļ░ÖņØĆ ĒĢŁCD20 ļŗ©Ēü┤ļĪĀĒĢŁņ▓┤ ļ®┤ņŚŁņÜöļ▓ĢņØä Ļ│ĀļĀżĒĢĀ ņłś ņ׳ļŗż[11].
ņØ┤ ņ”ØļĪĆļŖö API2-MALT1 ņØīņä▒Ļ│╝ Helicobacter ņØīņä▒ņØĖ II1E ļ│æĻĖ░ņØś ņ£ä ļ¦ÉĒŖĖ ļ”╝Ēöäņóģņ£╝ļĪ£ ļ░®ņé¼ņäĀ ņ╣śļŻīļź╝ ĻČīĒĢśņśĆņ£╝ļéś ļŹ£ ņ╣©ņŖĄņĀüņØĖ ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ļ░śņØæņØä ļ©╝ņĀĆ ĒÖĢņØĖĒĢśĻĖĖ ņøÉĒĢśņŚ¼ amoxicillin 1 g, clarithromycin 500 mg, lansoprazole 30 mgņØä ĒĢśļŻ© ļæÉ ļ▓ł ņØ╝ņŻ╝ņØ╝Ļ░ä Ēł¼ņŚ¼ĒĢśņśĆļŗż. ņ£äļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ņØ┤ ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļ░śņØæĒĢśļŖö ļŗżļ░£ņä▒ ļ»Ėļ×ĆĒśĢĻ│╝ Ēć┤ņāēĒśĢ ņåīĻ▓¼ņØä ļ│┤ņśĆĻ│Ā, ņĪ░ņ¦ü Ļ▓Ćņé¼ļĪ£ ņŗ£Ē¢ēĒĢ£ NHPH ņ¦äļŗ©ņØ┤ ņ£äņØīņä▒ņØ╝ Ļ░ĆļŖźņä▒ļÅä ņ׳ņ¢┤ņä£ ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļ░śņØæĒĢśĻĖĖ ĻĖ░ļīĆĒ¢łņŚłņ£╝ļéś ļæÉ ļŗ¼ ĒøäņØś ņ£äļé┤ņŗ£Ļ▓Į ņĪ░ņ¦ü Ļ▓Ćņé¼ņŚÉņä£ ņ£ä ļ¦ÉĒŖĖ ļ”╝ĒöäņóģņØ┤ ņŚ¼ņĀäĒ׳ ļ│┤Ļ│ĀļÉśņ¢┤ ņ¦Ćņ▓┤ ņŚåņØ┤ ļ░®ņé¼ņäĀ ņ╣śļŻī(30.6 Gy, 17 fractions)ļź╝ ĻČīĒĢśņśĆļŗż. ļ░®ņé¼ņäĀ ņ╣śļŻīļź╝ ļ¦łņ╣£ Ēøä 4Ļ░£ņøö ļÆżņŚÉ ņŗ£Ē¢ēĒĢ£ CT Ļ▓Ćņé¼ņŚÉņä£ ņ×æņĢäņ¦ä ļ”╝ĒöäņĀłņØ┤ ĒÖĢņØĖļÉśņŚłļŗż(Fig. 4C, D). ņ£äļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņāü ņāüļČĆ ņ▓┤ļČĆņŚÉņä£ Ļ┤Ćņ░░ļÉśļŹś ĒØ░ņāē ĒĢ©ļ¬░ĒśĢ ļ»Ėļ×ĆļōżņØĆ ņØ┤ņĀäņŚÉ ļ╣äĒĢ┤ Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░(Fig. 5A), ņ£äņŻ╝ļ”äņØś ņĀÉņāü ļ░£ņĀüņØĆ ņé¼ļØ╝ņ¦ä ņāüĒā£ņśĆļŗż(Fig. 5B). ņ£äĻ░üņØś Ēøäļ▓ĮņŚÉļŖö ņĪ░ņ¦ü Ļ▓Ćņé¼ĒĢ£ ĒØöņĀüļ¦ī ļé©ņĢäņ׳ņŚłļŗż(Fig. 5C). ņ▓śņØīņŚÉ ļ”╝ĒöäņóģņØ┤ ņ¦äļŗ©ļÉśņŚłļŹś ņ▓┤ļČĆņØś ļīĆļ¦īĻ│╝ ņ£äĻ░üņØś Ēøäļ▓ĮņŚÉņä£ ņČöņĀü ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ĒĢśņśĆņ£╝ļéś ļ¬©ļæÉ ņØīņä▒ņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż.
ņóģĒĢ®ĒĢĀ ļĢī, ņØ┤ ņ”ØļĪĆļŖö ļ╣äņ╣©ņŖĄņĀüņØĖ Ļ▓Ćņé¼(Ēśłņ▓Ł Ļ▓Ćņé¼ņÖĆ ņÜöņåīĒśĖĻĖ░ Ļ▓Ćņé¼)ņÖĆ ņ╣©ņŖĄņĀüņØĖ Ļ▓Ćņé¼(H&EņÖĆ Giemsa ņŚ╝ņāē, ĻĘĀņŚ╝ĻĖ░ņä£ņŚ┤ļČäņäØ)ņŚÉņä£ ļ¬©ļæÉ ņØīņä▒ ņåīĻ▓¼ņØä ļ│┤ņØĖ H. pylori ņØīņä▒ ņ£ä ļ¦ÉĒŖĖ ļ”╝Ēöäņóģņ£╝ļĪ£, ĒÖ£ļÅÖņä▒ H. pylori Ļ░ÉņŚ╝ņØä ņŗ£ņé¼ĒĢśļŖö ņĀÉņāü ļ░£ņĀüņØä ļ│┤ņØĖ ĒŖ╣ņØ┤ĒĢ£ ņ”ØļĪĆņØ┤ļŗż. ņ£ĪņĢłņĀüņØĖ ņåīĻ▓¼ņØĆ ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ņל ļ░śņØæĒĢśļŖö ļŗżļ░£ņä▒ ļ»Ėļ×ĆĒśĢĻ│╝ Ēć┤ņāēĒśĢņØä ļ│┤ņśĆņ£╝ļéś ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖņĢäņä£ ļ░®ņé¼ņäĀ ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢśņśĆļŗż. ņØ┤ņ▓śļ¤╝ ņ£ĪņĢłņĀüņ£╝ļĪ£ļŖö H. pylori Ļ░ÉņŚ╝ņä▒ ņ£ä ļ¦ÉĒŖĖ ļ”╝ĒöäņóģņØä ņØśņŗ¼ĒĢĀ ņłś ņ׳ļŖö ņåīĻ▓¼ņØä ļ│┤ņŚ¼ļÅä ļ░®ņé¼ņäĀ ņ╣śļŻī ĒøäņŚÉņĢ╝ Ļ┤ĆĒĢ┤ļÉ£ H. pylori ņØīņä▒ ņ£ä ļ¦ÉĒŖĖ ļ”╝ĒöäņóģņØä Ļ▓ĮĒŚśĒĢśņśĆĻĖ░ņŚÉ ļ│┤Ļ│ĀĒĢ£ļŗż.
Fig.┬Ā1.
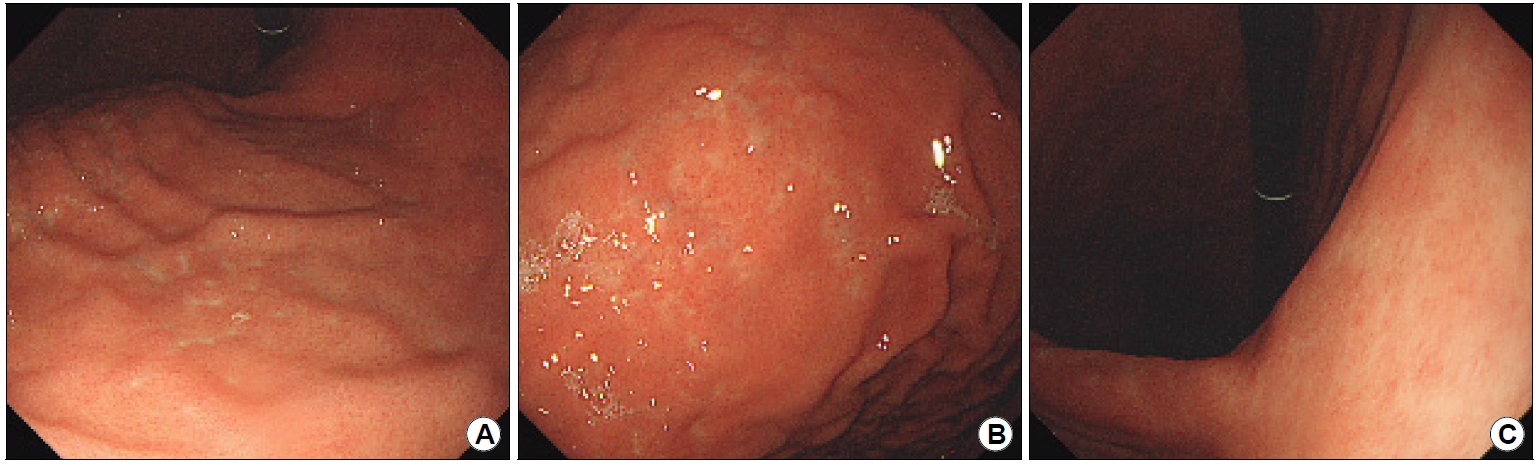
Gastroscopic findings. (A) Multiple, minute, whitish, and depressed erosions seen from the fundus to the upper body in the retroflexed view. (B) Multiple, minute hemorrhagic spots, also referred to as spotty redness, seen in the gastric rugae. Gastric biopsies were performed during the procedure. Yellow arrow indicates the biopsy sites. (C) Whitish ulcer scars and increased vasculature in the posterior aspect of the angle. Yellow arrow indicates the biopsy sites. (D) Regular arrangement of the collecting venules are observed in the antrum.

Fig.┬Ā2.
Pathology findings for the gastric biopsy specimens obtained during the initial gastroscopy. Representative images of the upper body are shown here. Similar pathology findings observed using the biopsy specimens from the angle. (A) Atypical lymphoid infiltration seen in a lymphoepithelial lesion. The findings are consistent with extranodal marginal zone B cell lymphoma of the mucosa-associated lymphoid tissue (H&E, ├Ś200). (B) Infiltrating lymphoid cells are po- sitive for CD20 which is specific for B cells (CD20 immunohistochemical stain, ├Ś200).

Fig.┬Ā3.
Findings of the pyrosequencing analysis to confirm the presence of Helicobacter pylori (H. pylori) and non-H. pylori Helicobacter. There is no evidence of the Helicobacter species in the specimens. M, marker (100 base pair [bp]); PC, positive controls showing Helicobacter at 133 bp; NC, negative control using deionized sterile water.
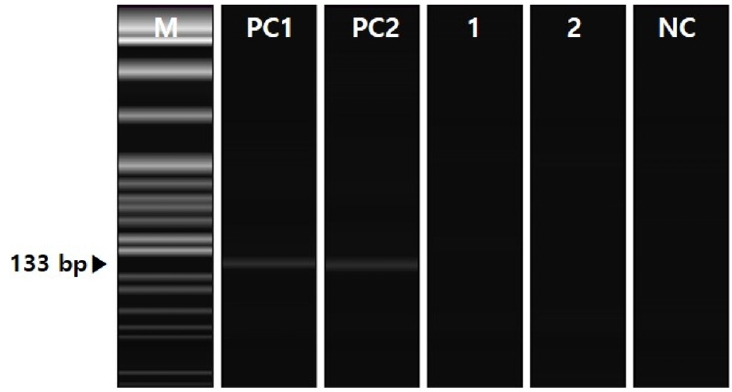
Fig.┬Ā4.
Findings of the initial and followup contrast-enhanced CT. (A) In the coronal view, a 1.5 cm sized left gastric lymph node (LN) is observed with edematous gastric wall thickening on the posterior side of the lower body. (B) In the axial view, a 1.5 cm sized left gastric LN is observed. (C) Four months after involved-site radiation therapy (ISRT) using a total dose of 30.6 Gy in 17 fractions, the enlarged LN in the coronal view is not visualized. (D) The axial view after ISRT shows a decrease in the size of the left gastric LN. There is no observable abnormality in the stomach.
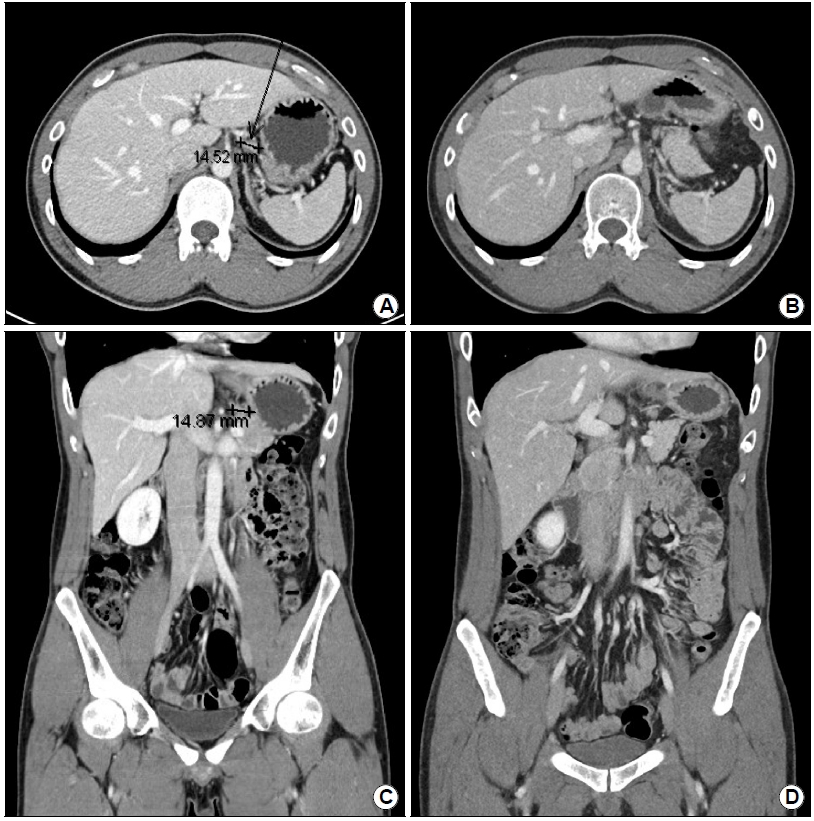
Fig.┬Ā5.
Gastroscopic images obtained after involved-site radiation therapy (ISRT). (A) Four months after ISRT, a decreased number of whitish and depressed erosions is observed in the fundus. (B) Previous lesions that extended from the greater curvature side of the upper body to the fundus are resolved. (C) On the posterior side of the angle, a previous ulcer has healed to a whitish scar.
REFERENCES
1. Yoshii S, Mabe K, Watano K, et al. Validity of endoscopic features for the diagnosis of Helicobacter pylori infection status based on the Kyoto classification of gastritis. Dig Endosc 2020;32:74ŌĆō83.


2. Tsukadaira T, Hayashi S, Matsumoto T, Ota H. Prevalence and clinicopathologica characteristics of patients with gastric disease infected with gastric non-Helicobacter pylori Helicobacter: retrospective analysis at a single institution based on 2,508 consecutive patients over a 7-year period. Jpn J Helicobacter Res 2019;21:48ŌĆō55.
3. Takigawa H, Masaki S, Naito T, et al. Helicobacter suis infection is associated with nodular gastritis-like appearance of gastric mucosa-associated lymphoid tissue lymphoma. Cancer Med 2019;8:4370ŌĆō4379.



4. Asano N, Iijima K, Koike T, Imatani A, Shimosegawa T. Helicobacter pylori-negative gastric mucosa-associated lymphoid tissue lymphomas: a review. World J Gastroenterol 2015;21:8014ŌĆō8020.



5. Takigawa H, Yuge R, Masaki S, et al. Involvement of non-Helicobacter pylori Helicobacter infections in Helicobacter pylori-negative gastric MALT lymphoma pathogenesis and efficacy of eradication therapy. Gastric Cancer 2021;24:937ŌĆō945.



6. Choi YJ, Kim N, Paik JH, et al. Characteristics of Helicobacter pylori-positive and Helicobacter pylori-negative gastric mucosa-associated lymphoid tissue lymphoma and their influence on clinical outcome. Helicobacter 2013;18:197ŌĆō205.


7. Gong EJ, Ahn JY, Jung HY, et al. Helicobacter pylori eradication therapy is effective as the initial treatment for patients with H. pylori-negative and disseminated gastric mucosa-associated lymphoid tissue lymphoma. Gut Liver 2016;10:706ŌĆō713.




8. Jung K, Kim DH, Seo HI, Gong EJ, Bang CS. Efficacy of eradication therapy in Helicobacter pylori-negative gastric mucosa-associated lymphoid tissue lymphoma: a meta-analysis. Helicobacter 2021;26:e12774.



9. Xie YL, He CY, Wei SQ, Guan WJ, Jiang Z. Clinical efficacy of the modified Helicobacter pylori eradication therapy for Helicobacter pylori-negative gastric mucosa-associated lymphoid tissue lymphoma: a meta analysis. Chin Med J (Engl) 2020;133:1337ŌĆō1346.



10. Kiso M, Yoshihara M, Ito M, et al. Characteristics of gastric cancer in negative test of serum anti-Helicobacter pylori antibody and pepsinogen test: a multicenter study. Gastric Cancer 2017;20:764ŌĆō771.



11. Schmelz R, Miehlke S, Thiede C, et al. Sequential H. pylori eradication and radiation therapy with reduced dose compared to standard dose for gastric MALT lymphoma stages IE & II1E: a prospective randomized trial. J Gastroenterol 2019;54:388ŌĆō395.



12. Tajika M, Nakamura T, Tanaka T, et al. Clinical characteristics and endoscopic findings of patients with gastric MALT lymphoma. Stomach Intestine 2014;49:603ŌĆō615.
13. Kawazoe A, Yamada Y, Doi T. Therapeutic strategy for gastric MALT lymphoma. Stomach Intestine 2014;49:616ŌĆō622.
-
METRICS

-
- 0 Crossref
- 2,641 View
- 97 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Can Helicobacter pylori Infection Reduce the Efficacy of Cancer Immunotherapy?2023 December;23(4)
The Recurrence of Helicobacter pylori Infection: Recrudescence Versus Reinfection2023 December;23(4)
Eradication of Helicobacter pylori Infection Using 7-day PCR-based Tailored Therapy2023 June;23(2)
Helicobacter pylori Infection and the Risk of Osteoporosis in Women2022 March;22(1)






