식도 및 위 질환의 인공지능 적용
Artificial Intelligence in the Analysis of Upper Gastrointestinal Disorders
Article information
Trans Abstract
In the past, conventional machine learning was applied to analyze tabulated medical data while deep learning was applied to study afflictions such as gastrointestinal disorders. Neural networks were used to detect, classify, and delineate various images of lesions because the local feature selection and optimization of the deep learning model enabled accurate image analysis. With the accumulation of medical records, the evolution of computational power and graphics processing units, and the widespread use of open-source libraries in large-scale machine learning processes, medical artificial intelligence (AI) is overcoming its limitations. While early studies prioritized the automatic diagnosis of cancer or pre-cancerous lesions, the current expanded scope of AI includes benign lesions, quality control, and machine learning analysis of big data. However, the limited commercialization of medical AI and the need to justify its application in each field of research are restricting factors. Modeling assumes that observations follow certain statistical rules, and external validation checks whether assumption is correct or generalizable. Therefore, unused data are essential in the training or internal testing process to validate the performance of the established AI models. This article summarizes the studies on the application of AI models in upper gastrointestinal disorders. The current limitations and the perspectives on future development have also been discussed.
서 론
누구나 인공지능을 사용할 수 있는 시대이다. 또한 누구나 인공지능을 필요에 의해 만들어 사용할 수 있는 시대가 다가오고 있다. 본 종설은 빠르게 발전하고 있는 인공지능의 의학분야 적용에 대한 내용을 정리하고자 기존에 저자가 제시한 상부위장관 소화기학 분야의 인공지능 적용에 대한 종설에[1-3] 최근에 발표된 위장관 내시경 인공지능에 대한 내용을 추가하고자 한다. 또한 인공지능 모델을 개발하거나 개발과정에 참여할 때 의료인으로서 염두에 두어야 할 내용을 기술하고자 한다.
본 론
1. 상부위장관 소화기학 분야의 인공지능 적용사례
미국 소화기내시경학회(American Society of Gastrointestinal Endoscopy)에서는 2020년 10월 위장관 내시경 인공지능 모델의 개발을 위한 position statement를 발표하였고, 3가지 요소의 향상이 이루어져야 임상에 사용 가능한 인공지능 모델이라고 발표하였다[4]. 이는 임상적인 지표의 향상(augment clinical performance), 치료계획의 향상(establish better treatment plans), 또는 환자 치료지표의 향상(improve patient outcomes)이다[4]. 이외에도 반복적이고 많은 시간을 소모하는 단순업무처리에 인공지능을 사용하여 의료인 고유의 의학술기를 수행할 수 있는 시간을 확보하여 업무 효율성을 높일 수 있는 방식으로 인공지능이 적용되어야 한다고 기술하였다[4]. 이미 영상의학 분야에서는 영상판독에 판독자의 음성을 인식(speech recognition)하여 판독 레포트를 자동으로 작성하는 인공지능 모델이 적용되어 왔으며 위장관 내시경 판독기록 작성에 적용이 가능하다. 또한 내시경 검사는 검사자가 갖고 있는 지식이나 술기 능력에 따라 육안진단이나 조직 검사의 정확도(accuracy)가 달라질 수 있는 특성이 있으며 학습(training)에 따라 이를 향상시킬 수 있지만 오랜 시간이 필요한 한계도 있어 인공지능 모델의 적용이 이를 보완할 수 있는지 연구가 되었다.
대부분의 초기 위장관분야 인공지능 모델 개발 연구들이 컴퓨터 비전(computer vision)을 주제로 하고 있으며 이는 병변을 자동으로 발견하거나 경계를 구별해주고 병변의 사진을 인공지능 모델에 입력하는 형태로 제시하면 정답을 예측하는 판별모델(discriminative model) 방식이다(Fig. 1) [4]. 대표적으로 position statement에서 제시한 예로는 육안으로 정확히 발견하기 어려운 암 전구 병변(pre-cancerous lesion)이나 암 자체를 발견하는 모델이며 바렛식도(Barrett’s esophagus)에서 신생물의 발생을 내시경 사진에서 발견하거나 위암 또는 그 전구 병변을 내시경 사진이나 영상에서 발견(detection)하고 진단 또는 분류(classification, categorization)하는 방식이다. 이와 같은 인공지능 모델이 필요한 당위성은 실제 내시경 검사 도중 실시간으로 병변으로 의심되는 부위를 검사자에게 알려주면 이 부위를 집중하여 조직 검사 또는 절제술을 시행하는 것이 환자의 예후에 영향을 미칠 것으로 예측되기 때문이다[4]. Position statement에서 추천하는 인공지능 학습용 데이터는 상부위장관 내시경 사진인데 백색광 내시경(white-light imaging) 이외에도 narrow-band imaging, blue-light imaging, i-SCAN, linked color imaging과 같은 영상 강조 내시경(image-enhanced endoscopy) 사진과 색소 내시경(chromoendoscopy), 확대 내시경(magnification endoscopy) 사진 등이며, 각 해당 병변의 조직학적 진단이 이루어진 사진을 다루도록 권고하고 있다. 병변의 자동 발견을 예시로 들었지만, 이는 병변의 발견이 인공지능 모델에 의해 이루어진 후 각 병변을 자동 진단 및 분류하는 것을 염두해두고 있기 때문에 학습 데이터는 범주형(category) 자료로 예를 들고 있다(예시: 1. gastritis; 2. gastric atrophy; 3. intestinal metaplasia; 4. gastric dysplasia; 5. adenocarcinoma) [4].

Representative task of computer vision in upper gastrointestinal endoscopy. The classification task signifies the differentiation of input data into certain categories. Detection is a task where a green box is generated when the previously trained image is seen in the new image (localization). Semantic segmentation accurately identifies the boundary of the learned image without predicting a bounding box and can blur the background or distinguish the boundary. M, mucosa; SM, submucosa.
1) 식도암 및 식도 신생물의 내시경 인공지능 적용사례
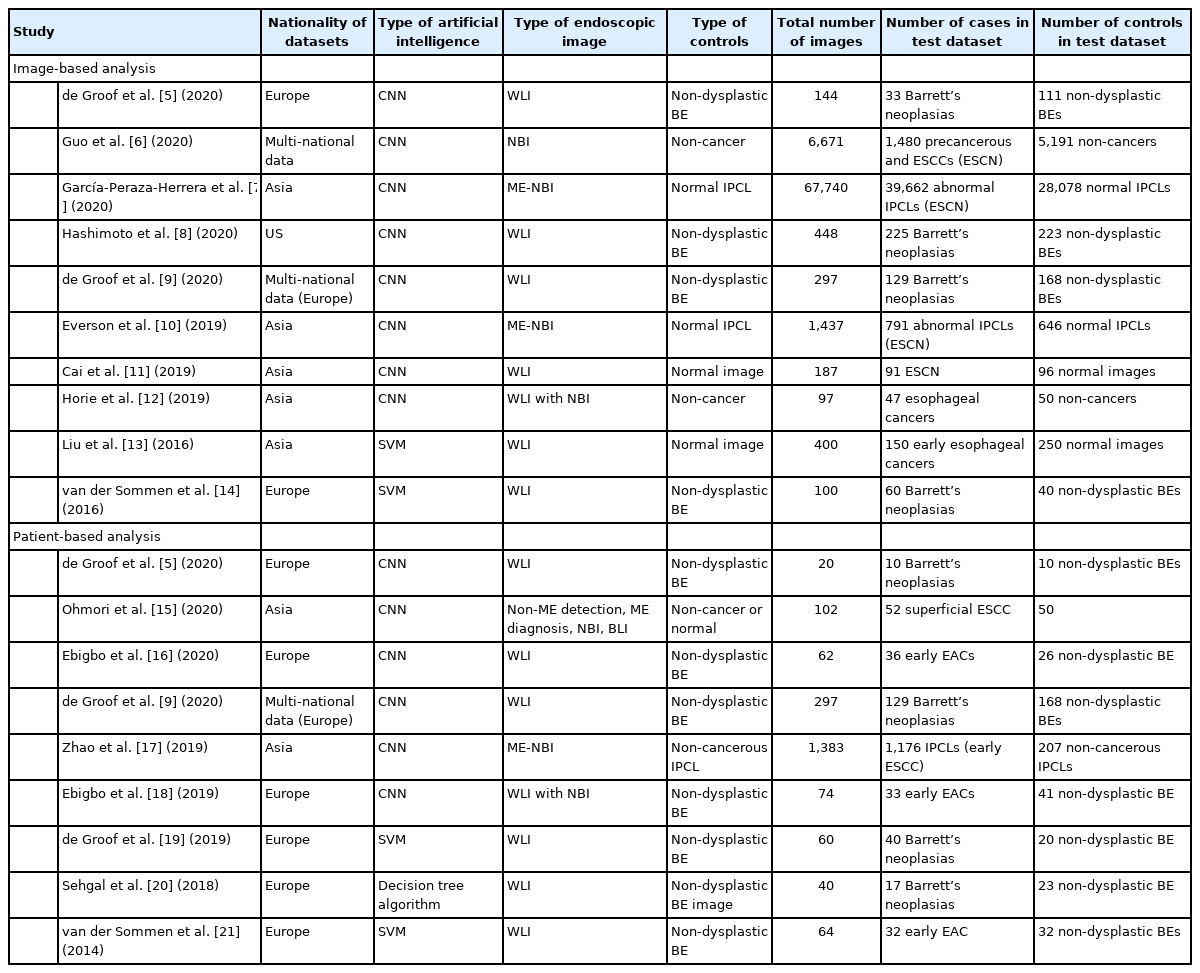
상기 이론적인 배경을 바탕으로 현재까지 개발된 식도암이나 신생물에 대한 인공지능 모델은 신생물이나 암 자체를 발견하거나 비 신생물과 분류하여 진단하는 방식이 대표적이다(Table 1) [5-21]. 식도암이나 신생물의 경우 상부위장관 내시경 검사 도중 우연히 발견되거나 진단되는 경우가 대부분이고, 식도의 타액이나 점액, 정상 연동운동, 환자의 심장박동 및 생리적 협소부위를 고려하면 천천히 내시경을 회수하면서 면밀히 관찰하는 것이 중요하다[22]. 색소 내시경이 상기 제한점을 보완할 수 있지만 이를 모든 환자에게 적용하는 것은 불가능하며, 영상 강조 내시경이 대안이 될 수 있지만 경험이 부족한 의사가 사용할 경우 민감도(sensitivity)가 떨어지는 한계가 있다[12,23]. 미국 소화기내시경학회는 식도에서 영상 강조 내시경이 고등급 선종(high-grade dysplasia) 또는 표재성 식도암(superficial esophageal cancer) 등의 병변에 대한 조직 검사를 대체할 수 있는 광학적 진단(optical diagnosis)을 하려면 진단 수치인 preservation and incorporation of valuable endoscopic innovations (PIVI) performance thresholds를 만족해야 한다고 제시하였는데, 환자당 분석으로 병변을 발견하는 민감도가 90%, 특이도(specificity)가 80%, 음성예측도(negative predictive value)가 98%를 넘어야 한다[24]. 저자가 수행한 체계적 문헌고찰 및 진단 메타분석(systematic review and diagnostic test accuracy meta-analysis)에서는 인공지능 모델이 식도암이나 신생물을 진단하는 민감도, 특이도, 음성예측도가 환자별 분석에서 각각 93%, 85%, 91%로 계산되었다(Table 1) [22]. 현재의 인공지능 모델은 백색광 내시경이나 영상 강조 내시경에 관계없이 또는 편평세포암(squamous cell carcinoma)이나 선암(adenocarcinoma)에 관계없이 식도암을 구별하는 데 높은 정확도를 보여주었다[22]. 전체적으로 민감도와 특이도의 경우 PIVI 역치를 만족하지만 음성예측도는 낮은 수치를 보였는데, 영상 강조 내시경 역시 아직 상기 수치를 만족하지 못하지만 인공지능 모델의 기능적인 발전을 고려하면 향후 발표될 추가적인 연구들의 결과가 기대된다. 또한 전체적인 모델의 성능이 내부검증 자료이기 때문에 일반화가 어렵고 상용화를 고려한다면 전향적인 외부검증이 필요하다(모델이 일반화되는지 알 수 있는 방법은 새로운 데이터에 적용해 보는 것이며 외부검증에서 성능이 낮다면 이는 모델이 학습 데이터에 과대적합[overfitting]되었다는 것을 의미한다).
2) 위암 및 위 신생물의 내시경 인공지능 적용사례
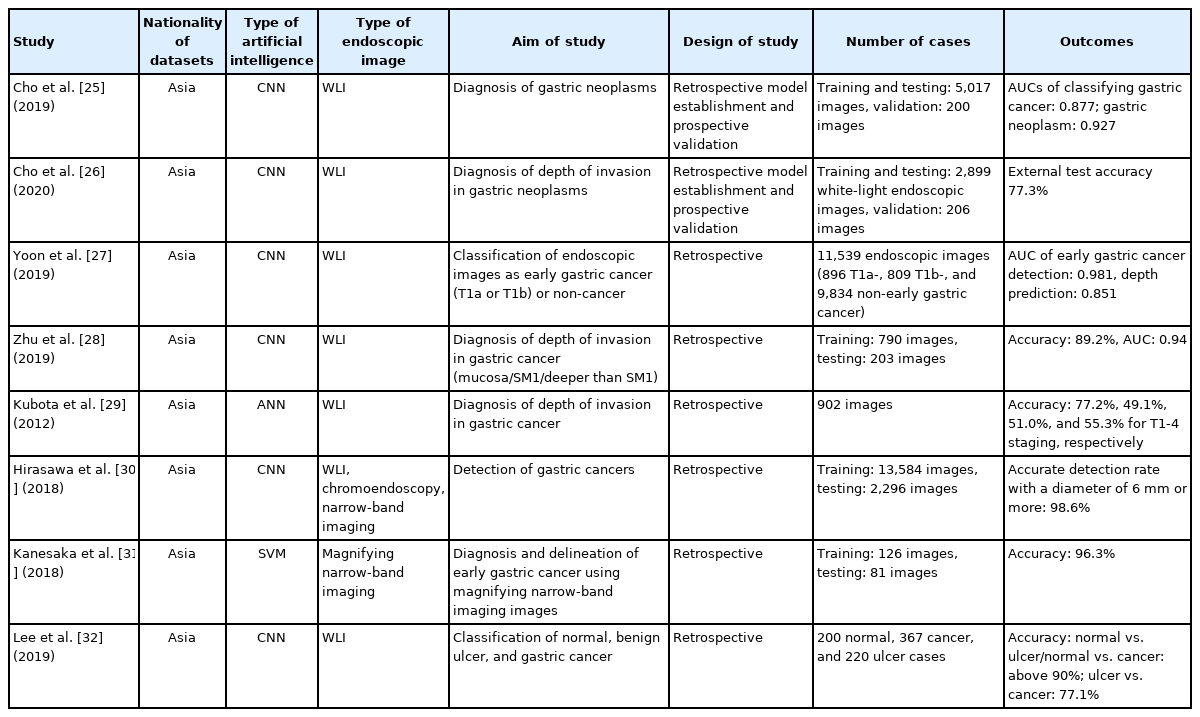
두 번째로 위암이나 위 신생물의 경우 상부위장관 내시경 검사 도중 육안 소견으로 병변을 의심하고 조직 검사용 겸자(biopsy forcep)를 이용한 병리학적 분석을 통해 일차 진단이 이루어진다. 하지만 육안 소견과 병리 검사가 일치하는 비율은 다양하며, 조직 검사를 통한 일차 진단과 수술 및 내시경 절제술을 통한 치료 후 최종 병리 소견의 불일치 비율 또한 병변의 상태와 모양에 따라 다양하게 보고되고 있다. 또한 내시경 검사 도중 병변을 발견하지 못하고 놓칠 경우 환자의 예후에 직접 영향을 미치게 된다. 진단 이외에도 위 신생물의 치료방침을 결정하기 위해서는 위벽 침윤 깊이를 예측해야 한다. 이는 주로 의사의 육안 소견과 내시경 초음파(endoscopic ultrasound) 등의 검사를 통해 판단하는데, 위 신생물이 점막내에 국한되었거나 점막 하 침윤 깊이가 500 μm 이하인 경우에만 내시경 절제시술의 대상이 된다. 하지만 육안 소견의 정확도는 개인에 따라 차이가 크고 내시경 절제술 이후에 점막하 침윤이 깊은 암으로 최종 판단되는 경우 추가적인 위 절제 수술이 필요하여 위 신생물의 위벽 침윤 깊이 판단에 미충족 의료요구가 있는 실정이다. 현재까지 개발된 위 신생물 및 위암에 대한 인공지능 모델의 경우위 신생물 자체를 비 신생물과 (또는 위암을 분류) 분류하여 진 단하는 모델과[25] 조기위암의 침윤 깊이를 진단하여 내시경 치료의 대상이 될 가능성이 있는지 확인하는 모델이 개발되었다[26-29]. 또한 위암의 발견과[30,31] 범위를 지정하는 연구[31] 및 궤양형 병변 중에서 위암을 구별하는 연구에[32] 인공지능 모델이 활용되었으며, 합성곱 신경망(convolutional neural network)을 이용한 딥러닝(deep learning) 학습법 또는 support vector machine 방식의 머신러닝(machine learning) 모델이 적용이 되었다(Table 2). 소화기 내시경분야에서 인공지능 모델이 가장 활발히 개발되어 있는 대장 용종(colon polyp)의 발견이나 진단 분야와 비교해서 위암이나 위 신생물의 경우 주변 점막의 염증의 정도나 암종의 조직학적 분화도 또는 임상 병기에 따라 다양한 외형을 보이기 때문에 인공지능 모델의 개발이 상대적으로 어렵다.
이전 저자의 연구에서 상부위장관 내시경 사진을 자동으로 진행성 위암(advanced gastric cancer), 조기위암(early gastric cancer), 고등급 및 저등급 선종(high-grade or low-grade dysplasia), 양성 병변(non-neoplasm)의 5단계로 분류하는 인공지능 모델을 생성하였다[25]. 이는 사진에서 자동으로 병변의 조직학적 진단을 제시함으로써 시술자에게 조직학적 진단의 필요성과 치료적 계획을 세우도록 이차 의견을 제시하는 역할을 수행할 수 있다. 인공지능 모델이 5가지 병변을 구별하는 평균 내부시험(internal-test) 정확도는 84.6%였고 외부시험(external-test) 정확도는 76.4%였다[25]. 위 신생물의 침윤 깊이의 경우 인공지능 모델이 점막내 국한된 병변과 점막하 이상을 침범한 병변을 구별하는 외부시험 정확도가 77.3%였다[26]. 후향적인 임상 simulation에서 인공지능 모델을 사용하여 위 신생물에 대한 수술적 치료와 내시경 절제술을 결정한다고 가정할 경우 일부 임상적인 지표의 향상이 있음을 보고하였지만 실제 임상에 적용하기에는 정확도가 다소 낮은 제한점이 있었다. 이를 보완하기 위해 인공지능 모델의 생성시 하이퍼 변수(hyperparameter)를 자동으로 최적화해주고 복잡한 코딩이 없이도 단순한 drag & drop 방식이나 사용자 인터페이스(user interface)의 버튼을 누르는 방식으로 인공지능 모델을 생성하는 no-code platform을 이용한 연구를 수행하였다[33]. 이전에 사용하였던 같은 학습용 사진을 이용하여 위 신생물의 침윤 깊이를 판단하는 인공지능 모델을 생성하였고 외부시험 정확도가 89.3%로 기존 모델의 77.3%에 비해 향상되었다[33]. 모델의 생성 시간 역시 수개월에서 수주 또는 수일내로 단축되었다. 현재는 향상된 성능의 일반화가 가능한지 확인하기 위해 전국 다기관 연구로 성능에 대한 외부검증이 이루어지고 있다.
인공지능 모델이 정확한 답을 제시한다고 가정하더라도 실제 임상 현장에서 내시경 검사를 시행하는 의사는 어떤 반응을 나타낼 지 알 수 없다. 이를 확인하기 위해 내시경 의사의 숙련도에 따라 소화기 내시경 전문의, 전임의, 수련의로 분류하여 각각 200여 장의 위 신생물 사진에 대한 침윤 깊이를 예측하는 연구를 하였다[33]. 총 3회의 시험을 하였는데, 첫 번째는 인공지능 모델의 도움 없이 스스로 정답을 예측하게 하였고, 두 번째는 정확도가 50% 밖에 되지 않는 부정확한 인공지능 모델의 답을 생성하여 시험자에게 알려주고 답안의 변화가 있는지 확인하였다. 세 번째는 본 연구에서 생성된 외부시험 정확도가 89.3%인 인공지능 모델의 답을 알려주고 시험자의 답안에 변화가 있는지 확인하였다. 위 신생물의 침윤 깊이를 예측하는 정확도는 소화기 내시경 전문의, 전임의, 수련의 순으로 높았으며, 총 3회의 시험 중 내시경 전문의의 정확도는 인공지능 모델의 정답에 관계없이 통계학적 차이가 없는 일정한 정확도를 유지하였다. 하지만 전임의와 수련의는 부정확한 인공지능 모델의 정답을 확인하고 침윤 깊이 예측 정확도가 감소하였고, 정확도가 높은 인공지능 모델의 정답을 확인한 후 예측 정확도가 상승하는 현상을 보였다. 예측 정확도의 상승 정도는 전임의에서 수련의에 비해 더욱 높아서 소화기 내시경 사진 판별 인공지능 모델의 경우 숙련도 중 또는 하의 내시경 의사가 가장 큰 이득을 얻을 수 있을 것으로 추측하였다[33].
3) 기타 최신 내시경 인공지능 적용사례
최근에 해당 분야에 출판된 연구로는 내시경 절제의 대상이 되는 조기위암 병변의 indigo carmine 색소 내시경과 백색광 내시경 사진으로 암의 경계(절제면 경계; resection margin)를 인공지능 모델에 학습시키고 확대 내시경과 narrow-band imaging 사진으로 분류능력을 시험하는 연구이다[34]. 내부시험 정확도는 색소 내시경 사진으로 학습시킨 인공지능 모델의 경우 85.7%, 백색광 내시경 사진으로 학습시킨 인공지능 모델의 경우 88.9%였다. 내부시험에서 전문가에 의해 수행된 병변과 절제면 marking의 최소거리는 3.32±2.32 mm였고, 인공지능 모델에 의해 수행된 병변과 절제면 marking의 최소거리는 3.40±1.49 mm로 통계적인 차이는 없다고 보고하였다. 또한 확대 내시경과 narrow-band imaging을 이용해서 조기위암의 분화도(differentiation)를 예측하는 인공지능 모델에 대한 연구가 발표되었다[35]. 내부시험 정확도가 83.3%였고 5명의 전문가와 인공지능 모델을 비교시험하였을 때 인공지능 모델이 통계학적으로 더 조기위암의 분화도를 잘 구별하는 것으로 발표되었다(정확도; 86.2%, vs. 69.7%). 진행성 위암의 경우 복막전이(peritoneal metastasis)가 때때로 진단이 되지만 수술적인 치료 전에는 이를 완벽히 예측하기가 어렵다. 수술 전 전산화단층촬영(CT) 사진을 학습하여 복막전이(occult peritoneal metastasis)를 예측하는 인공지능 모델이 발표되었고 외부시험에서 민감도 87.5%, 특이도 98.2%의 성적을 발표하였다[36].
의학 인공지능 모델의 생성 후에 의사와 인공지능 모델의 진단 성적을 비교하는 연구(man-machine contest)가 다수 출판되었다[25]. 연구 결과 대부분 인공지능 모델이 의사들에 비해 더 높은 성능을 보이거나 통계학적으로 차이가 없는 정도의 성능을 보여주었다[22]. 각 연구 주제에 따라 비슷한 연구 결과들이 축적되면서 인공지능 모델이 잘 분류할 수 있는 분야에 대한 성능을 사람과 비교하는 것은 의미가 퇴색되고 있긴 하지만, 소화기 내시경 의사들의 진단 성적을 일률적으로 수치화하는 것도 어려운 것이 사실이다. 최근 의사와 인공지능 모델의 진단 성적을 비교하는 연구들을 체계적 문헌고찰을 통해 정리하고 분석하여 의사들의 상부위장관 신생물에 대한 분류 정확도, 민감도, 특이도 등을 제시한 연구가 출판되었다[37]. 상부위장관의 특정 분야에서 인공지능 모델의 생성을 염두에 두고 있다면 해당 연구의 결과를 참조하여 인공지능 모델의 성능 목표치를 제시하는 것도 고려해 볼만 하다.
2. 향후 발전 방향과 한계점
최근에는 암이나 암 전구 병변, 신생물 이외에도 양성 병변(benign lesions)의 진단에 인공지능이 적용되는 예가 발표되고 있다. 식도와 위의 정맥류(esophageal or gastric varices)의 경우 출혈(bleeding) 소견이 있는 경우 환자의 예후와 직접적인 연관이 있는데, 이를 자동으로 발견하고 크기, 형태, 색조, 출혈 가능성을 분석하는 인공지능 모델이 발표되었다[38]. 이 모델은 정맥류를 발견하는 정확도가 의사보다 높았고, 출혈의 위험 요소들을 판단하는 정확도는 의사와 비슷하다고 보고하였다[38]. 상부위장관 내시경 사진에서 헬리코박터 파일로리(Helicobacter pylori, H. pylori) 감염을 진단하는 인공지능 모델이 개발되었다. 8개의 개별 연구에 대한 진단 메타분석에서는 인공지능 모델이 H. pylori 감염을 내시경 사진에서 진단하는 민감도, 특이도가 환자별 분석에서 각각 87%, 86%로 계산되었다(Table 3) [39]. 일반적인 상부위장관 내시경 이외에도 캡슐 내시경(wireless capsule endoscopy)을 이용하여 위 내의 궤양(ulcer), 용종, 출혈과 식도염(esophagitis) 등을 진단하는 인공지능 모델이 발표되었고 내부시험 정확도는 96.5%였다[40]. Magnetically controlled capsule endoscopy과 faster region-based convolutional neural network을 이용하여 위 내의 미란(erosion), 궤양, 용종, 점막하 종양(submucosal tumor), 황색종(xanthoma), 정상점막(normal mucosa) 등을 진단하는 인공지능 모델도 발표되었고 내부시험 정확도는 77.1%였다[41].

Summary of Studies Using Artificial Intelligence in the Diagnosis of Helicobacter pylori (H. pylori) Infections in Endoscopic Images
전체적으로 위장관 내시경 영상기술의 발전으로 병변의 표면구조 모양이나 혈관구조를 확대해서 확인하는 기술이 가능하기 때문에 인공지능 모델이 학습할 만한 특성(feature)을 더 많이 가진 영상 강조 내시경 사진이나 영상을 이용한 인공지능 모델 개발이 지속적으로 시도되리라 생각한다.
업무의 효율성이나 질을 향상시키는 연구들은 내시경 검사 도중 맹점(blind spot)을 모니터링해주는 인공지능 모델 개발을 예로 들 수 있다. Wu 등[42]은 상부위장관 내시경 검사 도중 실시간으로 맹점을 모니터링해주는 인공지능 모델을 개발하여 무작위 대조군 연구를 통해 검사에 사용할 경우 맹점을 줄일 수 있음을 발표하였다. 또한 같은 연구그룹에서 의식하 진정 내시경에 인공지능 모델을 사용했을 경우 비 진정 상태의 검사보다 맹점을 더욱 줄일 수 있음을 발표하였다[43]. 최근에는 다기관 무작위 대조 연구를 통해 실제 진료에 인공지능 모델을 사용하였을 때 맹점을 줄이고 신생물도 높은 정확도로 진단할 수 있음을 확인하였다(병변당 정확도 84.69%, 민감도: 100%, 특이도: 84.29%) [44]. 국내에서도 유럽 소화기내시경학회(European Society of Gastrointestinal Endoscopy)에서 제시한 8장의 표준 상부위장관 내시경 촬영 부위를 gold standard로 정하고, 이 8장의 사진을 자동으로 분류하여 이를 모두 촬영하였으면 내시경 검사가 충실히 시행된 것으로 판단하는 인공지능 모델을 개발하였다. 8장의 표준 사진을 분류하는 내부시험 정확도는 97.58%였고 검사가 충실히 시행되었는지 확인하는 내부시험 정확도는 89.2%였다[45].
사진이나 영상 이외에 빅데이터를 기반으로 분석하여 위암의 발생 가능성이나 치료 지표를 예측하는 연구들이 발표되었다. 나이와 성별, 혈액검사, 암표지자 등을 조합하여 위암의 발생을 예측하는 연구가 발표되었다[46]. 이런 예측모델을 생성하는 것은 기존에도 통계학적인 모델링을 통해 시행되어 왔으나 본 연구에서는 머신러닝 분석기법 중 gradient boosting decision tree를 이용하여 모델을 생성하였고 내부시험 정확도가 83%로 보고되었다. 미분화형 위암(early gastric cancer with undifferentiated histology)의 경우 내시경 절제 전에 치료적 절제(curative resection)를 예측하기 어려운 경우가 많은데 국내의 다기관 데이터를 이용하여 미분화형 위암의 치료적 절제를 예측하는 모델이 발표되었다[47]. 환자의 나이, 성별, 병변의 크기, 위치, 궤양 동반 유무 등을 바탕으로 예측모델이 생성되었고 extreme gradient boosting 분류모델의 경우 내부시험 정확도가 93.4%, 외부시험 정확도가 89.8%로 보고되었다.
결국에는 생성적 적대 신경망(generative adversarial network), diffusion model과 같은 생성모델(generative model)이 인공지능 모델이 수행할 수 있고 사람이 일반적으로 생각하지 못한 창의적인 업무를 수행하게 될 가능성이 높다. 향후 딥러닝에서 특징적으로 성능 향상을 보이는 앙상블기법(ensemble, 단일 모델 대신 여러 모델의 출력값을 평균하여 결과를 도출)이나 지식 증류(knowledge distillation, 작은 모델[student model]로도 큰 모델[teacher model]과 비슷한 성능을 낼 수 있도록 학습), 자가 증류(self-distillation, 별도의 teacher model 없이 스스로 distillation을 수행) 등에 대한 추가 연구를 통해 수리적인 방식으로 딥러닝의 작동방식을 좀 더 깊이 이해할 수 있으리라 기대된다.
3. 인공지능 모델을 개발 시 고려할 점
실제 임상에 존재하는 영상이나 환자 데이터는 질병이나 예후를 시사하는 소견을 포함하고 있지만 노이즈가 가득한 정제되지 않은 데이터이다. 또한 질병상태 또는 이상 병변보다는 정상 소견이 절대적으로 많은 의학데이터의 특성을 고려할 때 인공지능이 주로 학습하기를 기대하는 소견은 전체 데이터 중에서 소량인 경우가 많다. 인공지능 모델 개발을 원하는 데이터가 가진 특성에 따라 어떤 방식의 인공지능 모델을 적용해야 하는지 다를 수 있으며 실제 사용을 위해서는 모델 배포(model deployment)까지도 고려해야 한다. 또한 현재는 대부분의 연구자들이 특정 인공지능 모델의 성능을 높이려는 작업에 집중하고 있지만, 인공지능 모델의 생성에 사용된 데이터에 대한 분석으로 초점을 바꿀 필요가 있다. 즉 데이터 중심의 인공지능 개발인데, 어떤 재료로 학습하는지에 따라 모델의 성능과 그 사용방식이 달라진다. 의학 데이터의 특성상 실제 임상현장에서 사용할 수 있으려면 분류의 대상이 되는 특징이 충분히 존재하는 학습 데이터를 구축해야 한다. 학습 데이터를 어떤 방식으로 레이블링(labeling)하는지에 따라 실제 사용 시에 유용성이 달라질 수 있다. 기술적인 방식으로 모델의 성능을 향상시키는 것도 중요하지만 데이터가 갖고 있는 특성을 이해하고 데이터의 분포나 질에 따른 성능의 변화에 초점을 맞추어 현실에 사용하기에 가장 적합한 데이터를 가공하는 것이 중요하다.
결 론
딥러닝을 이용하여 내시경 영상이나 사진을 바탕으로 암이나 그 전구 병변인 신생물의 자동발견, 진단 및 병변의 경계를 확인하는 컴퓨터 비전 분석법은 높은 정확도를 보이고 있다. 하지만 전향적인 외부 검증 연구가 부족하고 임상적인 이득이 있는지 확인하는 연구가 부족하다. 개발된 대부분의 딥러닝 모델들은 연구 목적으로 생성되어 실용성이 떨어지는 단점이 있지만 최근에는 실제 내시경 의사의 검사를 방해하지 않으면서 원활하게 정보를 제공하는 딥러닝 모델의 개발이 이루어지고 있다. 내시경 영상 분석은 검사 도중 실시간으로 분석이 필요하기 때문에 모델의 경량화 및 전용 모듈이 필요한데 이에 대한 연구가 증가하리라 생각된다. 영상 강조 내시경 및 확대 내시경 기법 등 위장관 내시경 영상의 질 또한 향상되고 있기 때문에 이에 따라 개발되는 딥러닝 모델의 수준 또한 향상될 가능성이 높다. 향후에는 임상 의사결정지원 시스템(clinical decision support system)의 일부로서 이런 영상 분석 딥러닝 모델이 확장되어 사용되리라 예측된다.
Notes
No potential conflict of interest relevant to this article was reported.