장형 위암과 선종
Intestinal Type Gastric Cancer and Gastric Adenoma
Article information
Trans Abstract
Gastric adenoma (dysplasia) is a precursor for gastric cancer and is closely associated with intestinal type gastric cancer. Thus, accurate diagnosis and proper management of gastric adenoma are extremely critical for preventing gastric cancer. The revised Vienna and World Health Organization classifications have categorized gastric adenomas into two types: high-grade and low-grade dysplasia. High-grade dysplasia requires endoscopic resection due to synchronous carcinoma or the high risk of progression to carcinoma. Although the treatment for low-grade dysplasia remains controversial, endoscopic resection is also recommended due to the potential of progression to carcinomas and the unrevealed histologic discrepancies between forceps biopsy and endoscopic specimens. According to the Lauren classification, gastric cancer is categorized into three histologic types: intestinal, diffuse, and mixed types. Intestinal and diffuse types show a distinct difference in their clinical and epidemiological features. The intestinal type, in its pathogenesis, follows the cascade of non-atrophic gastritis, atrophic gastritis, intestinal metaplasia, adenoma, and intramucosal neoplasia (correa cascade). It tends to appear in older ages than diffuse type and show some predominance in the distal portion of the stomach. It is more common in males and is often associated with environmental factors. In this review, the current knowledge of gastric adenoma and intestinal type gastric cancer, together with relevant diagnostic and therapeutic strategies, is discussed.
서 론
위암은 한국과 일본, 중국 등 동아시아 국가에서 발생 빈도가 특히 높고, 세계에서 6번째로 발병률이 높은 암이다[1]. 위암을 분류하는 기준은 다양하지만, World Health Organization (WHO) 분류, Japanese 분류, Lauren’s 분류가 가장 널리 쓰이고 있다. WHO 분류에 따르면 papillary adenocarcinoma, tubular adenocarcinoma, mucinous adenocarcinoma, poorly cohesive carcinoma, including signet ring cell carcinoma and other variants 등으로 나뉘며[2], Japanese 분류에 따라서는 differentiated type, undifferentiated type으로 나뉜다[3]. Lauren [4]은 1965년에 glandular growth pattern에 따라 장형 위암(intestinal type)과 미만형 위암(diffuse type)으로 나눈 Lauren’s 분류를 발표하였다. 대략적으로 WHO 분류의 papillary, tubular, mucinous adenocarcinoma와 Japanese 분류의 differentiated type이 Lauren’s 분류의 장형 위암에 해당되고, WHO 분류의 poorly cohesive carcinoma와 Japanese 분류의 undifferentiated type이 Lauren’s 분류의 미만형 위암에 해당된다.
위선종(gastric adenoma) 혹은 위이형성(gastric dysplasia)은 위암의 전구 병변이기 때문에, 위선종 혹은 위이형성의 진단 및 적절한 치료는 위암의 발생의 예방에 대단히 중요하다[5]. 위선종과 위이형성은 비슷한 의미로 현재 임상에서는 혼용하여 사용하고 있다. 본고에서는 혼용을 줄이고자 저도 이형성 선종(gastric adenoma with low grade dysplasia), 고도 이형성 선종(gastric adenoma with high grade dysplasia)으로 통일하여 명칭하고자 한다.
본고에서는 발생 과정에서 밀접하게 연관되는 이형성 선종과 장형 위암에 관련하여 실제 임상 진료에 도움이 될 만한 부분에 초점을 맞추어 살펴보고자 한다.
본 론
1. 이형성 선종
1) 이형성 선종의 정의와 분류법
실제 임상에서는 위선종과 위이형성을 혼용하여 사용하고 있다. 그러나 엄밀하게 위선종은 위축성 위염과 같은 염증과 관련 없이 발생한 양성 신생물(tubular or villous structure lined by dysplastic epithelium)인 반면에, 위이형성은 주변 위 점막의 염증과 관련이 있는 양성 신생물이라고 볼 수 있다[6].
이형성 선종의 분류에는 대표적으로 WHO 분류, Vienna 분류, Japanese 분류가 있다(Table 1) [2,3,7-9]. 특히 조기위암과 고도 이형성 선종의 분류에 있어 서양 및 일본 병리학자들 사이에는 이견이 있다. 서양 병리학자들은 점막 고유층 침범 여부에 따라 암을 진단하는 반면, 일본 병리학자들은 점막 고유층 침범 여부와 관련 없이 세포학적 구조의 변화에 따라 암을 진단하였다[10]. 일본 병리학자들의 기준의 단점은 invasive mucosal cancer와 noninvasive mucosal cancer의 구분이 모호하다는 점과 dysplasia라는 용어를 포함하지 않는 점이었다. 서양 병리학자들의 기준의 단점은 noninvasive carcinoma와 점막하층 침범(submucosal invasion)이 없는 mucosal cancer에 대한 개념이 포함되지 않았다는 점이었다[9]. 이에 대한 혼돈을 줄이고자 WHO 분류법과 수정된 Vienna 분류법을 발표하였다[2,7,8]. 이 분류법에 따르면 저도 이형성 선종과 고도 이형성 선종은 모두 noninvasive로 분류되고, 저도 이형성 선종은 수정된 Vienna 분류법 category 3, 고도 이형성 선종은 수정된 Vienna 분류법 category 4에 각각 해당된다(Table 1).
2) 이형성 선종의 임상적 특징과 치료법
이형성 선종의 유병률은 위암이 호발하는 동아시아지역에서는 약 10% 정도로 보고되고 있으며 위암과 유사하게 남성에서 더 호발하며 발생연령은 위암보다 10세가량 어려 약 61.3세 정도로 알려져 있다[8]. 이형성 선종은 위 전정부(antrum)에서 가장 많이 발생하고 대부분 건강검진에서 우연히 발견된다[11].
고도 이형성 선종은 암으로 진행될 가능성이 높다. 여러 연구에 의하면 4~48개월의 추적 관찰 기간 동안 고도 이형성 선종의 60~85%가 암으로 진행되었다고 보고하였다[12-14]. 저도 이형성 선종 역시 암으로 진행될 가능성이 있으나 고도 이형성 선종에 비해 낮다고 알려져 있다. 저도 이형성 선종의 자연 경과는 아직 확실치 않지만 암으로 진행될 가능성은 10% 미만으로 낮은 것으로 알려져 있다[14,15]. 또한 저도 이형성 선종의 일부는 추적 관찰 중 자연적으로 소실되기도 한다고 보고한 연구도 있다[16]. 이형성 선종이 있을 경우 위 내에 다른 부위에 동시성 암(synchronous carcinoma)이 있을 가능성이 높기 때문에 내시경 관찰 시 이형성 선종 이외에 다른 병변이 있는지 더욱 주의가 필요하다[17,18].
고도 이형성 선종은 여러 가이드라인에서 조기위암에 준하여 내시경 절제 등의 적극적인 치료를 권장하고 있다[7,11,19]. 따라서 고도 이형성 선종은 가능하면 조기위암에 준하여 내시경 점막하 박리술(endoscopic submucosal dissection, ESD)이 가장 효과적인 치료라고 할 수 있다. ESD가 어려울 경우, 고식적 내시경 점막 절제술(endoscopic mucosal resection, EMR) 혹은 여러 변형된 점막 절제술(EMR with circumferential precutting, cap-assisted EMR, ligation-assisted EMR) 등의 방법을 사용할 수 있다. ESD는 내시경점막하박리술에 비해 천공, 출혈 등과 같은 합병증이 적고 시술 시간이 훨씬 짧다는 장점이 있다. 하지만 ESD는 내시경점막하박리술에 비해 병변의 일괄 및 완전 절제율이 낮은 중요한 단점이 있다. 또한 절제해야 하는 병변 크기가 2 cm 이상이거나 병변의 위치에 따라서 불완전 절제가 많아서 국소 재발률이 높다는 단점이 있다[20-24]. 따라서 고도 이형성 선종의 경우에는 가능하면 내시경점막하박리술을 시행하여야 한다.
반면, 저도 이형성 선종의 치료는 아직까지는 다소 이견이 있다. 병변의 크기가 1~2 cm 미만으로 작은 편평 저도 이형성 선종의 경우에는 아르곤 플라즈마 응고술을 시도해 볼 수 있다. 아르곤 플라즈마 응고술은 시술이 비교적 간단하고 시술자의 숙련도가 크게 중요하지 않다는 장점이 있지만, 선종 전체의 조직 검사 결과를 확인할 수 없고 국소 재발률이 높은 것은 중요한 단점이다. 또한 선종의 진단에 있어 생검 겸자(biopsy forceps)를 이용한 조직 검사와 내시경 절제술 시행 이후 최종 조직 검사 결과 간의 불일치가 비교적 높은 것으로 보고되었다. 근래 한 메타분석에 따르면 생검 겸자를 이용한 조직 검사에서 저도 이형성 선종으로 진단되어 내시경 절제를 받은 환자들 중, 약 25%의 환자에서는 조기위암이나 고도 이형성 선종으로 진단되었다[25]. 따라서 저도 이형성 선종의 경우에도, 생검 겸자의 조직학적 불일치가 비교적 많은 점을 고려하면 선종의 치료 목적뿐만 아니라 진단적 목적, 즉 ‘total biopsy’ 측면에서도 내시경 절제술을 시행함이 좋겠다. 또한 생검 겸자에서 저도 이형성 선종으로 진단되었더라도 내시경 절제 이후 고도 이형성 선종이나 조기위암으로 진단될 가능성이 높은 병변(크기가 2 cm 이상, 함몰이 동반된 경우, 점막 표면이 거칠거나 붉은색으로 보이는 경우, 자발적 출혈이 있는 경우)은 완전 절제를 위해 내시경 점막 절제술보다는 내시경점막하박리술을 시행함이 나을 것으로 판단된다(Fig. 1).
2. 장형 위암
1) 장형 위암의 발생기전
장형 위암은 미만형 위암에 비해 헬리코박터 파일로리 감염이 발생에 밀접한 관련이 있다고 알려져 있다. 아직 명확하지는 않지만 장형 위암은 일반적으로 correa cascade (non-atrophic gastritis-atrophic gastritis-IM-dysplasia-cancer)라고 불리는 다단계 형태형성(multistep morphogenesis)에 따라 발생한다고 알려져 있다[26]. 헬리코박터 파일로리 감염 등으로 인하여 위 상피세포의 여러 유전자 변이(genomic error)를 일으켜 비정상적인 분화(abnormal differentiation)와 성장(growth), 자멸(apoptosis) 등이 유발되고 이로 인해 위축성 위염, 장상피화생, 이형성 선종, 암으로 연결된다는 가설이다. 이러한 부분에서 operative link on gastritis assessment system은 위축성 위염과 장상피화생과 장형 위암 발생의 위험 예측과 임상적 추적 관찰의 기준을 제시하기도 하였다[26,27]. 특히 헬리코박터 파일로리 감염은 위 점막의 위축을 유발하고, 이로 인한 저산성(hypoacidity)과 고가스트린혈증(hypergastrinemia)을 통해 장형 위암을 유발한다고 알려져 있다. 따라서 장형 위암에서는 위축성 위염과 장상피화생이 동반되는 경우가 미만형 위암보다 높다. 같은 맥락으로 위축성 위염과 무위산증(achlorhydria)은 장형 위암 발생의 중요한 중간 과정이라고 알려져 있다. 위축성 위염과 무위산증은 위 내에서 세균이나 진균(bacteria or fungi)이 집락형성(colonization)하기 좋은 환경이 되고 이는 발암물질(carcinogen)을 생산하고 장형 위암 발생의 원인이 되기도 하며 이러한 위내 환경에서 추가적인 고염분(high salt)섭취는 미생물(microorganism)의 발암 잠재력(carcinogenic potency)을 증가시킬 수도 있다고 보고되었다[26]. 장형 위암의 발생기전을 Fig. 2에 정리하였다.
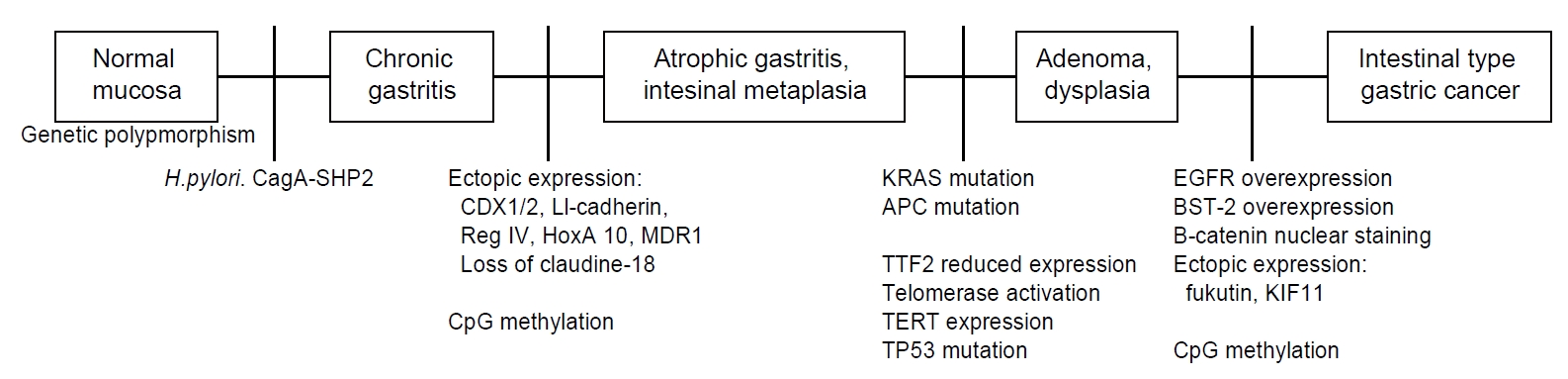
An overview of the pathogenesis and molecular alternation in intestinal type gastric cancer is presented. H. pylori, Helicobacter pylori; CDX, caudal type homeobox; LI, live-intestine; Reg, regenerating gene; HoxA, homeobox A; MDR, multi-drug resistance 1; CpG, cytosine-guanine; KRAS, kirsten rat sarcoma viral oncogene homolog; APC, adenomatous polyposis coli; TTF, thyroid transcription factor; TERT, telomerase reverse transcriptase; TP, tumor protein; EGFR, epidermal growth factor receptor; BST, bone marrow stromal cell antigen; KIF, kinesin family
2) 장형 위암의 임상적 특징
장형 위암은 미만형 위암에 비해 비교적 평균연령이 높고 위 전정부와 위각부에 호발하며 남성에서 더 유병률이 높다. 위암이 전반적으로 남성에서 약 2배가량 호발하는데 이는 장형 위암이 남성에서 호발하는 것과 연관이 있다. 육안적으로 장형 위암은 돌출형의 경계가 구분되는 종양(exophytic, demarcated mass)으로 관찰되는 경우가 많다. 전체적으로 위암 발생은 전세계적으로 감소하는 추세인데 이는 장형 위암 발생이 감소하는 것과 관련이 깊다[28-30]. 이러한 현상은 식습관의 변화와 위암 호발 국가에서 헬리코박터 파일로리 감염률 감소와 관련이 있다. 미만형 위암은 유전적인 요인(genetic factor)과 연관이 깊은 반면 장형 위암은 환경적인 요인(environmental factor)과 연관이 더 깊다. 한편, 같은 T stage라도 장형 위암은 미만형 위암에 비해 림프절 전이 위험도가 낮다고 보고하고 있으며[31,32] 이러한 차이로 인해 일부 연구에서는 장형 위암보다 미만형 위암에서는 림프절 절제의 범위를 넓히는 것을 주장하기도 하였다[33]. 하지만 근래 위암에서 분자생물학적인 연구가 많은 발전을 이루어 위암 치료 및 예후에 영향을 미치고 있는 만큼 Lauren’s 분류만으로 치료 방침을 결정하는 것은 아직 그 근거가 부족한 실정이다.
3) 최근 위암의 분자 생물학적인 분류
차세대 분석 방법이 발달함에 따라 위암에서도 장형, 미만형외에도 분자생물학적 분석방법이 중요하게 되었다. 근래에는 The Cancer Genome Atlas (TCGA)와 Asian Cancer Research group (ACRG)은 위암을 분자 생물학적인 분류에 따라 비교적 간략하게 4그룹으로 나누는 것을 제안하였다. 두 그룹의 분류법 모두 향후 위암의 맞춤 치료(tailored therapy)의 초석이 되는 중요한 연구들이다. TCGA 분류법에 따르면, Ebstein-Barr virus, microsatellite instability (MSI), genomically stable, chromosomal instability로 4그룹으로 나누었다[34]. ACRG 분류법에 따르면 크게 MSI와 microsatellite stability (MSS) 그룹으로 나누고 MSS는 다시 epithelial-mesenchymal transition (EMT), tumor protein 53 (TP53) 양성, TP53 음성 세 그룹으로 나누었다[35]. 이 분류는 각 그룹마다 분자 생물학적인 차이가 있을 뿐 아니라 예후에도 유의미한 차이가 있다고 알려져 있다. MSI 그룹이 생존율이 제일 높고 암 재발률이 가장 낮으며 EMT 그룹이 생존율이 제일 낮고 암 재발률이 가장 높다고 보고하고 있다.
결 론
이형성 선종과 장형 위암은 발생 과정에서 밀접한 관련이 있다. 고도 이형성 선종은 조기위암에 준하여 내시경점막하박리술과 같은 적극적인 내시경적 치료가 필요하다. 저도 이형성 선종도 진단 및 치료 목적으로 내시경적 절제를 시행하는 것이 고려된다. Lauren’s 분류는 비교적 오래 전에 만들어졌지만, 장형 위암과 미만형 위암은 역학적, 임상적, 분자유전학적으로도 확연한 차이를 보이기 때문에 아직까지 널리 사용되고 있다. 장형 위암은 전형적으로 correa cascade의 다단계 형태형성에 따라 발생한다고 알려져 있고 미만형 위암에 비해 남성, 위 원위부에서 호발하며 발생 연령이 더 높다. 전반적으로 미만형 위암에 비해 림프절 전이가 낮고, 재발율이 낮아 예후가 좀 더 양호하다고 알려져 있다. 장형 위암과 미만형 위암의 차이를 Table 2에 정리하였다. 또한 근래에는 TCGA, ACRG의 분류법과 같이 분자 생물학적인 차이에 따라 위암의 병태생리에 대하여 연구가 더욱 활발히 진행되고 있으며 이러한 발전은 위암의 맞춤 치료시대로 가는 초석이 되고 있다.
Notes
No potential conflict of interest relevant to this article was reported.



