양성 식도 협착
Benign Esophageal Stricture
Article information
Trans Abstract
Benign esophageal strictures, characterized by fibrotic narrowing of the esophageal lumen, are frequently encountered in clinical practice. Benign esophageal strictures are associated with a multifactorial etiology and may occur across various age and population groups. Common causes of benign esophageal strictures include gastroesophageal reflux disease (peptic stricture), esophageal injury secondary to surgery (anastomotic strictures), radiotherapy, caustic agent ingestion, or endoscopic resection. Benign esophageal strictures are categorized into simple and complex types based on their size, area involved, surface features, extent of luminal narrowing, and margins. Esophageal strictures often present clinically with dysphagia and may lead to severe complications. Regardless of the underlying cause, therapy is aimed at relief of dysphagia and prevention of stricture recurrence. Benign esophageal strictures are commonly treated using endoscopic balloon or bougie dilation, followed by disease-specific approaches to treat underlying inflammation. However, based on the underlying cause, the risk of recurrence of benign esophageal strictures is 10~30%. Therapeutic options for refractory or recurrent esophageal strictures include endoscopic incisional therapy, esophageal stent placement, or intralesional injection of steroids or mitomycin C. The pathophysiology of esophageal strictures is complicated, and thorough understanding and patient cooperation are important for optimal management. Physicians should familiarize themselves with the various dilation strategies available and their application for management of specific types of stenotic lesions. In this article, we review the evaluation and management of patients with esophageal strictures.
서 론
식도는 인두에서 위를 연결하는 약 25 cm 길이의 근육관(muscular tube)으로, 자율신경계의 조절 하에 이루어지는 연동 운동에 의해 구강에서 인두에 들어온 음식물을 위로 전달해 주는 역할을 한다. 식도는 윤상 연골(cricoid cart ilage), 흉부 입구(thoracic inlet), 횡경막(diaphragm)을 기준으로 경부(cervical), 흉부(thoracic), 복부(abdominal) 식도로 나누어지며 약 30 mm 정도의 관강 직경을 가지고 있지만 생리적 협착부(physiologic stricture)라고 불리는 상부식도 괄약근, 대동맥궁(aortic arch)과 주 기관지(main bronchus) 교차 부위, 횡격막을 관통하는 부위인 횡격막의 식도 열공(esophageal hiatus) 부위는 정상적으로도 관강이 좁아 이물질이 걸리기도 한다[1].
식도 협착(esophageal stricture)은 관강이 병적으로 좁아져 삼킴곤란과 같은 증상을 일으키는 경우로 식도 내부 및 외부의 다양한 질환에 의해 발생할 수 있다[1,2]. 하지만 좁은 의미의 식도 협착은 식도에 염증의 증거 없이 반흔이나 섬유화에 의한 해부학적 제한(anatomic restriction)으로 정의된다[3]. 식도 협착은 원인 질환과 환자의 식습관에 따라 차이가 있지만 관강의 직경이 13 mm 이하로 좁아지는 경우 삼킴곤란, 연하통, 가슴 통증, 체중 감소와 같은 증상을 발생시키고 환자는 충분한 영양을 공급받을 수 없게 되어 신속한 진단과 치료를 필요로 하는 질환이다. 식도 협착은 문진, 내시경 및 영상 검사를 통해 쉽게 진단은 가능하지만 다양한 치료법에도 재발성 및 난치성인 경우가 많아 치료가 쉽지 않다. 본고에서는 식도 협착 중 양성 식도 협착의 원인 및 치료법에 대하여 알아보고자 한다.
본 론
1. 식도 협착의 원인
식도 협착은 다양한 양성 및 악성 질환에 의해 발생 가능하고, 양성 질환에 의한 식도 협착은 소화성 궤양 협착(peptic stricture), 부식성 협착(caustic stricture), 수술 후 문합부 협착, 약제 및 방사선 조사에 의한 협착, 호산구성 식도염 등이 중요한 발생 원인이다(Table 1) [2]. 서양의 경우 위식도 역류 질환에 의한 소화성 궤양 협착과 수술 후 문합부 협착이 흔한 원인이지만, 국내의 경우 부식성 협착, 수술 후 문합부 협착 등이 주요 발생 원인이다. 최근 식도 종양에 대한 내시경 치료의 증가로 시술과 연관된 협착도 점차 증가되고 있다.
소화성 궤양 협착은 위식도 역류 질환에 의해 발생하며 국내의 경우 발생 빈도가 높지 않지만 서양에서는 식도 협착의 가장 흔한 원인이다(Fig. 1A) [4,5]. 위식도 역류에 의해 발생한 미란성 식도염(erosive esophagitis)이 심한 경우 식도 하부에 2~7% 환자에서 궤양이 형성되고 궤양이 관강 전체를 침범하면 4~20% 환자에서는 소화성 궤양 협착이 발생할 수 있다[6]. 소화성 궤양 협착은 위식도 역류와 관련되어 주로 식도 편평상피와 위 원주상피의 경계부(squamocolumnar junction) 또는 그 직상방 식도 원위부에 발생한다. 환형의 전체 식도 점막에서 염증이 발생하여 점막하층까지 진행, 섬유화되어 반흔 조직을 형성하면 식도 협착과 함께 단축을 초래한다. 소화성 궤양 협착 환자는 초기에는 고형식에 대한 삼킴곤란을 주로 호소하지만 점차 진행하면 역류 증상은 사라지고 유동식까지 삼킴곤란이 발생한다. 국내 환자들의 경우 서양에 비하여 심한 미란성 식도염의 비율이 적고 양성자펌프억제제 등의 사용으로 식도 협착의 발생 비율은 상대적으로 적다.

Representative images of benign esophageal strictures. (A) Peptic stricture: luminal fibrosis and dilatation accompanied by a short-segment stricture (arrow) at the distal esophagus. (B) Multifocal strictures (arrows) are observed with luminal dilatation between the strictures.(C) Anastomotic stricture: a focal stricture (arrow) measuring approximately 3~4 mm in diameter is observed at the anastomotic site.
부식성 협착의 경우 발생 빈도가 감소하였으나 여전히 국내에서 식도 협착의 가장 흔한 원인 중의 하나이다(Fig. 1B). 양잿물, 빙초산과 같은 강알칼리 또는 강산의 부식성 물질(caustic agent) 섭취에 의해 발생하며, 식도벽의 궤사가 광범위하고 심할수록 협착의 발생 가능성이 높다. 강알칼리는 조직 단백과의 결합으로 인한 액화 괴사를 통해 식도벽 바깥으로 종격동을 향해 급격한 손상을 일으키게 되는데 조직액에 의해 중화될 때까지 지속된다. 또한 강알칼리는 표면 장력이 강하므로 더 오랜 시간 동안 조직에 머물게 되어 응고 괴사를 일으키는 강산에 비해 손상이 더 심하게 일어난다[7]. 부식성 손상의 정도 파악을 위해 내시경 검사는 부식성 물질을 삼킴 후 24시간 이내에 시행하는 것이 추천된다. 그러나 혈역학적으로 불안정한 환자, 천공이 의심되는 환자, 심한 호흡부전 환자, 극심한 인후두의 부종이나 괴사가 있는 환자 등에서 시행은 금기이다. 부식성 식도염 환자의 내시경 검사 결과는 손상의 정도에 따라 1991년 Zargar 등[8]이 제안한 방식으로 분류한다. Grade 0은 정상 점막인 경우, grade 1은 점막의 부종 및 약간의 발적만 있는 경우, grade 2A는 표면적인 궤양, 출혈, 삼출물 등이 있는 경우, grade 2B는 깊은 국소적 혹은 윤상 궤양의 경우, grade 3A는 국소적 괴사의 경우, grade 3B는 광범위한 괴사의 경우 등을 의미한다. Grade 1, 2A의 경우 합병증 발생이 적어 특별한 치료가 필요 없고, grade 2B 이상의 경우부터 입원 치료가 필요하며, grade 3B의 경우 80% 환자에서 협착이 발생한다[7]. 부식성 협착은 부식성 물질 삼킴 후 3주에서부터 길게는 1년까지 평균 2개월 안에 발생하고 식도의 전분절을 침범하고 협착이 다발성으로 길고 불규칙한 협착을 형성한다. 부식성 손상에 의한 오랜 협착은 전암성 병변으로 내시경을 통한 정기적인 관찰을 시행해야 한다[9].
수술 후 문합부 협착은 문합부 누출, 출혈, 궤양, 빈약한 혈관신생 및 기구 또는 수동봉합 시 위장관 거상에 의한 문합부 허혈이 주요한 원인으로 수술 후 1~2개월에서 수년 후까지도 발생 가능하지만 수술 후 4개월 이내에서 발생 빈도가 가장 높은 것으로 보고되고 있다(Fig. 1C) [4]. 우리나라에서는 위암, 식도암 수술이 대부분의 원인이며 수술에서 자동 문합기(stapler)를 널리 사용함으로 그 빈도가 증가하고 있고 문합기의 직경이 작을수록 호발하는 것으로 알려져 있다.
최근 내시경 기기의 발전으로 표재성 식도 종양의 발견이 증가되고 이에 대한 내시경 치료의 빈도 또한 증가되고 있다. 내시경 점막하 박리술을 포함한 내시경 치료는 좁은 식도 내강의 특성상 원주형(circumferential) 내시경 절제술을 시행할 경우 88~100%에서 협착이 발생하는 것으로 보고되고 있고, 이전 연구를 통해 시술에 의한 점막 결손이 관강의 75%를 넘는 경우가 식도 협착 발생의 주요 위험 요인으로 확인되었다[10].
삼킴곤란과 식도 내의 호산구 침착을 특징으로 하는 만성 면역/항원 매개 식도 질환인 호산구성 식도염은 진단이 늦어질 경우 식도 협착의 빈도가 증가하여 내시경 상에 부종, 다발성 원형 주름(circular rings), 선상의 골(linear furrows), 백색의 삼출물(white exudate) 등의 특징적인 소견이나 원인이 명확하지 않은 협착 및 삼킴곤란을 호소하는 환자에서 조직 검사를 시행하여 감별하는 것이 중요하다[11].
2. 식도 협착의 진단 및 분류
식도 협착은 대부분의 경우 환자가 호소하는 증상의 특징, 가슴쓰림, 산역류, 구토 및 연하통과 같은 동반 증상, 복용하는 약물, 수술 및 내시경 치료나 부식성 손상의 병력, 알레르기 질환 등에 대한 문진을 통한 진단과 원인 질환의 감별이 대부분 가능하다[1]. 원인 질환에 따라 차이는 있지만 경도의 협착을 동반한 대부분의 환자들은 특별한 증상을 호소하지 않고 협착이 상당히 진행된 경우에 삼킴곤란을 포함한 증상이 나타난다. 삼킴곤란과 식도 관강 직경의 관계를 연구한 Schatzki [12]는 1963년도 그의 연구에서 모든 13 mm 이하의 식도 협착은 증상은 동반하고 25 mm 이상은 무증상, 13~25 mm의 경우 식습관에 따라 증상이 발생할 수 있다고 하였다.
하지만 식도 협착의 정도, 원인 질환 감별 및 치료 결정을 위해서는 상부위장관 내시경, 식도조영술 등의 검사가 필요하고 환자에 따라 전산화단층촬영, 내시경 초음파 등이 도움이 될 수 있다. 이 중 상부위장관 내시경 검사는 협착이 진행하여 내시경 기계가 통과되지 않는 경우를 제외하면 협착의 위치, 길이, 관강 직경, 협착과 동반된 식도륜(ring), 부종, 선상의 골, 궤양을 관찰하고 조직 검사가 가능하여 식도 협착을 확인하고 악성 질환 및 원인 질환을 감별하는 데 가장 중요한 검사이다[13]. 식도조영술은 식도 협착의 진단에서 95%의 높은 민감도를 보이고 협착의 위치, 길이, 직경, 범위 등을 확인 가능하며 특히 내시경 기계가 통과되지 못하거나 소구경 내시경 검사의 이용이 불가능한 경우 유용한 검사법이다. 내시경 초음파의 경우 식도 협착의 진단을 위해 사용되는 경우는 적지만 협착 부위 두께를 측정하고 가장 두꺼운 협착 부위를 확인하여 약물 주입술 시 효과적인 약물 주입 위치를 결정하는 데 도움이 될 수 있다[14].
식도 협착은 상부위장관 내시경 및 식도조영술에서 확인된 협착의 길이, 직경, 연관된 부위, 점막 표면, 경계면에 따라 일반적으로 단순(simple) 또는 복합(complex) 협착으로 분류된다[15]. 단순 협착의 경우 보통 길이가 2 cm 미만이고, 곧고, 내시경이 쉽게 통과할 수 있고, 소화성 궤양 협착, Schatzki ring, 식도 웹(esophageal web) 등이 해당한다. 치료에 잘 반응하여 3~5회의 확장술에 의해 증상 호전이 가능하다. 이에 반해 복합 협착의 경우 길이가 2 cm 이상이고, 표면이 매끄럽지 못하며, 경계면은 뒤틀리고, 협착된 내강이 상대적으로 더 좁아 내시경 통과가 어려운 경우가 많아 추가 평가를 위해 식도조영술 또는 소구경 내시경을 위한 검사가 필요하다. 내시경 치료 및 수술 후 문합부 협착, 부식성 협착, 방사선 치료 유발 협착이 이에 해당하고 치료에 불응성 및 재발하는 경우가 많다.
3. 식도 협착의 치료
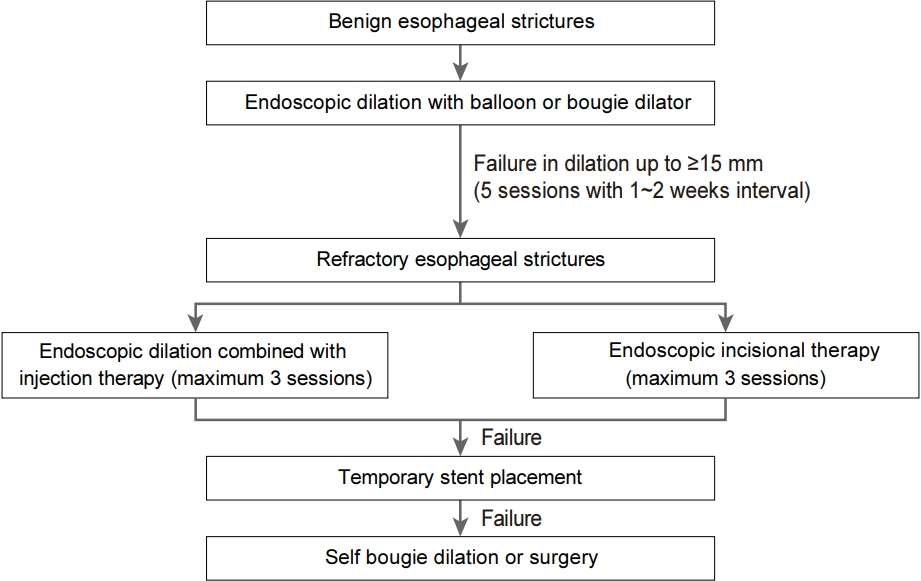
식도 협착이 진단되면 가능한 신속히 협착에 대한 치료를 시작해서 환자의 식이가 가능하게 해야 한다. 또한 소화성 궤양 협착에 대해 확장술을 시행한 후 협착의 재발을 예방하기 위해 양성자펌프억제제를 지속적으로 투여하는 것처럼 원인 질환에 대한 치료를 병행하는 것이 중요하다[16]. 먼저 악성 또는 양성을 구분하고 가능한 치료 방법의 장단점과 치료 성적을 분석하여 방침을 결정한다. 양성 협착의 치료는 비수술적 치료가 대부분을 차지하고 있으며, 부우지 확장술(bougie dilation), 풍선 확장술(balloon dilation), 침형 절개도를 이용한 내시경적 절개술, 일시적 스텐트 삽입술, 협착부의 약물 주사 등이 있으며 이 중 부우지 확장술, 풍선 확장술 등이 일차적으로 사용된다(Fig. 2).
부우지 확장술은 이전에는 많이 사용되었지만 고가의 비용으로 여러 환자에서 반복적으로 사용해야 하는 단점과 부우지 확장술에 대한 경험 있는 의사가 많지 않아 사용 빈도가 줄어들고 있다. 부우지 확장술은 협착 부위에 종축과 횡축 두 방향으로 힘을 가하게 되며 근위부에서 원위부 순서로 협착을 확장하게 된다. 수은 부우지(Maloney, Hurst), 폴리비닐 부우지(Savary-Gilliard), 금속올리브 부우지(Eder-Puestow) 등이 있으며, Savary-Gilliard (Cook Medical, Winston-Salem, NC, USA) 확장기는 유도선을 넣을 수 있는 반투명의 폴리비닐로서 방사선 비투과성이고 잘 휘지 않아 가장 많이 이용된다. 부우지 확장술 방법은 협착의 정도를 확인하고 협착 부위와 같은 직경의 확장기를 이용하여 유도선 삽입 후 유도선을 따라 확장기를 삽입하여 협착 부위를 서서히 3~5회 통과시킨다. 확장기의 직경을 단계적으로 올려가며 시술하며 확장 시 삽입하였던 확장기에서 혈흔이 묻어 있으면 충분한 확장으로 간접 평가할 수 있다. 확장술에서 자주 인용되는 “rule of t hree” 원칙은 1981년 Tulman과 Boyce [17]에 의해 제창되었으며 이는 확장기를 삽입할 때 저항이 느껴지면 확장기를 3개까지만 큰 것으로 바꾸어 시도하고 그 이상은 하지 않는 것이다. 하지만 Tulman의 rule of t hree는 최근 약 1,400여 건의 확장술을 가지고 시행한 연구에서 rule of three를 지키기 않아도 천공을 포함한 합병증의 위험성은 증가되지 않는 것이 확인되었다[18]. 수술 후 식도 협착을 포함한 양성 식도 협착에서 부우지 확장술의 성공률은 78~100%로 우수하지만 풍선 확장술과 비교하여 6.7%의 높은 천공률로 부우지 확장술 시 주의가 필요하다[19].
풍선 확장술은 1981년 London 등[20]이 최초로 식도 협착에 대하여 시행하였고 풍선이 접촉하는 협착 부위에 대해 방사상으로 동일한 힘을 가하여 그 부위를 신전시키거나 찢어지게 하여 협착을 완화시킨다. 내시경 직시 하에 시술하는 장점이 있어 최근 일차적으로 선호되는 방법이다. 풍선 확장기는 두 가지 종류로 나눌 수 있는데 하나는 내시경의 겸자공을 통해 확장기가 직접 들어가는 through-the-scope (TTS) 확장기와 유도선(guidewire)을 이용하는 over-the-guidewire 확장기가 있다. 압력에 따라 풍선 직경이 변화하는 controlled radial expansion (CRE) 풍선 확장기는 TTS 확장기로 풍선 확장술에서 가장 많이 이용되고 6~8 mm에서 18~20 mm까지 협착의 직경에 맞추어 다양한 풍선 확장기의 선택이 가능하고 하나의 확장기로 3차례 다른 크기의 확장술이 가능하다[21]. 협착부 직경에 따른 첫 풍선 확장의 직경은 시술자의 경험에 의존하지만 일반적으로 2~4 mm이면 10 mm, 5~9 mm이면 12 mm, 12 mm 이상이면 15 mm 풍선으로 시작한다. 보통 1회 시술 시에 3회 이내로 확장하며, 직경을 1~1.5 mm씩 증가시키고 30~60초 동안 확장을 유지한다. 시술 시 내시경이 협착부의 통과가 가능하면 방사선 투시 없이 시술이 가능하지만 내시경 통과가 불가능한 경우 방사선 투시 하에 유도선을 위까지 충분히 삽입한 후 시술을 시행하는 것이 안전하다. 방사선 투시 하에 시술할 때는 풍선의 허리 부위가 협착 중간에 오도록 하고 시술 중에 풍선이 이동하지 않도록 하면서 협착 허리 부위가 사라지는지를 확인해야 한다. 양성 식도 협착에서 풍선 확장술의 성공률은 83~100%, 평균 시술 횟수는 2.1~4.4회이다[19]. 출혈과 천공은 약 0.3%에서 발생하고 특히 길고 좁고 각이 진 복합 협착이나 양잿물에 의한 부식성 협착 시 합병증 빈도가 높게 발생한다.
최근 부우지 확장술과 풍선 확장술의 장점을 이용한 Bougiecap (Ovesco Endoscopy AG, Tübingen, Germany)이 개발되었다. Bougiecap은 투명하고 끝이 가늘어지는 over-the-scope cap으로 내시경 선단부에 부착하여 내시경 직시 하에 확장술이 가능한 장점을 가진다. 50명의 식도 협착 환자를 대상으로 시행한 전향적 연구에서 평균 2.3회의 시술로 48명에서 성공적인 확장술이 가능하였다[22].
확장술 효과는 부우지 및 풍선 확장술을 시행받은 891명의 식도 협착 환자를 대상으로 한 분석에서 시술 1년째 식도 협착의 재발이 없는 것을 시술 성공으로 정의하였을 때 질환에 따라 차이는 있지만 각 군에서 70% 이상의 시술 성공을 보였다[23]. 하지만 부식성 협착의 경우 수술 후 문합부 협착, Schatzki ring에 비하여 61%로 낮은 성공률을 보였다[23]. 부우지 및 풍선 확장술 시술 간의 성공률, 합병증 발생의 비율은 연구에 따라 차이는 있지만 2018년 보고된 461명의 식도 협착 환자를 포함하고 5개의 무작위 대조 연구를 대상으로 한 메타분석에서 두 시술 간에 증상 개선율, 천공 위험성, 재발률에서 차이가 없는 것이 확인되었다[24]. 하지만 하위 분석에서 병변을 직접 관찰하지 못하고 시술하는 부우지 확장술에서 시술 후 통증이 좀 더 흔히 발생하는 것으로 확인되었다.
4. 식도 확장술의 치료 목표
아직까지 식도 협착 환자의 증상 개선 및 유지를 위해 필요한 확장술의 최대 직경(maximum diameter), 시술 간격 및 종료 시점에 대한 명확한 근거는 없다. 하지만 식도 확장술에 대한 영국 소화기학회 임상 진료 지침에서는 1~2주 간격으로 확장술을 시행하여 증상의 개선뿐만 아니라 15 mm 이상의 확장기가 쉽게 통과될 때까지 시행하는 것을 강하게 권고하고 있다[16]. 이러한 근거는 오래된 연구이지만 34명의 식도 협착 환자를 대상으로 한 군은 환자의 주관적인 증상 개선에 따라 확장술 시행 및 중단을 결정하고 다른 한 군은 15 mm 바륨 알약(barium pill) 통과 여부를 기준으로 하는 두 군으로 나누어 분석을 하였을 때 바륨 알약 통과 여부를 기준으로 하는 객관적인 군에서 통계적으로 유의하게 협착의 재발률이 낮은 것을 근거로 하고 있다[25].
5. 난치성 및 재발성 식도 협착
식도 협착은 성공적으로 확장술을 시행하여도 상당수 환자에서 재발을 경험한다. 이렇게 치료에 반응이 없거나 재발하는 경우 일반적으로 2주 간격으로 5회 이상의 확장술 시행 후에도 협착이 있는 경우를 난치성(refractory), 14 mm 이상의 관강을 4주 이상 유지하는데 실패하는 경우 재발성(recurrent) 식도 협착으로 분류한다[3]. 이 중 치료에 반응이 없는 난치성 식도 협착은 발생 원인, 협착의 직경, 3번의 확장술 후의 최대 직경으로 나누어 분석해 보았을 때 진단 당시 협착의 직경은 중요한 위험 요인은 아니었지만 협착의 발생 원인, 3회의 확장술 후에 16~18 mm의 최대 직경에 도달하지 못하는 것이 중요한 위험 요인으로 확인되었다[23]. 발생 원인으로는 상대적으로 복합 협착의 발생의 위험성이 높은 수술 후 문합부 협착, 부식성 협착, 방사선 치료 유발 협착이 난치성 식도 협착의 주요 위험 요인이었다.
확장술에 반응이 없는 경우 대부분의 임상 진료 지침에서는 약물 주입술이나 절개술(incisional therapy)을 권고한다[5]. 스테로이드 주입술은 약물 주입술의 대표적 방법으로 트리암시놀론(triamcinolone)이 콜라겐의 가교결합(cross linking)을 억제하여 반흔조직 구축(scar tissue contraction)을 줄일 수 있다는 이론에 근거한다. 확장술 전후로 트리암시놀론(40 mg/mL)을 1:1 비율로 생리적 식염수와 희석 후에 사분면에 각각 0.5 mL를 주입한다. 스테로이드 주입 시점에 따라 치료 성공률을 비교한 연구는 없지만 대부분 전문가들은 확장술 전에 스테로이드 주입을 권고한다. 하지만 수술 후 문합부 협착 환자를 대상으로 한 이중눈가림 연구에서 확장술 후 스테로이드 주입술도 협착의 재발을 예방하는 효과를 보였다[26]. 스테로이드 주입술은 2018년 시행된 메타분석에서 상대위험도(risk ratio) 0.64로 통계적으로 유의하게 협착 발생의 위험성을 감소시키는 것으로 보고되었다[27]. 경구 스테로이드의 경우 내시경 절제술 후 발생하는 식도 협착에서 예방 효과가 보고되고 있지만 협착이 발생된 환자에서 확장술 후에 투여 시 협착 재발의 위험성을 감소시키는지에 대한 연구는 부족한 상태이다[28]. 스테로이드 이외에도 섬유아세포(fibroblast)의 증식을 억제하여 항섬유화(antifibrotic activity)를 가지며 항암제로도 사용 중인 mitomycin C도 난치성 식도 협착의 약물 주입 요법으로 사용 가능하다. Mitomycin C는 개별 연구에서 좋은 결과를 보이고 있지만 전신으로 흡수될 경우 심각한 부작용이 나타날 수 있고 아직 이에 대한 연구 또한 부족하여 추가적인 연구가 필요하다[29].
내시경적 절개술은 침형 절개도를 이용하여 고주파 절개파로 협착 부위를 여러 군데 절개하여 확장시키는 방법으로 비교적 최근에 도입된 방법이다[2]. 이는 수술 문합부 협착 및 단순 협착에서 유용하며 절개도를 이용하여 협착 부위 4군데 또는 6군데 정도를 균등하게 절개하는데 환자의 흉통이나 합병증의 빈도가 적은 장점이 있다. 하지만 문합부 내강이 변형되거나 협착이 길면 시행에 어려움이 있다. 최근에는 침형 절개도 이외에 다양한 절개도 및 내시경 기구들이 이용되고 있다. 이러한 내시경적 절개술의 효과는 Schatzki ring 환자 25명을 대상으로 부우지 확장술과 비교하였을 때 1개월째 증상 개선과 무증상 기간에서 통계적으로 유의하게 우월함이 확인되었다[30]. 국내에서는 식도 협착에 대한 내시경적 절개술과 절개도에 대한 보험 급여는 아직 인정받지 못하여 시행에 제한이 있다.
확장술, 약물 주입술, 절개술에 반응이 없는 경우 일시적 스텐트(stent) 삽입을 고려할 수 있다. 스텐트 삽입은 주로 악성 질환에서 수술이 불가능할 경우 시행되지만, 난치성 또는 재발성 양성 협착에서도 사용 가능하고 4~8주간 일시적으로 스텐트를 삽입하는 것이 원칙이다. 유럽 소화기내시경학회(European Society of Gastrointestinal Endoscopy) 임상 진료 지침을 포함한 대부분의 임상 진료 지침에서는 스텐트 삽입술은 식도 협착의 일차 치료법으로 권하지 않고 다른 치료에 반응이 없는 난치성 식도 협착에 국한하여 사용을 권하고 있다[5,31]. 국내의 경우 아직 양성 식도 협착에 대한 보험 급여가 인정되지 않아 시술이 필요한 경우 본인 부담으로만 시술이 가능하다. 현재까지 식도 협착에 사용 가능한 스텐트의 종류는 자가팽창성 플라스틱 스텐트(self-expandable plastic stent), 자가팽창성 금속 스텐트(self-expandable metal stent), 생분해성 스텐트(biodegradable stent)가 있다. 플라스틱 스텐트 및 금속 스텐트의 경우 4~8주 거치 후에 제거가 필요하며 금속 스텐트의 경우 제거가 가능한 완전 피막형 금속 스텐트(fully covered metal stent)를 사용해야 한다. 각각의 스텐트는 유연성(flexibility)과 스텐트를 병변에 거치시키는 방법에 차이는 있지만 45% 내외의 비슷한 장기 시술 성공률을 보인다[32]. 하지만 플라스틱 스텐트의 경우 다른 스텐트와 달리 50% 정도의 스텐트 이탈(stent migration)과 통증, 출혈과 같은 합병증의 발생률이 20~25%로 높아 각 스텐트의 장단점을 알고 선택하는 것이 중요하다[32]. 스텐트 삽입에 의한 임상적 성공률(clinical success)은 질환에 따라 차이는 없었지만 중부, 하부식도에 비하여 상부식도 병변에서 성공률이 낮았고, 2 cm 이하의 짧은 병변보다 오히려 2 cm 이상의 병변에서 성공률이 유의하게 성공률이 높았다[33]. 하지만 이러한 스텐트 삽입은 장기간 거치 시에 식도벽의 섬유화, 압박 괴사, 스텐트 제거 이후에 또 다른 협착을 유발하는 문제로 스텐트 삽입 기간을 4~8주로 단기간 사용하는 것이 중요하다[34]. 양성 식도 협착에서 스텐트를 삽입하면 50~60%에서 스텐트 경계부 식도에 조직 과형성, 육아종이 형성되어 협착이 발생할 수 있고 스텐트가 이탈하여 소장 폐쇄를 유발한 합병증도 보고되고 있다. 최근 제거를 목적으로 하는 스텐트가 따로 개발되어 양성 협착에서 일시적인 스텐트 삽입술이 시도되고 있고 생체 내에서 일정 시간이 지나면 파괴되어 없어지는 스텐트 등도 사용되고 있다.
마지막으로 스텐트 삽입술로도 치료가 불가능한 난치성, 재발성 식도 협착의 경우 자가 확장술 또는 수술적 치료를 고려할 수 있다. 이 중 자가 부우지 확장술(self bougie dilation)은 의료인 또는 실제로 자가 부우지 확장술 시행 중인 환자가 삽입법 교육을 시행하고 환자 스스로 부우지 확장술을 시행하는 방법으로 비록 적은 수이지만 복합 협착을 동반한 9명의 환자를 대상으로 시행된 한 연구에서 9명 중 8명에서 삼킴곤란의 증상 개선이 확인되었다[35].
결 론
삼킴곤란 및 심각한 부작용을 일으키는 식도 협착은 다양한 원인 질환에 의해 발생 가능하고 국내의 경우 부식성 협착, 수술 후 문합부 협착이 주요한 원인이다. 식도 협착의 치료는 먼저 원인 질환의 악성과 양성을 구분하고, 협착의 원인과 정도를 정확히 평가해야 한다. 이에 따라 환자에게 가장 적합한 치료법을 선택하여 가능한 빨리 환자의 식이가 가능하게 하는 것이 중요하다. 양성 식도 협착의 치료는 현재 비수술적 치료가 대부분을 차지하고 있으며 부우지 확장술, 풍선 확장술, 침형 절개도를 이용한 내시경적 절개술, 일시적 스텐트 삽입술, 협착부의 약물 주사법이 이용된다. 하지만 다양한 치료법의 발전에도 일부 환자는 치료에 반응이 없거나 재발을 경험한다. 때문에 환자에게 식도 협착의 경과를 이해시키고 식도 협착의 정도와 각각의 치료법의 시술 성공률 및 합병증을 종합하여 치료 방침을 결정하는 것이 중요하다.
Notes
No potential conflict of interest relevant to this article was reported.