위장관 림프종
Gastrointestinal Tract Lymphoma
Article information
Trans Abstract
The gastrointestinal tract is the most common site of extranodal lymphoma, and more than 95% of gastrointestinal lymphoma cases are of the non-Hodgkin type. The stomach is the primary site of extranodal non-Hodgkin lymphoma, and more than 98% of primary gastric lymphoma (PGL) cases are diffuse large B-cell lymphomas (DLBCL) and mucosa-associated lymphoid tissue (MALT) lymphomas. Because PGL usually presents with nonspecific clinical symptoms and various endoscopic features, its diagnosis is mainly dependent on histopathologic findings. Chemotherapy is the first-line treatment choice for gastric DLBCL, whereas Helicobacter pylori eradication is the primary treatment for gastric MALT lymphoma. However, some cases of gastric adenocarcinoma resemble PGL endoscopically, complicating treatment decisions. There are various types of gastrointestinal lymphomas, such as natural killer T-cell, lymphomatous polyposis, mantle cell, follicular, immunodeficiency-related gastrointestinal, and Hodgkin. These can invade the small and large intestines. Although these lymphomas are rare, clinical outcomes differ among these types. Therefore, it is necessary for endoscopists to distinguish the clinical and endoscopic findings of the different lymphomas on biopsy to improve diagnostic accuracy.
서 론
림프종은 가장 흔한 혈액학적 악성종이며, 다양한 임상 양상을 나타내는 여러 가지 질환의 집합체이다. 림프종은 주로 호지킨 림프종(hodgin lymphoma, HL)과 비호지킨 림프종(non-hodgkin lymphoma, NHL)으로 분류되는데, 비호지킨 림프종은 B-세포 림프종과 T/NK-세포 림프종(T/NK-cell lymphoma)으로 나누어질 수 있다. 2016년 개정된 World Health Organization classification of lymphoid neoplasms에서는 림프종의 종류를 크게, 성숙 B-세포 림프종(mature B-cell neoplasm), 성숙 natural killer(NK)/T-세포 림프종(mature NK/T-cell lymphoma), 호지킨 림프종, 이식 후 림프증식성 질환(post-transplantation lymphproliferative disease, PTLD), 조직구 수지상세포 종양(histiocytic and dendritic cell neoplasm)으로 분류하고 있다. 이러한 림프종들을 각각 세부적으로 나누면, 아형들은 80종류 이상으로 나타난다[1]. 림프종을 발생 위치에 따라서 분류하면, 림프절 림프종(nodal lymphoma)과 림프절외 림프종(extranodal lymphoma)으로 나누어 지는데, 림프절외 림프종이 가장 많이 발생하는 장기가 위이다.
이렇게 원발성 위 림프종(primary gastric lymphoma, PGL)은 림프절외 림프종 중 가장 흔하면서, 위에 발생하는 악성 종양 중, 위선암 (adenocarcinoma) 다음으로 많기 때문에 소화기 내과 영역에서 임상적으로 중요하다[2]. 위에서 발생하는 원발성 위 림프종의 97% 이상은 성숙 B세포 림프종 중 광범위 큰 B세포 림프종(diffuse large B-cell lymphoma, DLBCL)과 위 말트 림프종(gastric mucosa-associated lymphoid tissue lymphoma, gastric MALT lymphoma)으로 보고되고 있고, 그 외, 버킷 림프종(Burkitt’s lymphoma, BL), NK/T-세포 림프종, 이식 후 림프증식성 질환 등이 드물게 보고되고 있다[3]. 원발성 위 림프종뿐 아니라, 소장과 대장에서도 상기 림프종들 및 장병변 T-세포 림프종(enteropathy-associated T-cell lymphoma, EATL), 말초 T-세포 림프종(peripheral T cell lymphoma, PTCL), 성인 T-세포 백혈병/림프종(adult T cell leukemia/lymphoma, ATLL), 외투세포 림프종(mantle cell lymphoma, MCL), 여포성 림프종(follicular lymphoma, FL), 호지킨 림프종(Hodgkin lymphoma) 등이 나타날 수 있다.
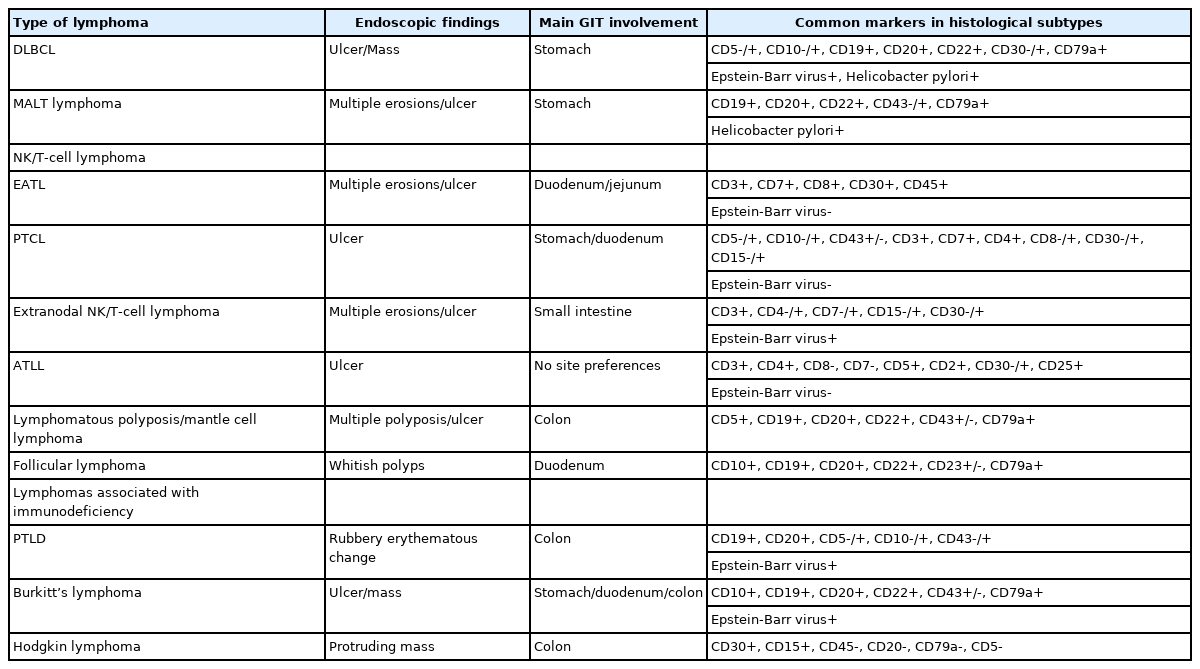
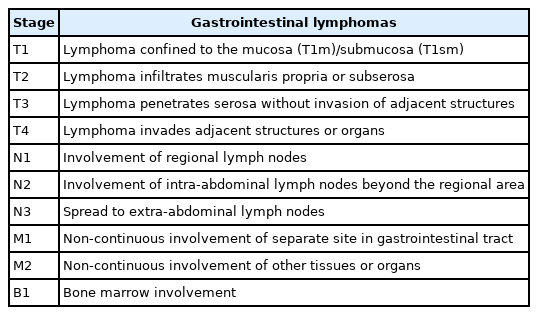
대부분 위장관의 원발성 림프종은 내시경 검사로 진단이 되며, 우리나라와 같이 위암의 유병률이 높고 건강 검진 내시경을 많이 시행하는 나라에서는 위선암과의 감별이 어려울 때가 종종 발생한다. 내시경에 의한 조직 검사 및 면역화학염색 등으로 림프종 진단 및 아형을 구분하고(Table 1), 이후 추가 검사 등을 통해서 병기 판단을 하게 되는데, 아직까지 통일된 병기 체계는 없는 실정이다. Ann arbor system은 임상 양상, 신체검진, 초음파, 전산화단층촬영, 하지 림프관조영술, 하대정맥 혈관조영술의 결과에 근거하여 병기를 정하는데, 원발성 위 림프종 중 약 30%를 차지하는 위 말트 림프종의 경우, 대부분 위만 침범하기 때문에 다른 부위의 검사가 필요 없는 경우가 많고, 예후 예측에 중요한 초음파 내시경에 의한 심달도 평가가 포함되지 않은 한계가 있다. 이를 보완하기 위해서 위벽의 심달도 평가 소견이 추가된 Ann Arbor system with Musshoff modification이 개발되었다(Table 2) [4]. Ruskoné-Fourmestraux 등[5]이 소개한 paris staging system 역시 Ann arbor system의 단점을 보완하여 위벽의 심달도에 대한 평가를 자세히 하였고, 이 외에도 림프절 침범, 원격장기의 침윤 양상도 분류하였다(Table 3). 이 외, Lugano staging system도 Ann arbor system의 부족한 내용을 추가하여 만든 병기 체계로, 최근 연구에서는 임상에서 Lugano staging system이 원발성 위 림프종 중 광범위 큰 B세포 림프종의 예후 평가에 가장 유용하다는 보고를 하였고, 위 말트 림프종에서도 많이 사용되고 있다(Table 2) [6].
치료는 림프종의 종류가 공격형 림프종인지, 지연형 림프종인지 또는 국소 병변인지, 전신 병변인지 등에 따라 접근법이 다르다. 광범위 큰 B-세포 림프종이나 T-세포 림프종 같은 공격형 비호지킨 림프종의 치료는 cyclophosphamide, doxorubicin, vincristine and prednisone (CHOP)나 rituximab을 추가한 R-CHOP 등의 고강도 항암 치료를 시행하고, 불응성 병변이거나 재발하는 경우에는 구제 항암화학요법, 자가조혈모세포 이식 등의 치료를 시행한다. 특히 공격형 림프종 중, 외투세포 림프종이나 버킷 림프종은 재발을 잘하거나 질병의 진행이 빠르다. 여포성 림프종이나 위 말트 림프종 같은 지연형 림프종의 경우는 대다수에서 고강도 항암 치료는 필요하지 않고, 치료 없이 경과 관찰 또는 헬리코박터 파일로리 제균 등의 치료 후 경과 관찰을 하는 경우도 있다.
본고에서는 위장관의 림프종 중, 원발성 림프종의 약 98%를 차지하는 광범위 큰 B세포 림프종과 위 말트 림프종의 기전, 진단 및 내시경 소견 그리고 치료 등에 대해 알아보고, 그 외 드물게 관찰되는 다양한 위장관 림프종들에 대해서도 기존의 증례들을 바탕으로 대략적으로 살펴보고자 한다.
본 론
1. 광범위 큰 B-세포 림프종(diffuse large B-cell lymphoma)
1) 역학 및 병태생리
광범위 큰 B-세포 림프종은 이전에 미만성 거대 B-세포 림프종으로 명명되었던 질환으로, 전체 림프종 중 가장 흔한 아형이고, 국내에서도 유병률이 증가하는 추세이다[7]. 광범위 큰 B-세포 림프종은 원발성 위 림프종 중 약 60%를 차지하며, 이는 림프절외 림프종에서 가장 많이 발견되는 림프종이다[3]. 광범위 큰 B-세포 림프종은 대부분 위 등의 장기에서 광범위 큰 B-세포 림프종 자체로 발생하지만, 때로 고분화도의 위 말트 림프종이 진행하여 진단되는 경우가 있다. 이러한 림프종은 위 말트 림프종으로 진단하여 치료하기보다는 광범위 큰 B-세포 림프종으로 진단하고 이에 준하여 치료하게 된다[8]. 원발성 위 림프종 중 광범위 큰 B-세포 림프종의 위험인자는 명확히 밝혀지지 않았지만, 여러 면역억제질환에 연관된 위축성 위염이 인자 중 하나로 이전부터 생각되어 왔다[9]. 최근 연구들에서 헬리코박터 파일로리 감염이 원발성 위 비호지킨 림프종의 가장 중요한 요인으로 보고되고 있고, 광범위 큰 B-세포 림프종 환자들 중 약 35%에서 헬리코박터 파일로리 감염이 되어 있으며, 이들 중에서 다수에서 광범위 큰 B-세포 림프종과 저분화도의 위 말트 림프종이 같이 관찰되어, 위 광범위 큰 B-세포 림프종의 많은 부분은 만성 헬리코박터 파일로리 감염에 의한 저분화도의 위 말트 림프종이 진행된 것으로 추측된다[10,11]. 또 다른 위 광범위 큰 B-세포 림프종의 원인으로는 인체면역결핍 바이러스(human immunodeficiency virus)가 관여하며, 그 외에도 엡스테인-바 바이러스(Esptein-barr virus), B형간염 바이러스(hepatitis B virus) 등도 관련 있는 것으로 보고되고 있다[12].
2) 임상 소견 및 진단
주로 50~60대 남성에서 많이 관찰되며, 임상 증상은 위선암 또는 위궤양 증상과 유사한 경우가 많다. 구역, 구토, 복부 팽만감, 소화불량, 체중 감소 등이 많으며, 소수의 환자에서는 피로감, 야간발한, 발열, 폐색, 천공 등의 증상도 나타날 수 있다[13]. 진단 방법으로, 과거에는 시험적 개복술에 의한 조직 검사를 하였으나, 최근에는 내시경 조직 검사 및 면역화학염색이 표준 방법으로 이용되고 있다. 내시경 기술의 발달로 내시경 조직 검사 시행 시 70~90%의 진단율을 나타내지만, 종양이 위 점막 깊게 침범한 경우에는 위 음성이 나올 수 있어, 반복적이고 깊은 조직 검사가 필요할 때도 있다[14].
임상적으로는 내시경 소견상 진행성 위선암의 소견과 유사할 때가 있어 구분이 중요하다. 위 림프종의 내시경 소견은 다양하나, 한 연구에서는 내시경 소견의 형태를 나누어 궤양형이 54.3%로 가장 많고, 침윤형이 34.3%, 용종형이 8.5% 등으로 나타남을 보여주었고, 침윤형이 다른 종양과 감별이 가장 어려운 것으로 보고하였다[15]. 최근 발표된 연구에서 48예의 위 림프종을 내시경 숙련자와 초심자가 판독을 하였을 때, 숙련자는 39.6%에서 위선암으로 판독을 하였고, 초심자는 50.7%에서 잘못 진단하였다. 이 연구에도 침윤형의 경우가 감별이 어려운 것으로 나타났다[16]. 많은 경우에서 진행성 위선암과 위 림프종을 감별할 때, 다발성 병변으로 나타나는 경우 진행성 위선암보다는 위 림프종으로 판단한다. 하지만 침윤형의 경우는 borrmann type 4형의 진행성 위선암과 구분이 어려운 경우가 종종 있어 조직 검사에 더욱 주의를 기울여야 할 것이다(Fig. 1). 내시경 진단 외에 정확한 병기 설정을 위해서는 초음파 내시경, 복부/골반/흉부 컴퓨터단층촬영, 양전자단층촬영 등의 검사 및 비록 위장관 림프종에서 골수 침범은 드물지만, 림프종의 골수 침범 여부 및 치료 효과 판정을 위해서 골수 검사 시행이 필요하다.
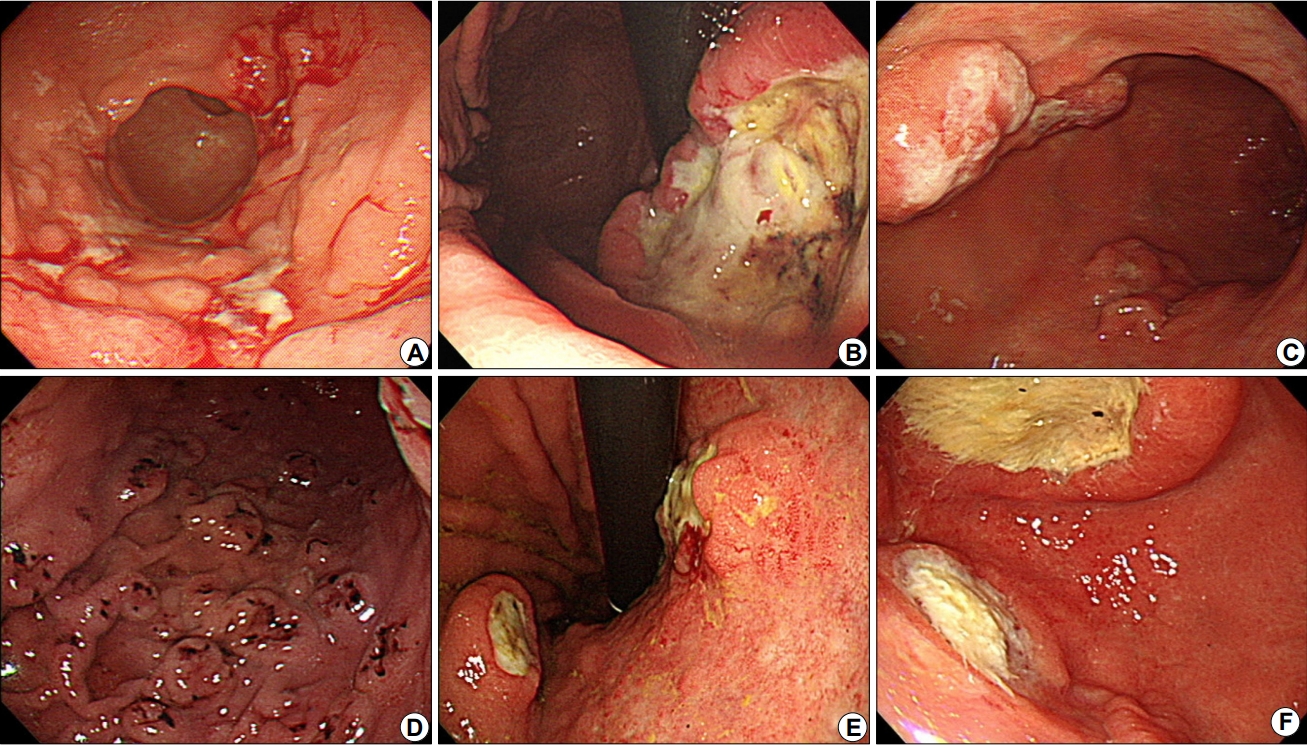
Various endoscopic findings of gastric diffuse large B-cell lymphoma. (A) Infiltrative type: diffuse infiltrative lesions with ulcerative changes are visible on the gastric antrum and body. (B) Ulcerofungating type: an ulcerofungating lesion is visible on the lower to middle gastric body. (C) Multiple nodular type: multiple nodular lesions with shallow ulcers and erosions are visible on the lower to middle gastric body. (D) Multiple raised erosion type: multiple raised erosions with hematin are visible on the entire gastric body. (E) Multiple small ulcer type: small ulcerative lesions are visible on the middle gastric body. (F) Multiple large ulcer type: two large ulcers are visible on the gastric antrum and lower body.
3) 치료 및 예후
치료 방법으로 과거에는 수술적 절제를 하였으나, 최근에 출혈, 천공 등의 합병증을 동반하지 않은 경우에는 광범위 큰 B-세포 림프종의 치료법인 전신 항암 치료를 우선으로 시행하고 있다. 위 광범위 큰 B-세포 림프종은 항암 치료에 반응이 좋으며, 조기 병기의 경우, 완전 관해율이 90%에 이른다. 가장 많이 사용되는 항암제는 일반적인 광범위 큰 B-세포 림프종 치료에 사용되는 CHOP과 R-CHOP로, R-CHOP가 CHOP보다 성적이 좋게 보고된 2002년 연구 이후로, 약 20년간 광범위 큰 B-세포 림프종의 초치료는 R-CHOP가 우선적으로 사용되고 있다[17,18].
위에서 언급한 바와 같이 위 광범위 큰 B-세포 림프종의 경우, 헬리코박터 파일로리 감염에 의한 저분화도의 위 말트 림프종이 진행되었을 가능성이 있기 때문에 헬리코박터 파일로리 제균 치료 역시 위 림프종의 효과적인 치료 방법으로 연구되고 있다. 조기 위 광범위 큰 B-세포 림프종 환자에서 헬리코박터 파일로리 제균 치료를 시행하여 성공한 경우, 1~2개월 후 약 63%에서 완전 관해를 이루었다는 연구가 있다[19]. 또 다른 연구에서는 위 광범위 큰 B-세포 림프종 중 헬리코박터 파일로리가 양성이고, 병변에 말트 부분이 있는 경우, 제균 치료를 하였을 때, 24명의 환자 중 14명에서 완전 관해에 도달하여, 헬리코박터 파일로리 제균 치료가 몇몇 위 광범위 큰 B-세포 림프종에서 효과가 있음을 보여주었다[20]. 위 광범위 큰 B-세포 림프종과 헬리코박터 파일로리와의 관계가 더 많이 증명된다면, 향후 위 광범위 큰 B-세포 림프종의 치료에서 소화기내과 의사의 역할이 커질 것으로 생각된다.
2. 위 말트 림프종(gastric mucosa-associated lymphoid tissue lymphoma)
1) 역학 및 병태생리
위 말트 림프종은 림프절외 변연부 림프종(extranodal marginal zone lymphoma)의 하나이며, B-세포 림프종의 5~8%를 차지한다. 원발성 위 림프종 중에서는 약 38%를 차지하며, 이는 림프절외 림프종에서 광범위 큰 B-세포 림프종 다음으로 많이 진단되는 림프종이다[3]. 위 말트 림프종의 발생에는 헬리코박터 파일로리 감염이 중요한 역할을 하는 것으로 알려져 있으며, 위 말트 림프종의 약 90%에서 헬리코박터 파일로리 감염이 동반된다[13,21]. 나머지 10%는 헬리코박터 파일로리 감염이 아닌 다른 원인에 의해서 발생하는 것으로 추측되나 아직 명확한 기전은 밝혀지지 않은 상태이다.
2) 임상 소견 및 진단
일부 환자에서 소화불량, 구역, 속쓰림, 위장관 출혈 등의 증상을 동반하는 경우도 있지만 많은 경우에서 무증상으로 발견되며, 검진 내시경 검사시 우연히 발견되는 경우가 많다[22]. 위 말트 림프종의 진단은 광범위 큰 B-세포 림프종과 마찬가지로 내시경 조직 검사 및 면역화학염색에 의한 진단이 가장 중요하다. 위 말트 림프종은 위의 원위부에 주로 관찰되지만, 근위부에서도 발생할 수 있고 많은 경우 다발성으로 나타날 수 있어, 여러 위치에서 충분한 검체를 얻는 것이 중요하다[23]. 진행성 위선암과 감별이 힘든 광범위 큰 B-세포 림프종과 다르게, 위 말트 림프종은 내시경 소견상 조기 위선암의 소견과 감별이 힘들 때가 있고, 때로는 위축성 위염 등 양성 위염과 구분이 어려운 경우도 있어, 면밀한 관찰 및 진단이 애매한 경우 적극적인 조직검사가 필요하다[24].
위 말트 림프종의 내시경 소견 역시 다양한 양상으로 나타내며, 내시경 모양에 대한 연구들도 다양한 형태를 보고하고 있다. 이전 연구에서 내시경 소견을 크게 4가지 모양으로 분류하였는데, 이 중 크기가 큰 궤양 형태가 42.9%로 가장 흔하고, 위염을 동반한 작은 궤양 형태 28.5%, 용종 형태 14.3%, 그 외 비정형적인 형태 14.3%로 보고하였다[25]. 일본의 연구에서는 궤양 형태가 33.3%, 다발성 미란 형태 23.4%, 반흔 형태 12.8%, 조기위암 IIc 형태 10.6% 등으로 보고하였다[26]. 국내 연구에서는 융기형, 궤양침윤형, 조기 위선암 IIc형, 상피하 종양형, 다발성 미란형 등으로 분류하였다[27]. 광범위 큰 B-세포 림프종과 같이 조기 위선암보다는 다발성으로 발생하는 경우가 많고, 일반적인 조기 위선암의 양상과 약간 다른 모양으로 관찰된다. 그러므로 경험이 많지 않은 내시경 의사의 경우 내시경 소견만으로는 감별이 힘들기 때문에 많은 사례를 공유하고, 의심이 되는 소견에 대해서 정확하고 적극적인 조직 검사를 시행하는 것이 필요하다(FIg. 2).
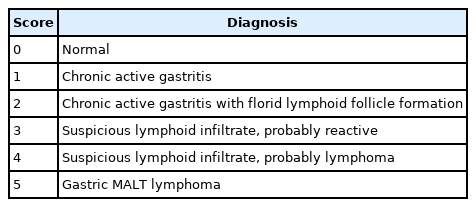
위 말트 림프종의 병리학적 진단은 Wotherspoon 등[28]이 제안한 점수 체계를 이용하는데(Table 4), 진단에 중요한 림프상피 병변(lymphoepithelial lesion)이 만성 염증에서도 관찰될 수 있어 병리 전문가의 평가가 필요하고, 때로는 조직 검사의 재시행 등을 요하는 경우가 종종 발생한다[29]. 광범위 큰 B-세포 림프종과 마찬가지로 치료에 필요한 정확한 병기 설정을 위해서는 내시경뿐 아니라, 초음파 내시경에 의한 심달도 평가, 복부/골반/흉부 컴퓨터단층촬영 등의 검사들을 권유한다. 위 말트 림프종에서 골수 침범의 빈도는 국내에서 약 0.5~7.6% 정도로 보고되었다[30-32]. 골수 침범이 있는 경우, 임상 병기 IV로 분류되지만, 위 말트 림프종의 골수 침범이 임상 경과에 미치는 영향은 아직까지 명확히 밝혀져 있지 않고, 골수 침윤이 있더라도 제균요법을 통하여 질병이 호전되는 경우들이 있어, 모든 환자에서의 골수 검사 시행에 대해서는 논란이 있다[30,33].
3) 치료 및 예후
위 말트 림프종의 치료에서 가장 중요한 것은 헬리코박터 파일로리 감염 유무의 파악이다. 조직 검사 또는 급속 요소분해효소 검사(rapid urease test) 결과 음성인 경우, 요소호기 검사(urea breath test)나 혈청 항체 검사 등을 추가로 시행하여 위 음성 여부를 감별해야 한다[34]. Lugano staging system의 병기 I 또는 II1에 해당하는 경우, 헬리코박터 파일로리 감염 유무와 관계없이 제균 치료를 1차 치료 방법으로 시행한다. 헬리코박터 파일로리 양성 위 말트 림프종에서 제균 성공 시 완전 관해율은 60~100%로 보고되고 있고[35,36], 최근 국내 다기관 연구에서는 1,163명의 위 말트 림프종 환자들의 10년 전체 생존 기간은 99.1%였으며, 특히 병기가 낮은 환자들과 헬리코박터 파일로리 감염이 양성인 환자들에서 생존 기간이 길었음을 보고하였다[37].
제균 치료 후 내시경 및 조직학적 관해에 이르기까지 평균 3~6개월이 소요되며, 1년이 지나서 관해되는 경우도 종종 있으므로, 치료 후 완전 관해 여부의 판단은 신중히 해야한다[30,36]. 제균 치료가 실패하거나, 치료가 성공하였지만 완전 관해가 되지 않는 경우, 방사선 치료 또는 항암 치료 등의 추가 치료를 고려할 수 있다. 고위험군의 위 말트 림프종에서는 항암 치료를 고려할 수 있으나 아직 이에 대한 근거는 명확하지 않은 실정으로, 제균 치료에 반응하지 않는 위 말트 림프종에서의 추가 치료는 경과 관찰하면서 기다리는 방법(watch and wait)이나 방사선 치료를 주로 시행하게 된다. 위 전체와 위 주변 및 복강 림프절이 포함되는 범위에 총 30.6 Gy를 17회에 걸쳐서 조사하며[38,39], 치료 성공률은 88~100%, 5년 무진행 생존율은 90~100%로 나타난다[40,41]. 치료와 연관된 급성 부작용은 오심, 구토, 식욕 부진 등이 있으나 대부분 경미하며, 보존적 치료로 조절이 가능하다[42].
4) 헬리코박터 파일로리 음성 위 말트 림프종
위에서 잠시 언급한대로, 헬리코박터 파일로리 음성 위 말트 림프종의 기전은 명확히 밝혀지지 않았으나, Helicobacter heilmannii 같은 헬리코박터 파일로리 이외의 헬리코박터 균주의 감염이나, t (11;18) (q21;q21) 유전자 변이 또는 자가면역 기전이 원인이라는 가설이 있다[22,43]. 헬리코박터 파일로리 음성 위 말트 림프종의 임상 증상은 헬리코박터 파일로리 양성 위 말트 림프종의 증상과 유사하며, 가증 흔한 증상은 소화불량과 상복부 통증으로 나타난다[44]. 내시경 및 조직 검사를 통한 진단과 병기 설정을 위한 검사들은 헬리코박터 파일로리 양성 위 말트 림프종과 같이 진행을 하며, 헬리코박터 파일로리의 위 음성을 배제하기 위하여 헬리코박터 파일로리에 대한 검사를 적어도 두 가지 이상 시행할 것을 권고한다[45]. 제균 치료에 대한 치료 성공률은 0~83%로 다양하게 보고되는데, 다발성 병변, 종양의 침범이 점막하층보다 깊은 경우, 주위 림프절 침범이 있는 경우, t (11;18) (q21;q21) 유전자 변이가 있는 경우 등에서 치료 성공률이 낮은 것으로 보고되었다[46-49]. 제균 치료에 반응이 없는 경우, 추가 치료에 대한 가이드라인은 없는 상태이지만, 항암 치료나 방사선 치료 시행 시 효과가 좋은 것으로 나타나고 있다[50,51]. 국내 연구에서는 헬리코박터 파일로리 음성 환자들에서 제균요법을 시행한 경우, 57.1%에서 완전 관해를 보임을 보고하였는데, 이는 헬리코박터 파일로리 음성 위 말트 림프종의 진단 시 헬리코박터 파일로리 감염 여부를 적절히 진단하지 못했거나, 헬리코박터 파일로리 이외의 헬리코박터 균주가 치료되면서 림프종 유발에 관여하는 인자가 제거되어 치료되었을 가능성 등으로 설명하고 있다[30].
3. NK/T-세포 림프종(NK/T-cell lymphoma)
T-세포 림프종(T-cell lymphoma)의 위장관 침범은 전체 위장관 림프종의 약 5% 정도로 보고되며, 특히 아시아에서는 약 7~15%로 약 1.3%인 유럽보다는 많이 발생하는 것으로 나타나고 있다[3,52,53]. 내시경적 소견으로는 궤양성 공장염이 가장 많은 양상으로 관찰되며, 흡수 장애의 증상으로 많이 나타나지만, 출혈이나 천공도 발생할 수 있다[52,54]. T-세포 림프종은 대부분 십이지장이나 공장을 침범하지만, 드물게 위에서 나타나는 경우도 있다[55]. 위장관을 주로 침범하는 종류의 T-세포 림프종은 장병변 T-세포 림프종, 말초 T-세포 림프종과 림프절외 NK/T-세포 림프종 그리고 성인 T-세포 백혈병/림프종이 있다.
장병변 T-세포 림프종은 주로 복통과 장폐색, 천공 등을 유발할 수 있고, B-세포 림프종에 비해서 예후가 나빠서 생존 기간이 약 7~10개월 정도로 보고되고 있다[56]. 말초 T-세포 림프종과 결절외 NK/T-세포 림프종은 한국과 일본의 위장관 T-세포 림프종 중 가장 많은 것으로 알려져 있다[57]. 말초 T-세포 림프종은 주로 피부에서 많이 생기지만, 위장관 침범이 있는 경우 특히 예후가 나쁘며, 위장관 침범 중 60% 이상은 위와 십이지장에서 나타난다[58].
림프절외 NK/T-세포 림프종은 주로 비강에서 나타나며 드물게 위장관으로 침범하는데, 엡스타인-바 바이러스 감염이 밀접하게 관련되어, 약 70% 정도에서 엡스타인-바 바이러스 양성으로 관찰된다[59]. 위장관 침범 시 소장을 주로 침범하며, 위에서는 드물게 나타난다[60]. 증상으로는 궤양에 의한 천공, 복막염 등이 잘 나타나며, 천공의 위험 인자가 있는 경우에는 항암 치료나 방사선 치료 시행 전이나 시행 후에 수술을 하는 것이 도움이 될 수 있다[61,62].
성인 T-세포 백혈병/림프종은 주로 일본에서 많이 보고되었으며, 임상적으로는 궤양을 동반하면서 공격적인 양상으로 나타난다[57]. 위장관 침범 시 약 1/3에서는 전신질환으로 진행하는데, 한 연구에서는 이 중 약 40% 정도는 위에서, 38%는 소장에서, 34%는 대장에서 발생함을 보고하였다[63,64]. 위장관 침범 시 진행이 빠르며 나쁜 예후를 나타내는데[63,65], 특히, 위를 침범하는 경우 절반 이상에서 궤양 소견이 관찰된다. 이러한 양상은 헬리코박터 파일로리 감염에 의해 생긴 염증이 악성 림프구들을 위벽으로 이동시켜 궤양 소견과 복통 등의 증상을 일으키는 것으로 생각된다[66,67].
4. 림프종양 용종증/외부세포 림프종(lymphomatous polyposis, LP/mantle cell lymphoma)
림프종양 용종증(LP)은 작은 크기의 림프구들이 확산 증식을 하면서 질환이 진행하기 때문에, 내시경 소견에서는 주로 약 2 mm 전후 크기의 결절 양상으로 관찰되며, 때로는 10 mm 정도의 크기로 나타날 수도 있다. 림프종양 용종증은 소장에서 가장 호발하며, 동양보다 서양에서 더 많이 발생하고, T-세포 림프종보다는 B-세포 림프종이 더 흔한 양상으로 관찰된다[52].
림프종양 용종증 중 50% 이상은 외투세포 림프종으로 나타나는데, 외투세포 림프종은 소장과 대장을 가장 많이 침범한다[52,68]. 국내 보고에서는 대장의 침범이 가장 많았고, 위, 회장 등과 대장이 같이 침범하는 양상으로 나타나는 경우들이 있었다. 내시경 소견상 용종 양상의 종괴를 형성하는 경우가 가장 흔하고, 그 외 침윤형, 궤양형 순으로 관찰되었다[69]. 외투세포 림프종의 위장관 침범은 약 88~92% 정도로 흔하게 나타나지만, 원발성 위장관질환은 2~13%로 주로 전신질환이 발생한 상태에서 위장관 침범이 같이 발견되는 경우가 많다[11]. 위장관 침범이 있는 경우 예후가 나쁘며, 평균 생존 기간은 약 3~4년 정도이지만[52,70], 젊은 연령에 발견되어 집중 치료를 받는 경우, 10년까지의 비교적 좋은 생존 기간을 나타낼 수도 있다[71,72].
5. 여포성 림프종(follicular lymphoma)
여포성 림프종은 전체 비호지킨 림프종의 3.6% 정도를 차지하는 비교적 드문 질환이다[73]. 위장관 침범 시 십이지장에서 약 50% 이상 관찰되며, 다음으로 말단 회장에서 약 30% 정도 나타난다[70,73]. 내시경 소견상 2 mm 정도 크기의 백색 결절이 모여 있는 양상으로 나타나고, 궤양을 동반하는 경우도 있다[73]. 다른 림프종들과는 다르게 천천히 진행하고, 특히 위장관 침범이 나쁜 예후를 나타내지 않으며, 주변 림프절에 퍼지지 않고 위장관에만 국한적으로 나타나는 경우가 많다[74-76]. 위장관 여포성 림프종의 경우 정해진 치료법은 아직 없지만, 증상이 없는 환자들에서는 여포성 림프종이 진행을 하거나 증상이 생기기 전까지는 경과 관찰을 하는 경우도 있다[76,77].
6. 면역결핍 관련 위장관 림프종(Immunodeficiency related gastrointestinal lymphoma)
면역결핍시에 발생하는 위장관 림프종이 생길 수 있는 전신질환으로는 인체면역결핍 바이러스 감염에 의한 후천성 면역결핍증(acquired immunodeficiency syndrome, AIDS)과 이식 후 면역 억제 상태가 있다. 인체면역결핍 바이러스 감염 환자에서의 림프종 발생은 1996년 이전인 pre-HAART 치료 시기에 많이 나타났었는데, 이 시기에는 정상인보다 진행이 빠른 림프종이 약 353배 더 많이 나타났으며, 이 중 20~50%에서는 위장관 침범이 관찰되었다[78,79]. 이식 후 림프증식성 질환보다는 덜하지만 엡스테인-바 바이러스나 거대세포 바이러스(cytomegalovirus) 감염이 동반된 경우 예후가 나쁘고[80], 분포는 B-세포 림프종(광범위 큰 B세포 림프종, 버킷 림프종, 위 말트 림프종)이 약 67%, T-세포 림프종이 약 33% 정도로 나타난다[79,81]. 가장 흔하게 침범하는 장기는 위와 십이지장이며, 내시경에서는 주로 다발성 궤양과 용종 양상 또는 종괴 형태로 관찰된다[78,80]. 인체면역결핍 바이러스 감염 환자에서의 림프종의 예후는 좋지 않아, 평균 생존 기간은 6개월 정도이고, 완전 관해는 40% 이하에서 관찰된다[82]. 이 중 버킷 림프종은 매우 공격적이지만, 항암화학요법에 반응이 좋아 치료 가능성이 높은 B-세포 림프종이다. 위장관 침범은 드물지만, 국내 보고에 의하면, 위, 대장, 십이지장을 침범한 양상으로 주로 관찰되며, 내시경 소견은 궤양이나 궤양을 동반한 종괴형 등이 많이 보였고, 5년 생존율은 64%로 나타났다[83].
신장, 심장, 소장 이식 후 특히 많이 관찰되는 위장관 림프종인 이식 후 림프증식성 질환은 인체면역결핍 바이러스 관련 림프종과 비교해서 면역억제제의 사용에 의해 감염된 엡스테인바 바이러스가 중요한 역할을 한다[84]. 대부분의 림프종은 이식 후 12개월 이후 발생하며, 평균 생존 기간은 8년 정도이다[78,85]. 위장관 침범은 약 1/3에서 관찰되며, 대장을 가장 흔하게 침범하고, 그 외 소장, 위 등에서도 관찰된다[86]. 한 연구에서는 위장관에 국한된 초기 이식 후 림프증식질환 중 일부에서 내시경적 제거를 통해 치료를 할 수 있음을 보고하였다[87].
7. 호지킨 림프종(hodgkin lymphoma)
위장관 침범을 하는 호지킨 림프종는 전체 림프절외 호지킨 림프종 중 약 1~3%이며, 위장관 림프종 중 5% 이내로 나타난다[88]. 위장관의 호지킨 림프종은 대장 등에서 관찰될 수 있으며, 증상은 주로 협착이나 궤양 소견 등으로 나타난다[88]. 위장관 침범이 예후에 미치는 영향은 아직 밝혀져 있지 않지만, 염증성 질환과 면역 저하 상태가 위장관 호지킨 림프종 발생에 중요한 역할을 할 것으로 여겨진다. 몇몇 경우에서는 위장관 호지킨 림프종이 대장의 염증성 장질환 형태와 유사하며, 드물게 염증성 장질환 환자에서 대장을 침범하는 호지킨 림프종이 생길 수 있다는 보고가 있으며, 면역결핍 환자에서도 위장관 호지킨 림프종이 발생할 수 있다[89,90].
결 론
위에서 발견되는 원발성 림프종의 경우 대부분 광범위 큰 B세포 림프종과 위 말트 림프종으로, 임상 소견이 비특이적이며, 내시경적 소견상 진행성 또는 조기 위선암과 구분이 어려운 경우가 많아, 다양한 내시경 소견을 경험하고 익히는 것이 필요하다. 치료 방향 결정으로 위하여 조직학적 검사에 의한 진단 및 다양한 검사를 시행해야 하며, 위의 림프종은 많은 경우에서 헬리코박터 파일로리와 관련이 있으므로 이에 대한 진단 및 치료 방향을 결정하는 것도 중요하다. 또한, 위 외의 소장과 대장에서 발생하는 드물고 다양한 위장관 림프종들을 파악하여, 질환이 의심되는 경우, 적극적인 조직 검사 등을 통해서 정확한 진단을 할 수 있는 것이 환자의 치료 및 예후에 중요한 영향을 미칠 것으로 생각된다.
Notes
No potential conflict of interest relevant to this article was reported.