식도 이완불능
Achalasia
Article information
Trans Abstract
Achalasia is characterized by peristaltic failure and incomplete relaxation of the lower esophageal sphincter. The incidence and prevalence of achalasia increase with age, although achalasia can affect all age groups. The pathophysiology of achalasia involves the loss of inhibitory ganglion cells in the myenteric plexus of the esophagus. Its main symptoms include dysphagia, chest pain, regurgitation, and weight loss. The method of diagnosing achalasia has evolved from conventional manometry in the 1970s to high-resolution manometry in the 2010s. High-resolution manometry based on spatiotemporal plots can diagnose achalasia more precisely than conventional manometry. Moreover, novel parameters such as integrated relaxation pressure (IRP) (according to the Chicago classification) have increased diagnostic accuracy. However, cases of achalasia presenting with normal IRP have been reported. Therefore, the novel Chicago classification version 4.0 has adopted additional tests. These tests include the stress test for esophageal motor disorders, timed barium esophagography, and test using a functional lumen imaging probe that measures the distensibility of the esophagogastric junction. Achalasia was previously treated using surgical myotomy, balloon dilation, and botulinum toxin injection. However, peroral endoscopic myotomy (POEM) has recently become the mainstay treatment. POEM has a higher clinical success rate and a lower complication rate than surgical myotomy. Esophageal cancer and pulmonary conditions such as aspiration pneumonia are possible complications of achalasia. In this review, the current knowledge regarding achalasia together with novel diagnostic and therapeutic strategies are discussed.
서 론
식도는 식괴를 상부식도조임근에서 하부식도조임근까지 연동운동을 통해 내려 보내는 인체 기관이다. 식도 이완불능(achalasia)은 하부식도조임근의 비정상적인 수축으로 정상적인 연동운동이 이루어지지 않아 삼킴곤란이나 비심인성 흉통 등을 유발한다[1]. 식도 이완불능은 예전부터 알려져 있던 질병이나, 고해상도 내압 검사 및 여러 가지 진단 방법의 비약적인 발전으로 인하여 최근 더욱 각광받고 있으며, 2010년대 이후 경구적 내시경 근절개술 등의 새로운 치료 방법이 개발되어 질병의 정확한 진단 및 치료에 대해서 그 어느 때보다 관심이 집중되고 있다. 본 원고에서는 식도 이완불능의 진단에 쓰이는 식도 내압 검사에서 최근 새롭게 제시된 시카고 기준 4.0과 치료에 대한 새로운 연구 결과들을 소개하고자 한다[2].
본 론
식도 이완불능은 1672년 영국의 의사 Willis에 의해 처음 알려진 질병으로, 당시에는 원인을 잘 알 수 없는 식도수축이 있는 환자에서 고래뼈에 스펀지를 붙여서 식도를 넓혀서 치료를 했다고 한다[3]. 따라서 식도내압 검사가 도입되기 전부터 이미 식도 이완불능에 대해 인지하고 있었다고 생각되며 이미 수백 년 전부터 존재했던 질병이라고 할 수 있다[3]. 이제는 식도운동 질환의 진단에 가장 중요한 검사로 여겨지는 식도내압 검사는 1970년대에 처음 임상에 소개되었다. 새로운 판독 기준이 나올 때마다 수시로 진단명이 바뀌거나 호두까기 식도처럼 진단명이 사라지는 등의 시행착오를 겪기도 하였고, 식도내압 검사를 통한 식도운동질환의 진단명이 임상 증상과 괴리가 있었기에 시카고 4.0부터는 임상적인 증상이 있을 때만 해당 진단명을 붙이도록 하는 등의 변화를 겪었다. 그러나 식도 이완불능은 이러한 변화에도 불구하고 뚜렷한 진단명으로 자리매김하였다[4].
1. 역학
식도 이완불능은 대략적으로 전세계 인구 10만 명당 1~5명 정도의 발생률(incidence)을 보인다고 알려져 있고, 유병률(prevalence)은 인구 10만 명당 7~32명 정도라고 알려져 있다[5-7]. 하지만 고식적 내압 검사가 쓰였던 1970~1990년대보다 고해상도 내압 검사가 활성화된 2010년 이후 진단율이 높아졌다는 보고도 서구 쪽을 중심으로 나오고 있다[8,9]. 한국에서는 건강보험심사평가원 자료를 바탕으로 한 2011년에 발표된 연구에 따르면, 인구 10만 명당 남자는 0.33, 여자는 0.44의 발생률을 보고하고 있다[10]. 식도 이완불능은 전 연령대에서 발생할 수 있으나, 발생률과 유병률 모두 50세 이상의 고령층에서 증가한다고 알려져 있다[7,9,11].
2. 원인
아직까지도 그 정확한 원인은 밝혀져 있지 않으나, 일부 연구에서 특정 HLA 유전자형이 있는 환자들에게 바이러스 감염 이후 식도 이완불능으로 발현한다는 가설을 제시한 바 있고 특정 유전질환(triple A syndrome)과의 관련성에 대한 연구도 있었으나 일반화하지는 못하였다[1,5,12,13]. 최근에는 호산구성 식도염과의 관련성에 대해서도 여러 연구가 이루어지고 있으나, 아직까지 그 관련성은 명확하지 않다[14,15]. 브라질 같은 특정 지역에서는 샤가스(Chagas) 병의 증상 중의 하나로 나타나기도 한다[5]. 식도 이완불능 환자들에서 상대적으로 자가면역질환 유병률이 높다고 알려져 있어, 추가적인 연구가 기대되고 있다[16,17]. 병태 요인으로는 하부식도조임근과 하부식도 근육층의 근육층얼기(myenteric plexus ganglion)의 기능 소실이 원인일 것으로 추정하고 있다[5].
3. 임상 증상
가장 흔한 증상은 삼킴곤란이며, 고형식과 유동식에 동시에 있다는 것이 특징적이다. 소화 안 된 음식이 역류해서 올라오는 것도 주요 증상 중의 하나이며 특히 야간에 누워 있을 때 역류가 심하다고 한다[5]. 역류 증상으로 인하여 위식도 역류로 오인하는 경우도 있으므로 주의를 요한다[18,19]. 역류 및 삼킴곤란 등으로 인하여 체중 감소가 동반되기도 하고, 간혹 흡인성 폐렴이 반복되기도 한다[19]. 흉통도 특징적인 증상인데 특히 3형 식도 이완불능에서 더 도드라진다고 알려져 있다[5]. 흉통의 기전은 아직도 명확하지 않으나, 식도 내강 내에 머물러 있는 음식물의 발효에 의한 식도 내강의 화학수용체 자극에 의한 것이라는 가설, 식도 민무늬 근육의 불협 수축에 의한 것이라는 가설 등이 제시되고 있다[5]. 대표적인 증상인 삼킴곤란, 음식물 역류, 흉통, 체중 감소를 묶어서 Eckardt 점수가 치료 전후 효과 판정에 널리 쓰이고 있으나, 실제 증상을 잘 반영하지 못한다는 반론도 제시되고 있다[5,20]. Eckardt 점수는 삼킴곤란, 역류, 흉통을 각각 없으면 0점, 간혹 있으면 1점, 매일 있으면 2점, 식사 때마다 있으면 3점으로 하고, 체중 감소가 없으면 0점, 5 kg 미만이면 1점, 5~10 kg이면 2점, 10 kg 초과이면 3점으로 하여 총 12점 만점으로 평가한다.
4. 진단
1) 내시경
상부 내시경은 진단율이 낮다고 알려져 있고, 특히 식도 이완불능 초기에는 진단에 큰 도움이 안 되는 것으로 알려져 있다[19,21]. 내시경 검사에 익숙한 전문가일지라도 위식도 경계부 직상방에서 내시경 관찰 중에 송기를 하다 보면 위식도 경계부가 손쉽게 열리기 때문에 일반적인 내시경 검사에서는 식도 이완불능을 놓치는 경우도 종종 있다. 하지만 식도 협착을 일으키는 2차적인 원인 감별에 도움이 될 것으로 생각되고 있다[21]. 또한, 내시경 관찰 시에 식도 내강에 비정상적으로 음식물이나 액체류가 고여 있다거나 식도 내강이 늘어나 있다면 식도 이완불능을 의심할 수 있다[21].
2) 식도내압 검사
1970년대에 도입된 고식적 내압 검사는 당시만 해도 물이 흘러나오는 관류 측정관으로 이루어진 검사가 주로 쓰였으며 식도 압력을 측정하는 센서가 카테터마다 차이는 있으나 대체적으로 3~5 cm 간격으로 띄엄띄엄 배열되어 있어서 식도 이완불능증의 핵심적인 진단인 하부식도조임근의 이완 여부를 판독하는 데 어려움이 많았다[22]. 즉, 하부식도조임근 주변의 센서에서 식도 및 주변 구조물인 횡격막이 오르락내리락하면 하부식도조임근이 거짓 이완되는 것으로 판독하는 경우도 적지 않았고 식도 이완불능을 제대로 진단하지 못하는 경우도 있었다[23]. 이를 극복하기 위해 1976년 호주의 John Dent가 개발한 Dentsleeve는 하부식도조임근 주변의 6 cm 길이의 센서를 만들어서 그 사이에서 가장 높은 값을 측정하는 방법을 제안하였지만 상대적으로 널리 쓰이지는 못하였다[22,24]. 하지만 2000년대부터 미국 세인트루이스 조지워싱턴 대학의 Ray Clouse 등에 의해서 기존의 3~5 cm 간격으로 배열된 고식적 내압 검사법이 아닌 1 cm 간격으로 조밀하게 압력 센서가 배열된 고해상도 내압 검사법이 조금씩 연구 목적으로 사용되기 시작하였다[22,25]. 이러한 고해상도 내압 검사법은 기존 고식적 내압 검사법에 비하여 훨씬 많은 정보를 얻을 수 있었으며 진단에 있어서도 획기적인 변화를 가져오게 되었다(Fig. 1) [25,26]. 또한 Ray Clouse는 1 cm 간격의 센서 사이의 압력값을 다시 0.1 cm 간격의 추정치(interpolation)로 채우고 이를 압력값에 따른 컬러 이미지(압력값이 낮으면 파란색 계열, 압력값이 높으면 붉은색 계열)로 표현하고 또한 이를 일기예보에서 쓰이던 등고선 이미지를 도입하여 현재 쓰이는 고해상도 내압 검사법의 기틀을 잡았다[22,25]. 이렇게 촘촘하게 배열된 압력 센서를 통하여 다시 추정치까지 더해져 식도 내의 어떤 부위의 압력값도 측정이 가능하게 된 고해상도 내압 검사는 기존의 고식적 내압 검사의 고질적인 문제 중 하나였던 하부식도조임근의 거짓 이완을 좀 더 잘 찾아내게 되었고, 또한 기존의 Dentsleeve 개념을 전기적인 신호 분석을 통하여 발전시킨 eSleeve 개념을 도입하였다[22]. Ray Clouse는 삼킴 이후 10초 동안의 3초간 가장 낮은 하부식도조임근 바닥값이 가장 위식도 경계부의 이완을 잘 반영하는 기준값으로 처음 제시하였으나 뒤이은 시카고 그룹의 후속 연구에 따라 삼킴 이후 10초 동안에 위식도 경계부 압력의 바닥값의 4초 중앙값이 위식도 경계부의 이완을 가장 잘 반영한다고 연구 결과를 발표하였고, 이를 적분된 이완 압력(integrated relaxation pressure, IRP)으로 정의하여 현재 사용하는 시카고 기준의 기준점이 되었다(Fig. 2) [22,27]. 한편, 시카고 노스웨스턴대학의 John Pandolfino는 고해상도 내압 검사 결과값을 바탕으로 한 식도 이완불능 환자들의 내압검사 그림을 관찰하던 중, 3개의 아형이 존재한다는 것을 발견하였고 이런 3개의 아형에 따라 치료 후 예후가 다르다는 것도 발표하였다[28]. Pandolfino에 의하면 IRP 수치는 비정상적으로 높으나 식도 체부운동이 전혀 관찰되지 않는 1형, 식도 체부의 돌림근육층(circular muscle layer)의 운동은 떨어져 있으나 세로근육층(longitudinal muscle layer)의 운동만 일부 남아서 전식도 가압이 20% 이상의 삼킴에서 관찰되는 2형, 하부식도 체부의 수축을 20% 이상의 삼킴에서 관찰되는 3형으로 새롭게 구분하였고(Fig. 2), 특히 2형의 경우 치료 이후 증상 개선이 다른 1형이나 3형에 비해서 유의하게 높다는 것이 여러 연구를 통하여 알려졌다[1,28,29]. 이러한 3개의 아형의 분류는 2021년에 발표된 시카고 4번째 개정판까지 이어지고 있다(Table 1) [4]. 하지만 여러 연구 결과들을 통하여 적분된 이완 압력값이 정상임에도 불구하고 식도 이완불능인 경우도 밝혀지면서 새롭게 개정된 시카고 4번째 개정판에서는 후술할 여러 가지 추가적인 방법을 통하여 확진을 권장하고 있다[30]. 또한, 식도내압 검사 프로토콜에서도 추가적으로 변화를 주어서 기존에 단순하게 누운 자세에서 10번의 삼킴을 통하여 진단하는 것 외에 여러 가지 추가적인 검사들을 권장하고 있다[4]. 즉, 누운 자세에서 2~3초 간격으로 2 mL 식염수를 5회 삼키게 하는 다중급속삼킴 검사(multiple rapid swallow test)를 시행하며, 이를 통하여 식도 체부의 수축 여력(contractile reserve)을 알아볼 수 있다고 알려졌다[4,31]. 그 후 체위를 바꿔서 앉은 자세에서 다시 식염수를 5회 삼키게 하는데, 검사 도중에 자세를 바꾸는 이유는 위식도 접합부 출구 폐쇄(esophagogastric junction outflow obstruction) 같은 경우 카테터에 정상적인 식도 내강 내의 구조물 등이 닿아서 적분된 이완 압력값이 비정상적으로 높게 나오는 것을 배제하기 위해서 등의 이유이다[4,32]. 다음으로는 200 mL의 물을 최대한 연달아서 삼키게 하는 급속삼킴 검사(rapid drink challenge)를 진행하게 되는데 이를 통하여 위식도 경계부(esophagogastric junction)의 기능을 파악하는 데 도움이 된다고 하며, 특히 적분된 이완 압력 수치가 낮거나 애매한 경우에서 급속삼킴 검사를 시행하여 식도 이완불능 등의 진단에 도움이 된다고 한다[4,31,33]. 그 외 밥 같은 고형 식이를 먹이거나 amyl nitrate 등의 약물 투여 등을 통하여 유발 검사를 추가적으로 시행할 수도 있다[4]. 만약 이러한 검사를 진행했음에도 이상 소견이 명확하지 않거나 진단이 애매한 경우에 대해서 시카고 4판 개정판에서는 플립(functional lumen imaging probe, FLIP)과 시간차 바륨 식도조영술(timed barium esophagogram) 등의 검사를 보조적인 진단 도구로서의 역할을 인정하면서 이러한 한계를 극복하고자 하였다[2,4]. 플립에서는 위식도 접합부-탄성도(esophagogastric junction-distensibility index)가 3.0 이하이면서 비정상적인 수축을 보일 때 그리고 시간차 바륨 조영술에서는 5분 이상 바륨이 5 cm 이상 머물러 있거나 1분 이상 타블렛이 머물러 있을 때로 비정상을 정의하였다[2,4].
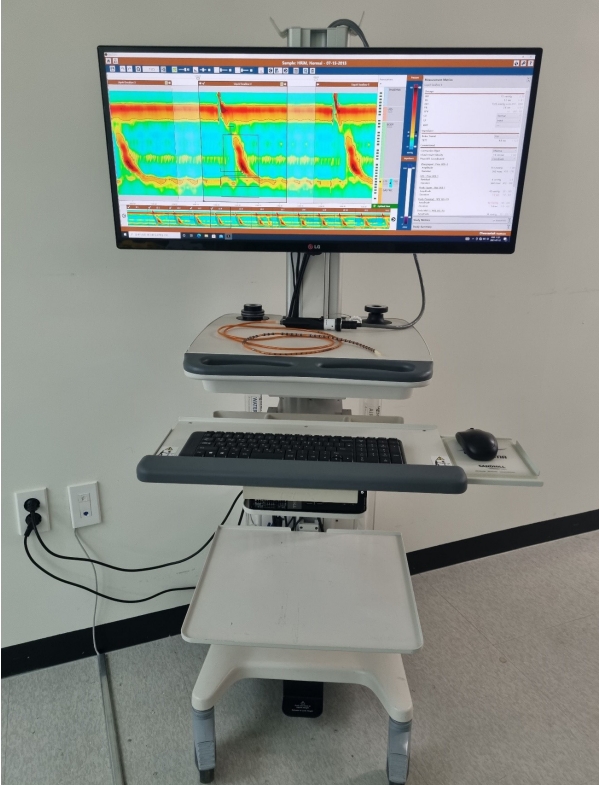
High-resolution manometry set-up. The equipment comprises a 12-French catheter with 36 pressure sensors at 1-cm intervals and 18 impedance sensors at 2-cm intervals (Diversatek Healthcare, Milwaukee, WI, USA). When the catheter is positioned into the esophagus, the sensors detect the pressure in various parts of the esophagus. Intraluminal pressure data are converted into dynamic esophageal pressure topography plots by integrated software algorithms.

Representative high-resolution manometric images of normalcy and achalasia. (A) Normal finding: the black box represents 10 seconds of the post-swallow period. Integrated relaxation pressure (IRP) is defined as the median 4 seconds nadir of pressure through the esophagogastric junction in the black box. IRP is decreased during the post-swallow period. (B) Achalasia type I: the IRP is elevated, and failed peristalsis is noted. (C) Achalasia type II: the IRP is elevated, and panesophageal pressurization is noted. (D) Achalasia type III: the IRP is elevated, and spasm is noted.
3) 플립(FLIP)
임피던스 면적 측정(impedance planimetry)을 이용한 식도 기능 연구는 1990년대부터 실험적으로 이루어져 왔으며, 실제 임상에서 그 이용이 가능해진 것은 Hans Gregersen 등에 의해서 FLIP (endoFLIP; Medtronic, Minneapolis, MN, USA)이라는 형태로 발전된 이후이다[34,35]. 이를 상용화한 것이 endoFLIP이며, 이를 임상에서 활용한 연구는 2010년대 초반부터 시카고 노스웨스턴 그룹에서 시작하였다[36-38]. 특히, endoFLIP에서는 임피던스 면적 측정을 바탕으로 내강의 단면적 및 압력을 측정할 수 있고, 이를 바탕으로 하여 내강 또는 조임근의 팽창능을 측정할 수 있다[37-39].
식도 이완불능의 병태생리를 생각해보면, 애초에 하부식도조임근의 불완전한 이완에 의해 발생하는 병이므로 5 mL씩의 역동적인 삼킴이 없으면 아무 신호도 체크되지 않아서 상대적으로 역동적인 내부로의 수축력을 평가하는 식도내압 검사보다는 상대적으로 수동적인 식도 바깥으로의 식도조임근의 팽창능을 평가할 수 있는 플립 같은 검사가 오히려 더 정확할 수도 있다고 일부 연구에서 주장되고 있다[40,41].
흔히 식도에서 쓰이는 플립 카테터는 8 cm (16개의 임피던스 센서가 0.5 cm 간격 배열)와 16 cm (16개의 임피던스 센서가 1 cm 간격 배열) 두 종류가 있는데, 8 cm 카테터는 위식도 경계부의 팽창능과 단면적 측정이 가능하고, 16 cm 카테터는 그 외 추가적으로 식도내강의 2차 연동운동도 파악이 가능하다[41]. 또한 최근에 플립을 이용하여 2차 연동운동의 파형을 분석한 panometry에서는 삼킴곤란으로 내원한 환자들 중에서 고해상도 내압 검사에서 정상이었던 환자의 50%에서 비정상 플립 소견을 보여서 진단이 가능했다는 연구 결과도 있다[41-43]. 최근 연구들을 종합하면 팽창능을 기준으로 2 mm2/mmHg 이하라면 비정상으로 간주되며, 2~3 mm2/mmHg 사이는 경계부, 3 mm2/mmHg 이상은 정상으로 여겨진다[41]. 또한, 식도 이완불능 환자 중에서도 앞 방향 2차 연동운동 등이 일부 살아있는 경우에는 경구적 내시경적 근절개술 등 시술 이후 식도 체부 운동능이 일부 회복되거나 증상 개선의 여지가 좀 더 있을 것으로 예측하는 일부 소규모 연구가 있으나, 이에 대해서는 대규모의 전향적 연구가 필요할 것으로 보인다[41,43].
4) 시간차 바륨 조영술(timed barium esophagography)
시간차 바륨 조영술은 100~200 mL의 저밀도 바륨을 선 자세에서 마시고, 1분, 2분, 5분 후 각각 식도의 엑스선 사진을 얻어서 바륨의 저류를 확인하는 방법이며, 식도내압 검사의 보조적인 진단 검사로서 도움이 될 수 있다[5]. 최근 여러 연구에서 시간차 바륨 조영술이 식도 이완불능의 진단 및 예후 판정에 도움이 된다고 보고하였다[5]. 식도 이완불능 환자들을 대상으로 한 대규모 연구에 의하면 바륨을 삼킨 후 1분 뒤 바륨 원주 높이가 5 cm 이상 남아 있을 때 94% 민감도와 71% 특이도를 보고하였고, 13 mm 지름의 바륨 타블렛이 빠져나가지 못하고 위식도 경계부에 걸리는 것이 진단에 도움이 됨을 보고하였다[44].
5) 감별 진단
전 세계적으로 마약류 진통제 등의 사용 증가에 따라 마약성 약제에 의한 식도운동 이상도 알려지고 있는데, 마약성 진통제를 장기간 복용하면 하부식도조임근의 이완이 떨어지며 하부식도 체부의 압력 및 속도가 증가하면서 식도 체부의 동시성 수축을 보이고 위식도 경계부의 압력이 증가하게 되면서 마치 식도 이완불능증 3형처럼 보이게 된다[32,45-47]. 이런 환자들에서 해당 약제를 중단하면 이러한 이상 소견이 일부 호전되고 삼킴곤란 등의 증상도 호전되는 것이 마약성 식도 기능 이상의 특징이라고 할 수 있다[32,45]. 따라서, 식도내압 검사 전에 평소 복용하고 있던 약제에 대해서도 자세하게 확인하는 것이 중요하다[32,45].
또한, 하부식도나 위식도 경계부에 발생한 암이나 폐암 중에서도 소세포암의 경우 종종 식도 이완불능증과 유사한 형태로 발현하기 때문에 진단에 있어 주의를 요한다[5]. 만약 1년 이하의 짧은 기간 내에 삼킴곤란이 생겼거나, 체중 감소가 있으면서 고령의 환자인 경우에는 CT 등의 검사를 통하여 2차적인 식도 이완불능 가능성을 감별하는 것이 필요하다.5 간혹 폐암 중에서도 소세포암의 경우에 신생물딸림 증후군(paraneoplastic syndrome)의 증상으로 2차적인 식도 이완불능을 보일 수 있고, 이런 경우 antineuronal nuclear antibody (anti-ANNA) 1 & 2, aka anti-Hu antibody 등의 검사가 도움이 될 수도 있다[5].
5. 치료
1) 약물 치료
칼슘통로 차단제, 질산염제재, 항콜린약제, 포스포다이에스터분해효소(phosphodiesterase) 등의 약제가 쓰일 수 있다. 하지만 이런 약제가 하부식도조임근 압력을 일시적으로 떨어뜨리는 효과는 있더라도 비교적 짧은 지속시간 때문에 여러 번 반복 투여를 요하다 보니, 두통, 저혈압, 부종 등의 부작용이 적지 않게 보고된다. 따라서 후술할 내시경 시술이나 수술적인 치료를 못하는 일부 환자들에서 고려할 수 있다[5,19,21].
2) 보튤리늄 독소 주사
내시경을 통하여 보튤리늄 독소를 주사하여 하부식도 및 하부식도조임근의 콜린성 자극을 막아서 근육의 일시적인 마비를 일으켜서 증상 개선을 노리는 치료로서, 대개 100 U의 보튤리늄 독소를 주사하게 된다. 부작용은 매우 낮다고 알려져 있으며, 315명을 대상으로 한 9개의 연구를 종합한 메타분석에 의하면 시술 30일 이내의 증상 개선율이 78% 정도로 알려져 있다[5,21,48]. 하지만 지속력은 떨어져서 12개월이 지나면 40% 정도만 증상 호전을 유지한다고 하며 결국 추가적인 보튤리늄 주사 치료나 기타 내시경적 치료 등이 필요하게 되므로 내시경 치료 등이 쉽지 않은 고령의 환자에서 일시적인 증상 개선을 노리고 시도해 볼 수 있을 것으로 생각된다[5,21].
3) 풍선 확장술
풍선을 하부식도조임근 주변으로 삽입하여 확장시키는 시술로서, 30, 35, 40 mm 지름의 풍선으로 늘려 나가는 식으로 진행한다[5]. 4,166명의 환자들이 포함된 52개의 연구를 대상으로 한 메타분석에 의하면, 3~6개월 추적에서 83%의 환자에서 증상 호전을 보였다[49]. 증상이 있는 위식도 역류가 6개월에 9% 정도 발생한다고 알려져 있고, 식도천공은 1.9% 정도로 알려져 있으며, 천공의 크기가 작을 때는 금식, 항생제 투여 또는 스텐트 삽입 정도의 보존적 처치로 충분하나, 천공의 크기가 클 경우에는 수술적인 처치가 요구된다[5,49]. 여러 가이드라인에 따르면 1형 또는 2형 식도 이완불능의 경우 풍선 확장술을 고려할 수 있을 것으로 생각된다[5,19,21,49].
4) 복강경 헬러 근절개술
복강경으로 식도 전벽으로 접근해서 식도 돌림근육층과 세로근육층을 위식도 경계부에서 상방으로 5~7 cm, 하방으로 2 cm 정도를 절개하는 것으로, 대체적으로 위식도 역류를 방지하기 위해서 위저부 주름술을 같이 시행하는 경우가 많다[5]. 대부분의 연구에서 5년 추적 검사에서 90% 이상의 증상 호전을 보였다고 보고하고 있다[5]. 수술의 합병증으로는 점막 천공, 비장 손상, 기흉 또는 출혈 등이 알려져 있으나 그 발생률은 매우 낮다고 알려져 있다[50].
5) 경구적 내시경 근절개술(peroral endoscopic myotomy, POEM)
2010년대에 들어서 행하여지고 있는 시술이다. 전신 마취하에서 중부 또는 하부식도의 점막 절개를 시행하고 이 절개부를 통해 내시경 선단을 넣어 점막하층으로 파고들어가 하부식도의 돌림근육층을 필요한 만큼 절개한 후 점막 절개 부위를 클립 등으로 봉합하는 시술이다[49].
POEM을 하는 방법에는 전방 혹은 후방 접근의 두 가지 방법이 있다. 환자가 앙와위 자세로 있는 상태에서 전방 근절개는 1시에서 2시 방향에 시술을 시행하고, 후방 근절개는 5시에서 6시 방향에 시술을 시행하게 된다[51]. 이론적으로, 전방 근절개는 항역류 기전으로 작용하는 His각(angle of His), 슬링 근섬유(sling muscle fiber)의 손상 위험을 줄일 수 있을 것으로 생각된다. 후방 근절개는 대부분 내시경 워킹채널이 5시에서 7시 사이에 위치하기 때문에, 근절개에 사용되는 내시경 도구와의 정렬면에서 우월할 수 있으나 항역류 기전을 담당하는 슬링근육(sling muscle)의 손상의 위험이 있을 수 있다. 하지만 1,247명의 환자를 대상으로 한 18개 연구를 분석한 메타분석에 따르면 전방 근절개와 후방 근절개 방법 사이에 치료 성공률, 위식도 역류, 부작용면에서 차이가 없었다[51]. 현재로서는 시술자의 재량에 따라 한 가지 방법을 선택하게 된다. 다만 이전 시술로 인한 손상이 없는 방향으로 접근하는 것이 합리적으로 보인다. 예를 들어서 전벽으로 접근하는 헬러 근절개술 후 치료에 실패한 경우에는 이전 접근한 방향과 다른 후방으로 POEM을 하는 것이 효과적일 수 있다[52].
POEM은 복강경 헬러 근절개술과 달리 필요한 만큼 근절개가 가능하므로 필요하다면 상부식도에서부터 상부 위부위까지 절개가 가능하다는 장점이 있다[49]. 따라서 3형 식도 이완불능에서 매우 도움이 되는 것으로 알려져 있으며, 물론 1, 2형 식도 이완불능에서도 시행이 가능하다[5,21,49]. 후술하겠지만, 1, 2, 3형 식도 이완불능 모두에서 기존에 쓰이던 풍선 확장술보다 나은 결과를 보이고 있다[53,54]. 하지만 POEM 시행 환자에서 헬러 근개술과 달리 위저부 주름술 등의 위식도 역류 방지 시술을 따로 하지 않기 때문에 상대적으로 위식도 역류가 잦다고 알려져 있다[5,29]. 2,373명의 환자들을 대상으로 한 36개의 연구를 바탕으로 한 메타분석에 의하면, 98%의 시술이 Eckardt 점수가 3점 이하로 성공적이었으나 비정상적인 위산 역류가 47%에서 관찰되었다고 하였다[55]. 하지만 최근 또 다른 연구에 의하면, POEM 시행 환자들에서 보행성 산도 검사를 통하여 확인한 바에 의하면 상당수 환자들에서 식도과민성에 의한 증상일 가능성도 제시하고 있어 추가적인 연구가 필요할 것으로 보인다[56].
500명을 대상으로 한 큰 규모의 단일기관 연구에 따르면 POEM의 합병증은 3.2%로 보고되었으며, 모든 경우에서 보존적 치료로 치료가 가능하였고 사망한 경우는 한 건도 없었다[57]. 흔한 합병증은 공기 주입과 연관된 합병증, 출혈, 점막천공이 있고, 상대적으로 흔하지 않은 합병증으로는 종격동염, 복막염, 흡인성 폐렴, 흉막 삼출이 있다[58]. 기복증, 종격동 기종, 피하기종과 같이 공기 주입과 연관된 합병증은 가장 흔한 합병증이며, 20%에서 30%의 환자에서 관찰되지만 증상과 연관성을 보이지 않고 무증상인 경우가 많다[59]. 하지만 긴장성 기복증과 같은 심각한 합병증이 발생한다면 복통 및 활력징후가 불안정해질 수 있고, 이런 경우 바늘감압술이 필요할 수도 있다[60]. 출혈은 1.1%에서 발생하고, 지연 출혈은 1% 미만에서 발생하는 것으로 보고되어 있다[59]. 점막천공은 시술자의 숙련도에 따라 0%에서 25%까지 다양하게 보고되고 있으나 보통 10% 미만에서 나타나며 대부분 내시경적으로 치료가 가능하다[57,61]. 식도누출의 경우 0.3%로 보고되어 있다[59].
POEM의 치료 성공률은 매우 높지만, 적은 수에서는 여전히 증상이 지속되거나 재발하는 경우가 생긴다. POEM 후에 증상이 지속되거나 재발한 경우 치료 방법에 대한 데이터는 많지 않으나, POEM을 다시 시행하거나 헬러 근절개술을 고려해 볼 수 있다. 한 단일기관 연구에 따르면 441명의 환자에 대해 POEM을 시행하였을 때, 3년 내에 43명(9.8%)의 환자에서 증상이 지속되거나 재발하였다. 증상이 지속되거나 재발한 환자 중 34명(8%)의 환자들은 재치료를 받았는데, 재치료로 복강경 헬러 근절개술은 45%, POEM은 63%에서 효과가 있었다. 반면에 풍선 확장술은 0%에서 20%로 상대적으로 효과가 좋지 않았다[62]. 한 다기관 연구에 따르면 46명의 환자에 대해 POEM 후 증상이 있어서 다시 POEM을 시행하였을 때, 모든 환자에서 기술적으로 성공하였고, 41명(85%)에서 Eckardt 점수가 3점 이하로 증상 호전을 보였다. POEM 후 증상이 지속되거나 재발한 경우 재치료 방법으로 POEM과 헬러 근절개술 중 어떤 방법이 더 우월한지에 대해서는 추후 무작위 대조군 연구 등의 추가 연구가 필요하다[63].
6) 치료 간의 비교
아직까지 장기간 비교 연구는 없으나 POEM과 복강경 헬러 근절개술 무작위 비교에서 비열등함이 증명되었고 증상 호전이 2년까지 유지되었다[64]. 하지만 위식도 역류가 POEM군에서 조금 더 많이 관찰되었다(POEM군에서 44% vs. 헬러 근절개술 및 위저부 주름술군에서 29%) [64]. 또 다른 POEM과 풍선 확장술 무작위 비교 연구에서는 풍선 확장술에 비해 POEM이 2년 관찰에서 훨씬 좋은 결과를 보였다(95% vs. 54%) [54]. POEM은 특히 3형 식도 이완불능증에서 효과적이었다[54].
7) 예후
합병증으로 흡인성 폐렴이나 호흡기 감염 그리고 편평세포식도암 등이 일반인에 상대적으로 높은 것으로 알려져 있고, 대부분의 식도암은 식도 이완불능 10년 이후에 관찰된다고 알려져 있다[65].
결 론
식도 이완불능은 최근 새로운 내시경 시술 및 새로운 진단법을 통하여 진단 및 치료가 계속해서 발전하고 있는 중이다. 이러한 새로운 진단 및 치료에 대한 충분한 이해를 통하여 삼킴곤란을 주소로 내원하는 환자들 진단한다면 거기에 맞는 올바른 치료를 할 수 있을 것으로 생각된다[32].
Acknowledgements
This study was financially supported by a grant of the Korean Society of Neurogastroenterology and Motility (KSNM-20-02).
Notes
No potential conflict of interest relevant to this article was reported.

