 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 19(3); 2019 > Article |
|
Abstract
Esophageal cancer is an aggressive malignant tumor with a poor prognosis because of its typically advanced stage at diagnosis and treatment-related morbidity and mortality. Of the two major subtypes, esophageal squamous cell carcinoma (ESCC) and esophageal adenocarcinoma, ESCC is prevalent in more than 90 percent of esophageal cancer patients in Korea. Both the incidence and mortality of esophageal cancer are declining, and the relative survival rate of patients with esophageal cancer has improved. These epidemiological changes are attributed to increase in the detection rate of esophageal cancer at localized and regional stages before distant spread of the disease. And the most well-known risk factors for esophageal adenocarcinoma are obesity and gastro-esophageal reflux disease. The carcinogenesis of ESCC is associated with chronic irritation caused by smoking, heavy alcohol use, drinking very hot beverages, and a low socioeconomic status. Understanding the risk factors for esophageal cancer can lead to the identification of preventative strategies to reduce the risk of developing esophageal cancer or to improve the long-term prognosis.
2012년 GLOBOCAN 자료에 의하면 전 세계적으로 식도암은 매해 456,000명이 발생하여 여덟 번째로 흔한 악성 종양이고, 약 400,100명이 사망하여 암으로 인한 사망 중 여섯 번째로 흔하며 전체 암 사망의 5%를 차지한다[1]. 식도암의 역학적 특성은 지역적으로 뚜렷한 차이를 보이는데, 동아시아 및 남아프리카와 동아프리카에서 가장 흔하며 전 세계 식도암의 약 80% 정도가 저개발국에서 발생한다. 식도암의 약 98%는 식도편평세포암종(esophageal squamous cell carcinoma)과 식도샘암종(esophageal adenocarcinoma)이 차지한다. 이 두 가지 암종은 식도암 발생의 다단계 암화 과정에서 유전 및 후생 유전학적으로 다른 경과를 보인다. 식도편평세포암종은 지속적으로 발암 물질에 노출되면서 기저세포 과증식에서 이형성이 진행하며 악성 종양이 발생하는 반면, 식도샘암종은 위산 역류로 인한 식도 점막의 만성 염증으로 인하여 특이적 장상피화생(specialized intestinal metaplasia)이 발생하여 바렛식도로 변화하고 점차 이형성으로 진행하며 악성 종양이 발생한다[2,3]. 본 고에서는 국내 식도암 역학 관련 현황과 추이 변화 및 그 위험인자에 대하여 주로 알아보고자 한다.
식도암은 전 세계적으로 남녀 모두에서 감소하는 추세이다. 식도편평세포암종은 과거 서구에서 가장 흔한 식도암의 조직학적 아형이었으나 최근 30년 동안 감소한 반면 북미, 캐나다와 유럽을 중심으로 비만 및 위식도 역류 질환(gastroesophageal reflux disease, GERD)의 증가와 비례하여 증가하는 경향을 보인다. 1975년부터 2009년까지 미국의 식도암 추이 분석 자료를 살펴보면 1998년 이후 식도샘암종이 지속적으로 증가하는 추세이다[4]. 아프리카와 중국과 일본을 포함한 아시아에서 식도편평세포암종이 가장 흔한 식도암으로, 우리나라에서도 식도암의 약 90% 이상이 식도편평세포암종이다. 2015년 한국중앙암등록사업(Korean Central Cancer Registry, KCCR)에 따르면 1년간 214,705명의 암 환자가 새로 발생하였고, 이 중 식도암 환자는 2,420명이 발생하였으며 남성이 2,201명으로 91%에 해당한다[5]. 연령 표준화 발생률은 인구 10만 명당 2.7명으로 남성 5.5명, 여성 0.4명이다. 조직학적 아형에 따른 발생 추이를 보면 조직학적 분류가 되지 않은 환자군을 제외하고 식도편평세포암종이 1999년에 92.5%에서 2013년에 96.0%이고, 식도샘암종은 양쪽 모두 3%로 비슷한 비율을 차지한다[6].
식도암의 병기별 발생 양상에 대한 국내 역학 자료는 매우 제한적으로, KCCR 자료를 기초로 한 Shin 등[6]의 분석에서 식도암의 surveillance, epidemiology, and end results 기준을 이용한 요약 병기에 따른 분류에서 국소 식도암(localized stage)은 2006~2009년 30.1%에서 2010~2013년 33.0%, 국소 진행 병기(regional stage)는 2006~2009년 30.1%에서 2010~2013년 32.7%로 증가하였다. 이는 전체 식도암 중 전이암(distant stage)과 진단되지 않은 식도암 환자의 비율이 감소하고, 치료가 가능한 국소 혹은 국소 진행 식도암이 증가한 것을 의미한다. 2015년 암으로 인한 사망이 전체 사망자의 27.9%를 차지하며, 이 중 식도암으로 인한 연령 표준화 사망률은 인구 10만 명당 1.6명, 남성 3.4명, 여성 0.2명이었다. 1999년 자료와 비교하면 식도암 발생률 및 사망률 모두 남녀에서 유의하게 감소하는 추세이다. 1993년부터 2013년까지 식도암 5년 생존율에 대한 추이 분석 결과, 식도암의 5년 생존율은 유의하게 향상되었다(Fig. 1). 조직학적 아형에 따른 식도암 사망률을 살펴보면, 식도편평세포암종은 5년 생존율이 1993~1995년 사이 12.1%에서 2009~2013년 34.6%로 뚜렷하게 상승하였고, 식도샘암종도 15.7%에서 29.6%로 역시 유의하게 증가하였으며, 두 조직학적 아형 사이에 생존율의 차이는 없었다. 특히 식도편평세포암종이 발생한 남성 환자에서 가장 큰 생존율의 향상이 관찰되었다[6].
식도암은 남성에서 호발하며 편평세포암종 및 식도샘암종 모두 남성에서 4~8배까지 호발한다. 식도암의 대표적인 위험인자는 흡연과 음주이다(Table 1). 식도암의 위험인자는 조직학적 아형에 따라 다르다. 식도샘암종과 연관성이 있는 대표적인 위험인자는 비만과 GERD이고, 편평세포암종과 연관성이 높은 위험인자는 음주와 흡연이다. 흡연은 샘암종 및 편평세포암종 모두의 위험인자로 알려져 있으며, 식도편평세포암종을 약 3~7배, 식도샘암종을 약 2배 가량 증가시킨다. 흡연과 함께 신선 야채나 과일을 부족하게 섭취하는 경우 편평세포암종의 위험도가 증가한다[7]. 최근 한국에서 흡연율이 현저히 감소하고 있으나 알코올 소비량은 매우 높아 고위험 음주자의 유병률은 남녀 모두에서 증가하는 추세이다(남성: 19.9% → 20.8%, 여성: 3.4% → 5.8%) [8,9]. 국내에서 진행된 빅데이터 연구에서 1일 30 g 이상의 술을 소비하는 경우를 고위험군으로 정의하였을 때 그렇지 않은 군에 비하여 음주량에 따라 식도암 발생이 유의하게 증가하였다(위험비 1.51, 95% 신뢰구간 1.43~1.60) [10]. 니트로소아민(nitrosoamine)이나 아세트알데히드(acetaldehyde)는 잘 알려진 발암인자로 식도암과 연관성이 있다. 음주 후 흡연을 시킨 동물 연구에서 비흡연군에 비하여 타액 내의 아세트알데히드의 농도가 증가하여 흡연과 음주는 식도암 발생에 시너지 효과가 있을 가능성을 제시하였다[11].
국민영양조사에 따르면 불충분하게 야채와 과일을 섭취하는 인구의 비율은 1998년에서 2012년 사이 큰 변화가 없다[12]. 총 야채와 과일 섭취량이 증가할수록 식도암 발생이 낮아, 1일 100 g 섭취량이 증가할수록 식도암 발생률이 11% 감소하였고, 특히 콜리플라워, 양배추, 무우, 겨자와 같은 십자화과 채소는 100 g 섭취 시 위험도(hazard ratio)가 0.44로 암 발생률을 낮추었다는 보고가 있다[13]. 붉은 고기와 가공육은 p16 유전자의 프로모터(promoter) 과메틸화를 유발하여 식도편평세포암종을 증가시킨다[14]. 또한 뜨거운 차를 지속적으로 마시는 등 만성적인 고온 손상은 p53 유전자의 CpG dinucleotide에서 somatic G>A transition을 유발하고 식도 점막 방어 기능을 저하시켜 식도암 발생을 증가시킨다[15,16]. 이외에도 식도이완불능증, 식도 부식성 손상으로 인한 만성 협착, 각화과다증(tylosis), Plummer-Vinson syndrome 등 만성 식도염이 유발될 수 있는 질환에서 식도암이 드물게 보고되고 있으나 이러한 질환 자체가 드물어, 고위험군으로 식도암 선별 검사가 필요한가에 대해서는 이견이 있다[3].
식도편평세포암종은 두경부 및 위장관 악성 종양에 이차성으로 흔히 발생하기도 한다. 구강/인두암이 있던 환자에서 식도편평세포암종의 표준화 발생비가 8.7배, 후두암에서는 4.7배 상승하였다[17]. 영상강화 내시경(image-enhanced endoscopy)을 이용하여 두경부암 환자에서 식도편평세포암종 여부를 본 연구에서 3.2~28.0%까지 증가하였고[18] 하인두암 치료 후 환자에서 이시성 식도암은 약 12.4배 증가하였다[19].
또한 사회경제적 상태가 낮을수록 식도편평세포암종의 위험도가 높아진다고 알려져 있는데, 위생 상태가 불량하고 식이습관, 생활패턴이나 발암인자에 노출될 기회가 높은 것과 연관이 있다[20]. 이는 식도샘암종에서도 공통된 위험인자로 사회경제적 수준이 낮은 경우 식도샘암종 발생 교차비가 증가하였다는 보고가 있다[21].
GERD는 식도샘암종의 중요한 위험인자로서 GERD의 증상이 심할수록, 병의 이환 기간이 길수록 암 발생률이 증가한다. 지역사회 기반 연구에서 GERD 증상이 1년 미만인 군에 비하여 증상이 1~5년인 군은 바렛식도의 위험도가 3.0배, 10년 이상인 경우 6.4배로 증가하였다[22]. GERD 증상이 반복적으로 있는 경우 무증상군에 비하여 식도샘암종에 대한 교차비가 7.7배로 증가하였다[23]. 성인에서 조직학적으로 확진된 바렛식도가 동반된 환자 중 정상 체중군에 비하여 체질량지수가 25 kg/m2 이상의 비만이 있으면 식도샘암종이 2.6배 호발하였다[24]. GERD가 있으면서 남성, 흡연, 음주 및 대사 증후군 등의 위험인자가 있는 경우 식도샘암종 발생률이 증가하였는데, 식도열 공탈장 및 복강 내 압력의 증가, 담즙 및 췌장액 역류의 호발 등이 발병 기전과 연관된다[25].
식도암은 진행암으로 발견되는 경우가 흔하고, 식도암 치료 자체로 인한 합병증 발생이 높아 예후가 안 좋은 암으로 알려져 있다. 국가암통계자료에 의하면 식도암 발생률 및 이로 인한 사망률이 증가되고 있는데, 이는 전이암 병기에 비하여 치료가 가능한 국소암 혹은 국소 진행암으로 발견되는 경우가 증가하고 있기 때문인 것으로 분석된다. 우리나라는 국가 암 검진으로 위암 검진이 시행되고 있는데, 위암뿐만 아니라 식도암, 특히 내시경 치료가 가능한 조기 식도암을 발견하려는 노력이 필요하다. 흡연은 식도편평세포암종과 식도샘암종 모두에서 공통된 위험인자이고, 만성 음주는 특히 식도편평세포암종 발생을 증가시킨다. 또한 사회경제적 수준이 낮은 계층에서 잘 발생하고, 야채나 과일을 적게 먹을수록 잘생기며, 두경부암 치료 후 이차적으로 발생하기도 한다. 이러한 위험인자와 병리 기전에 대한 이해는 식도암의 일차 및 이차 예방을 가능하게 하여 장기적으로 예후 향상에 기여할 것이다.
Fig. 1.
Five-year survival rate of people with esophageal cancer in Korea. This figure is reconstructed using KCCR data [5]. KCCR, Korean Central Cancer Registry.
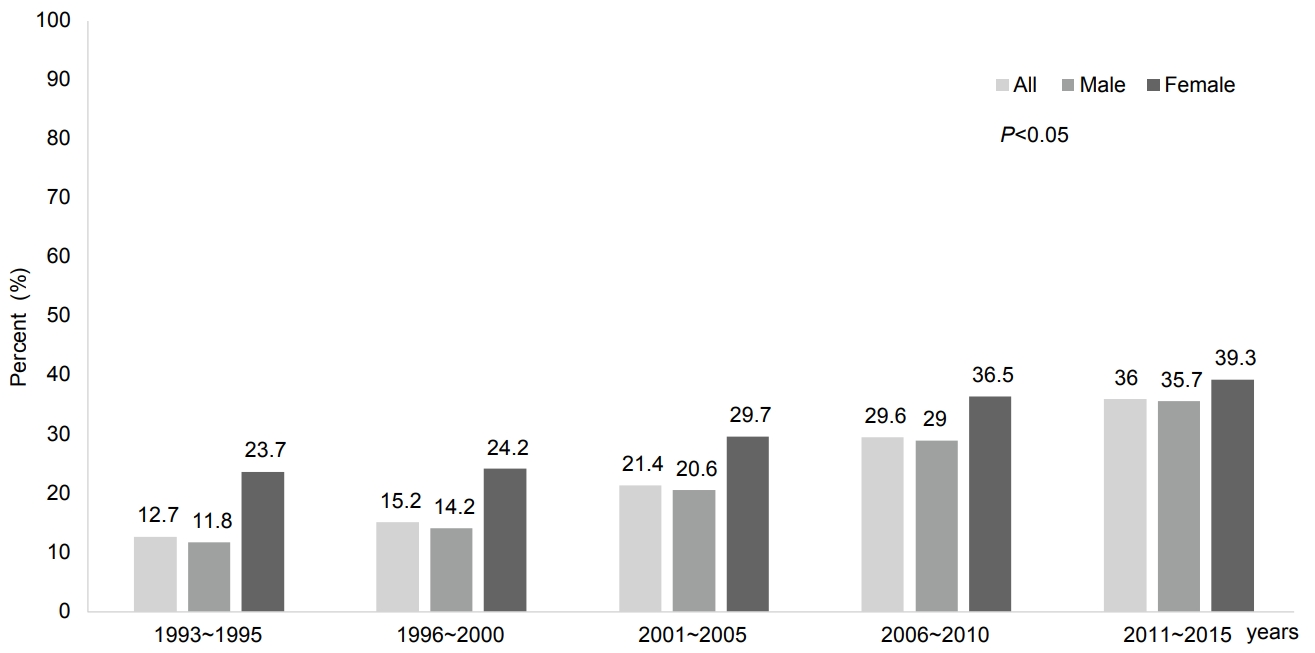
Table 1.
Risk Factors for Esophageal Carcinoma According to Histological Subtype
REFERENCES
1. Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015;136:E359–E386.


2. Peng DF, Hu TL, Soutto M, Belkhiri A, El-Rifai W. Loss of glutathione peroxidase 7 promotes TNF-α-induced NF-κB activation in Barrett's carcinogenesis. Carcinogenesis 2014;35:1620–1628.




3. Chung CS, Lee YC, Wu MS. Prevention strategies for esophageal cancer: perspectives of the East vs. West. Best Pract Res Clin Gastroenterol 2015;29:869–883.


4. Tevaarwerk AJ, Gray RJ, Schneider BP, et al. Survival in patients with metastatic recurrent breast cancer after adjuvant chemotherapy: little evidence of improvement over the past 30 years. Cancer 2013;119:1140–1148.


5. Jung KW, Won YJ, Kong HJ, Lee ES, Community of Population-Based Regional Cancer Registries. Cancer statistics in Korea: incidence, mortality, survival, and prevalence in 2015. Cancer Res Treat 2018;50:303–316.




6. Shin A, Won YJ, Jung HK, et al. Trends in incidence and survival of esophageal cancer in Korea: analysis of the Korea Central Cancer Registry Database. J Gastroenterol Hepatol 2018;33:1961–1968.



7. Norat T, Aune D, Chan D, Romaguera D. Fruits and vegetables: updating the epidemiologic evidence for the WCRF/AICR lifestyle recommendations for cancer prevention. Cancer Treat Res 2014;159:35–50.


8. Jee YH, Shin A, Lee JK, Oh CM. Decreases in smoking-related cancer mortality rates are associated with birth cohort effects in Korean men. Int J Environ Res Public Health 2016;13:1208.



9. Lobelo F, Heather AJ. Chronic disease is healthcare’s rising-risk, 2016 [Internet]. Health it Outcomes. [cited 2018 Feb 14]. Available from: https://www.healthitoutcomes.com/doc/chronic-disease-is-healthcare-s-rising-risk-0001.
10. Choi YJ, Lee DH, Han KD, et al. The relationship between drinking alcohol and esophageal, gastric or colorectal cancer: a nationwide population-based cohort study of South Korea. PLoS One 2017;12:e0185778.



11. Salaspuro V, Salaspuro M. Synergistic effect of alcohol drinking and smoking on in vivo acetaldehyde concentration in saliva. Int J Cancer 2004;111:480–483.


12. Kim EK, Ha AW, Choi EO, Ju SY. Analysis of Kimchi, vegetable and fruit consumption trends among Korean adults: data from the Korea National Health and Nutrition Examination Survey (1998-2012). Nutr Res Pract 2016;10:188–197.


13. Yamaji T, Inoue M, Sasazuki S, et al. Fruit and vegetable consumption and squamous cell carcinoma of the esophagus in Japan: the JPHC study. Int J Cancer 2008;123:1935–1940.


14. Chen W, Yang C, Yang L, et al. Association of roasting meat intake with the risk of esophageal squamous cell carcinoma of Kazakh Chinese via affecting promoter methylation of p16 gene. Asia Pac J Clin Nutr 2014;23:488–497.

15. Islami F, Boffetta P, Ren JS, Pedoeim L, Khatib D, Kamangar F. High-temperature beverages and foods and esophageal cancer risk--a systematic review. Int J Cancer 2009;125:491–524.



16. Pütz A, Hartmann AA, Fontes PR, et al. TP53 mutation pattern of esophageal squamous cell carcinomas in a high risk area (Southern Brazil): role of life style factors. Int J Cancer 2002;98:99–105.


17. Chen MC, Chen PT, Chan CH, et al. Second primary esophageal or lung cancer in patients with head and neck carcinoma in Taiwan: incidence and risk in relation to primary index tumor site. J Cancer Res Clin Oncol 2011;137:115–123.



18. Chung CS, Lee YC, Wang CP, et al. Secondary prevention of esophageal squamous cell carcinoma in areas where smoking, alcohol, and betel quid chewing are prevalent. J Formos Med Assoc 2010;109:408–421.


19. Chuang SC, Scelo G, Tonita JM, et al. Risk of second primary cancer among patients with head and neck cancers: a pooled analysis of 13 cancer registries. Int J Cancer 2008;123:2390–2396.


20. Kubo A, Levin TR, Block G, et al. Alcohol types and sociodemographic characteristics as risk factors for Barrett's esophagus. Gastroenterology 2009;136:806–815.


21. Brown LM, Silverman DT, Pottern LM, et al. Adenocarcinoma of the esophagus and esophagogastric junction in white men in the United States: alcohol, tobacco, and socioeconomic factors. Cancer Causes Control 1994;5:333–340.


22. Lieberman DA, Oehlke M, Helfand M. Risk factors for Barrett's esophagus in community-based practice. GORGE consortium. Gastroenterology Outcomes Research Group in Endoscopy. Am J Gastroenterol 1997;92:1293–1297.

23. Lagergren J, Bergström R, Lindgren A, Nyrén O. Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma. N Engl J Med 1999;340:825–831.


-
METRICS

-
- 7 Crossref
- 7,125 View
- 269 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Endoscopic Treatment for Esophageal Cancer2019 September;19(3)
Chemoradiotherapy for Esophageal Cancer2019 September;19(3)
Epidemiology of Helicobacter pylori Infection in Korea2011 June;11(1)
Epidemiology of Barrett's Esophagus2012 June;12(2)
Epidemiology of Adenocarcinoma of Esophagogastric Junction2012 September;12(3)






