 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 19(4); 2019 > Article |
|
Abstract
Background/Aims
Among irritants causing gastric ulcer, Helicobacter pylori (H. pylori) might be pivotal, after which eradication became essential way in either inhibiting ulcerogenesis or preventing ulcer recurrence. Since threonine is essential in either mucus synthesis or cytoprotection, we hypothesized that the dietary threonine from Corynebacterium glutamicum (C. glutamicum) can mitigate the cytotoxicity of H. pylori infection.
Materials and Methods
RGM-1 cells were challenged with 100 multiplicity of infection H. pylori for 6 hours, during which threonine alone or combination with Corynebacterium sp. was administered and compared for anti-Helicobacter, anti-inflammation, anti- oxidative, and cytoprotective actions.
Results
Threonine alone or combination of threonine and C. glutamicum yielded significant bacteriostatic outcomes. The increased expressions of interleukin (IL)-1╬▓, IL-8, Cox-2, and iNOS mRNA after H. pylori infection were significantly decreased with either threonine alone or the combination of threonine and C. glutamicum. The elevated expressions of NF-kB, HIF-1a, and c-jun after H. pylori infection were all significantly decreased with the combination of threonine and broth from C. glutamicum (P<0.05), leading to significant decreases in 2',7'-dichlorofluorescein-diacetate (P<0.01). Tracing further host antioxidative response, the attenuated expression of heme oxygenase-1, Nrf2, and dehydrogenase quinone-1 after H. pylori infection was significantly preserved with combination of threonine and C. glutamicum. H. pylori infection led to significant increases in apoptosis accompanied with Bcl-2 decreases and Bax increases, while the combination of threonine and C. glutamicum significantly attenuated apoptosis, in which attenuated EGF, TGF-╬▓, and VEGF were significantly regulated, while ╬▓-catenin did not change.
ņ£ä ņĪ░ņ¦ü ļ░░ņ¢æņØä ĒåĄĒĢ£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼(Helicobacter pylori)ĻĘĀņØś Ļ▓ĆņČ£ņØĆ ņŗżļĪ£ Ēśüļ¬ģņĀüņØĖ ļ░£Ļ▓¼ņØ┤ļŗż. ĻĖ░ņĪ┤ņØś pH 2ļéś 3 ņĀĢļÅäņØĖ ņĢäņŻ╝ Ļ░ĢļĀźĒĢ£ ņ£äņé░ ĒÖśĻ▓ĮņŚÉņä£ļŖö ņ¢┤ļŖÉ ĻĘĀļÅä ĻĄ░ļØĮĒÖöĒĢĀ ņłś ņŚåņØä Ļ▓āņØ┤ļØ╝ļŖö ņØ╝ļ░śņĀüņØĖ ļ»┐ņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ļ░░ņ¢æņØś ņä▒Ļ│ĄĻ│╝ ĒĢ©Ļ╗ś ļ░░ņ¢æļÉ£ ĻĘĀņŻ╝Ļ░Ć ņ£ä, ņŗŁņØ┤ņ¦Ćņן ĻČżņ¢æņØ┤ļéś ņ£äņŚ╝Ļ│╝ Ļ░ÖņØĆ ņ£ä ņ¦łĒÖśĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØä ĻĘ£ļ¬ģĒĢ£ ņŚģņĀüņ£╝ļĪ£ ĒśĖņŻ╝ņØś Marshall ļ░Ģņé¼ņÖĆ Warren ĻĄÉņłśļŖö 2005ļģä ļģĖļ▓© ņØśĒĢÖņāØļ”¼ĒĢÖņāüņØä ļ░øĻ▓ī ļÉśņŚłļŗż[1-3]. ņØ┤ļ¤¼ĒĢ£ ņä▒Ļ│╝ļŖö ņ×äņāüņŚÉņä£ ņ£ä ļ░Å ņŗŁņØ┤ņ¦Ćņן ĻČżņ¢æņØś ļ░£ņāØņØĆ ļ¼╝ļĪĀ ņ×¼ļ░£Ļ│╝ ĒĢ®ļ│æņ”ØņØś ļ░®ņ¦Ćļź╝ ņ£äĒĢ┤ņä£ļŖö ļ░śļō£ņŗ£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ļź╝ ņĀ£ĻĘĀņŗ£ņ╝£ņĢ╝ļ¦ī ĒĢ£ļŗżļŖö ņé¼ņŗżļĪ£ ņØ┤ņ¢┤ņĀĖ, ĻĖ░ņĪ┤ņØś ŌĆ£No acid, No ulcerŌĆØļØ╝ļŖö ņåīĒÖöņä▒ ĻČżņ¢æņØś ļ│æĒā£ņāØļ”¼ļź╝ ņÖäņĀäĒ׳ ļ│ĆĒÖöņŗ£ĒéżļŖö ĻĘĖņĢ╝ļ¦ÉļĪ£ Ēśüļ¬ģņĀüņØĖ ļ░£Ļ▓¼ņØ┤ļØ╝ ņ╣ŁĒĢĀ ņłś ņ׳ļŗż[4-6].
ļ╣äļĪØ ņ£äņĢö Ļ░äņØś ņŚ░Ļ┤ĆņŚÉņä£ļŖö ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņØ┤ ņäĖĻ│äļ│┤Ļ▒┤ĻĖ░ĻĄ¼ņŚÉņä£ ņĀ£1ĻĖē ļ░£ņĢöņØĖņ×ÉļĪ£ ņĀĢņØśļÉśĻĖ░ļŖö ĒĢśņśĆņ¦Ćļ¦ī, ļ░śļīĆļĪ£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ļŖö ĒĢśļéśņØś Ļ│ĄņāØņ▓┤ņØ╝ ņłś ņ׳ļŗż. ļśÉ ņÖäņĀäĒĢ£ ņĀ£ĻĘĀņØĆ ņé¼ņŗżņāü ļČłĻ░ĆļŖźĒĢśļ®░, ļ¦ÄņØĆ ņ×äņāüņŚÉņä£ ļ¬©ļōĀ ĻĘĀņØä Ļ╝Ł ņĀ£ĻĘĀņØä ņŗ£ņ╝£ņĢ╝ ĒĢ£ļŗżļŖö ļ¬ģĒÖĢĒĢ£ Ļ▓░ļĪĀņØ┤ ņĢäņ¦üĻ╣īņ¦ĆļŖö ļé┤ļĀżņ¦Ćņ¦Ć ņĢŖņĢä ņ¦ĆĻĖłļÅä ņØ┤ļź╝ ĻĘ£ļ¬ģĒĢśĻĖ░ ņ£äĒĢ£ ņłśļ¦ÄņØĆ ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ņ£ä, ņŗŁņØ┤ņ¦Ćņן ĻČżņ¢æĻ│╝ Ļ░ÖņØĆ ņ¢æņä▒ ņ¦łĒÖśņŚÉņä£ļŖö ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ņØś ĒÖ£ļÅÖņØä ņĀ£ĒĢ£ĒĢśĻ▒░ļéś Ļ░ÉņŚ╝ņŚÉ ļö░ļźĖ ņĀ£ļ░ś ļ│æĒā£ņāØļ”¼ļź╝ ņĪ░ņĀłĒĢśĻ│Ā, ņŚ╝ņ”Ø ĒśĖņĀäņØä ņ£äĒĢ£ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ĒĢśļŖö Ļ▓āņØ┤ ņŚ¼ļŖÉ ļŗżļźĖ ņ£ä ņĀÉļ¦ē ņ×ÉĻĘ╣ņØĖņ×ÉņŚÉ ļīĆĒĢ£ Ļ▓āļ│┤ļŗż ņÜ░ņäĀļÉśļŖö ņ╣śļŻī ļ¬®Ēæ£ļĪ£ ĒÖĢļ”ĮļÉśņŚłļŗż[7,8]. ļ╣äļĪØ ņ£äņĢöĻ│╝ņØś ņŚ░Ļ┤ĆņŚÉ ļīĆĒĢ┤ņä£ļŖö ņĢäņ¦üĻ╣īņ¦ĆļŖö ņĢĮĻ░ä ņāüļ░śļÉ£ ļ░░Ļ▓ĮņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā, ņ£ä ņ¦łĒÖśņØä ņ£Āļ░£ņŗ£Ēé¼ ņłś ņ׳ļŖö ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć Ļ│ĄĻ▓®ņØĖņ×É, ņ”ē ņ£äņé░, ĒØĪņŚ░, ņĢīņĮöņś¼, ņŖżĒŖĖļĀłņŖż, ļŗ┤ņ”Öņé░, Ļ░üņóģ ņĢĮļ¼╝ ļō▒ ļŗżņ¢æĒĢ£ ņÜöņØĖ ņżæņŚÉņä£ļŖö ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ņĀ£ņ¢┤ ļśÉļŖö ņĀ£ĻĘĀņØ┤ ņŚ¼ņĀäĒ׳ Ēü░ ļ╣äņżæņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż[9]. ņØĖĻ░äņØś Ļ▓ĮņÜ░ ņĢĮĻ░ä ļ¬ģĒÖĢĒĢśņ¦ĆļŖö ņĢŖņ¦Ćļ¦ī ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĻĘĀņŻ╝ņŚÉ ļīĆĒĢ£ ņĪ░ņĀł Ļ░ĆņØ┤ļō£ļØ╝ņØĖņØ┤ ņ׳ļŖö Ļ▓āņŚÉ ļ╣äĒĢśņŚ¼ Ļ░ĆņČĢņØ┤ļéś ļÅÖļ¼╝ņŚÉņä£ļŖö ņØ┤ļ¤░ Ļ░ĆņØ┤ļō£ļØ╝ņØĖņØ┤ ņŚåĻ│Ā, ņĢäņ¦üļÅä ņāüļŗ╣ĒĢ£ ņłśņżĆņØś ĒÅÉņé¼Ļ░Ć ļ¼ĖņĀ£Ļ░Ć ļÉśĻ│Ā ņ׳ļŖö ļÅ╝ņ¦ĆņØś ņśłņÖĆ Ļ░ÖņØ┤ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņØ┤ ņŗ¼Ļ░üĒĢśĻ▓ī Ļ▒┤Ļ░ĢņØä ĒĢ┤ņ╣śļŖö ņÜöņØĖņØ┤ļØ╝ ĒĢĀ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņé¼ļ×ī ņØ┤ņāüņ£╝ļĪ£ ņČĢņé░ ļÅÖļ¼╝ņŚÉĻ▓ī ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņØĆ ļśÉ ĒĢśļéśņØś ĒĢ┤Ļ▓░ļÉśņ¢┤ņĢ╝ ĒĢśļŖö ņŗ£ĻĖēĒĢ£ ļ»ĖņČ®ņĪ▒ ņØśļŻī ņłśņÜö(unmet medical needs)ņØĖ Ļ▓āņØ┤ļŗż[10,11].
ĻĘĖļ¤░ļŹ░ ņØ┤ļ¤¼ĒĢ£ ņ”ØĻ░ĆļÉ£ Ļ│ĄĻ▓®ņØĖņ×ÉņÖĆ ĒĢ©Ļ╗ś ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ ņŗ£ņŚÉļŖö ļ░®ņ¢┤ņØĖņ×ÉņØś ņĢĮĒÖöĻ░Ć ĻČżņ¢æņØś ļ░£ņāØ ļ░Å ņĢöĒÖö ļō▒ņŚÉļÅä Ļ┤ĆņŚ¼ĒĢśļŖöļŹ░ ņŗż ņśłļź╝ ļōżļ®┤, ņ£äņĀÉņĢĪņØś ņĢĮĒÖöļéś ņ£äņĀÉļ¦ē ņäĖĒż ņ×¼ņāØņØś ņ¦ĆņŚ░ ĻĘĖļ”¼Ļ│Ā ļČłņČ®ļČäĒĢ£ ņäĖĒż ļ│┤ĒśĖ ņ×æņÜ® ļō▒ļÅä ņ£ä ņ¦łĒÖś ļ░£ņāØņŚÉ ņżæņÜöĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņ×äņāüņŚÉņä£ļŖö ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ņØś ņĪ░ņĀłĻ│╝ ĒĢ©Ļ╗ś ņØ┤ļōż ļ░®ņ¢┤ņØĖņ×É ņ”ØĻ░ĢņØ┤ ņ╣śļŻīņØś ļśÉ ļŗżļźĖ ņČĢņØä ņ░©ņ¦ĆĒĢ£ļŗż[12,13]. ņ”ē, ņ£äņĀÉņĢĪņØś ņ£Āņ¦Ć, ņ£äņĀÉļ¦ē ņāüĒö╝ņäĖĒżņØś ņ×¼ņāØ ļ░Å ņ£Āņ¦Ć, ņ£äĒśłļźśļ¤ē ņ£Āņ¦Ć ļ░Å ņ£ä ļ│┤ĒśĖņŗĀĻ▓Į Ļ░ĢĒÖö ļ░Å prostaglandin (PG) ņ£Āņ¦Ć ļō▒ņØ┤ ņĢäņŻ╝ ņżæņÜöĒĢ£ ļ░®ņ¢┤ņØĖņ×É ņ▓┤Ļ│äņØĖļŹ░, ņØ┤ ņżæņŚÉņä£ ĒŖ╣Ē׳ ņ£äņĀÉņĢĪ ņāØņä▒ ļ░Å ņĀÉņĢĪ ņåŹ PG ņ£Āņ¦ĆĻ░Ć ņĢäņŻ╝ ĻĘ╝ļ│ĖņĀüņØ┤ļ®░, ļŹö ĻĄ¼ņ▓┤ņĀüņ£╝ļĪ£ļŖö PGļź╝ ĒżĒĢ©ĒĢ£ ņ£äņĀÉņĢĪ ņāØņä▒ ņ”ØĻ░ĆĻ░Ć ņżæņÜöĒĢśļŗżĻ│Ā ĒĢśĻ▓Āļŗż[14].
ņĀĆņ×ÉļōżņØĆ ņØ┤ļ»Ė ĻĄ¼ņåŹ ļ░Å ņ╣©ņłś ņŖżĒŖĖļĀłņŖż(water immersion restraint stress)ņŚÉ ļģĖņČ£ņŗ£ņ╝£ ņ£äĻČżņ¢æņØä ņ£Āļ░£ņŗ£Ēé© ļ¬©ļŹĖņŚÉņä£ threonine Ļ│╝ļ”ĮņØ┤ ņĀÉņĢĪ ņāØņä▒ ņ”ØĻ░Ć ļ░Å ĒĢŁņŚ╝ņ”Ø/ĒĢŁņé░ĒÖö ņ×æņÜ® ļō▒ņŚÉ ĻĘ╝Ļ▒░ĒĢśņŚ¼ ņ£ĀņØśĒĢ£ ĒĢŁĻČżņ¢æ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ļŖö Ļ▓āņØä ņ”Øļ¬ģĒĢśņśĆļŗż[15]. ņØ┤ņŚÉ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ ņŗ£ threonine Ļ│╝ļ”ĮņØś ļ│┤ĒśĖ ĒÜ©ļŖźņØĆ ļ¼╝ļĪĀ threonineņØä ļ¦īļōżņ¢┤ ļé┤ļŖö Corynebacterium glutamicum (C. glutamicum)ņØä ĒżĒĢ©ĒĢ£ Corynebacterium species (sp.) ĻĘĀņŻ╝ņÖĆņØś ļ│æĒĢ® Ēł¼ņŚ¼ņŚÉ ļö░ļØ╝ ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ĒÜ©ļŖźņØĆ ļ¼╝ļĪĀ Ļ░üņóģ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ņŚ░Ļ┤Ć ļ│æĒā£ņāØļ”¼ĒĢÖņĀü ļ░śņØæņØ┤ Ļ░ÉņåīļÉśļŖöņ¦Ć ļō▒ņØä ĻĘ£ļ¬ģĒĢśĻ│Ā, ļśÉĒĢ£ threonine Ļ│╝ļ”ĮņØĆ Ēśäņ×¼ ņé¼ļ×īņØä ļīĆņāüņ£╝ļĪ£ ĒĢśļŖö ņŗØņØ┤ ņä▒ļČäļ│┤ļŗżļŖö Ļ░ĆņČĢņØ┤ļéś ļÅÖļ¼╝ļōżņŚÉĻ▓īņä£ ņ£äņן ļ│┤ĒśĖ ĒÜ©ļŖźņØ┤ ņØĖņĀĢļÉśņ¢┤ ņé¼ļŻī ļō▒ņ£╝ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŖö ļ░ö[16-18], ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢśņŚ¼ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņŚÉ ļīĆĒĢ£ threonine Ļ│╝ļ”ĮņØś ņ£äņן ļ│┤ĒśĖ ĒÜ©ļŖźņŚÉ ļīĆĒĢśņŚ¼ ļŹö ĒÖĢņŗżĒĢ£ ĻĘ╝Ļ▒░ļź╝ ņĀ£Ļ│ĄĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ļ│Ė ņŚ░ĻĄ¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż.
ņĀĢņāü wistar rat ņ£äņĀÉļ¦ē ņäĖĒżņŻ╝ņØĖ RGM-1 ņäĖĒżļŖö 10%ņØś fetal bovine serumņØ┤ ĒżĒĢ©ļÉ£ DulbeccoŌĆÖs modified essential medium (DMEM)Ļ│╝ Ham F12 Ēś╝ĒĢ®ļ░░ņ¦ĆņŚÉņä£ 37Ōäā ņäĖĒż ļ░░ņ¢æĻĖ░(95% air, 5% CO2)ļĪ£ ļ░░ņ¢æĒĢśņśĆļŗż. ļ│Ė ņäĖĒżņŻ╝ļŖö ņØ╝ļ│Ė Tsukuba ļīĆĒĢÖņØś Matsui ĻĄÉņłśņŚÉ ņØśĒĢśņŚ¼ ņłśļ”ĮļÉśņŚłļŖöļŹ░ ļÅÖņØś ĒøäņŚÉ ļ│Ė ņŚ░ĻĄ¼ļź╝ ņ£äĒĢśņŚ¼ ņĀ£Ļ│ĄļÉśņŚłļŗż.
ņØ┤ ņŗżĒŚśņŚÉ ņé¼ņÜ®ļÉ£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ĻĘĀņŻ╝(cytotoxin-associated gene A+ strain, NCTC 11637)ļŖö American Type Culture Collection (ATCC, Rockville, MD, USA)ņ£╝ļĪ£ļČĆĒä░ ĻĄ¼ņ×ģĒĢśņśĆļŗż. ĻĘĀņŻ╝ļŖö 5% bovine calf serumĻ│╝ ĒĢŁņāØņĀ£Ļ░Ć ņ▓©Ļ░ĆļÉ£ brucella brothņŚÉņä£ 1├Ś108 CFU/mL (optical density [OD] 600=1)ņØ┤ ļÉĀ ļĢīĻ╣īņ¦Ć 10% CO2 ņĪ░Ļ▒┤ņŚÉņä£ ņ¦äĒāĢ ļ░░ņ¢æĒĢśņśĆļŗż. ņäĖĒżņŚÉņä£ņØś Ļ░ÉņŚ╝ ļŗżņżæļÅä(multiplicity of infection, MOI)ļŖö 100:1ļĪ£ ņé¼ņÜ®ĒĢśņśĆļŗż. ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ļŖź ņĖĪņĀĢņŚÉļŖö disk diffusion assayņÖĆ ĻĘĀņŻ╝ ļ░░ņ¢æņĢĪņØś OD ņĖĪņĀĢņØä ĒåĄĒĢ£ ņä▒ņן ņāüĒā£ļź╝ ņĖĪņĀĢĒĢśļŖö ļæÉ Ļ░Ćņ¦Ć ļ░®ļ▓ĢņØä ļ¬©ļæÉ ņé¼ņÜ®ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļź╝ Ļ░£ņŗ£ĒĢśĻĖ░ ņĀä ļ░░Ļ▓Į ņŚ░ĻĄ¼ļĪ£ ņŗ£Ē¢ēĒĢ£ Supplementary Fig. 1ņŚÉņä£ņÖĆ Ļ░ÖņØ┤ disk ņŻ╝ņ£äņØś ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ļŖźņŚÉ ņØśĒĢ£ ņÜ®Ēśł(hemolysis) Ļ▓░Ļ│╝ņŚÉ ļö░ļØ╝ ņāØņä▒ Ļ┤Ćņ░░ļÉśļŖö Ēł¼ļ¬ģĒĢ£ haloļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ThreonineņØś ļåŹļÅäņŚÉ ļö░ļØ╝ ņĢäņŻ╝ ļŗżņ¢æĒĢ£ Ēü¼ĻĖ░ņØś ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ļŖźņŚÉ ņØśĒĢ£ Ēł¼ļ¬ģĒĢ£ haloĻ░Ć ĒśĢņä▒ļÉśņŚłĻ│Ā, ņØ┤ ņŗżĒŚśņØä 3ļ▓ł ņØ┤ņāü ļ░śļ│ĄĒĢśņŚ¼ ĒÅēĻĘĀņĀü ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒÜ©ļŖźņØä ĻĘ£ņĀĢĒĢśņśĆļŗż. ņĀĆņ×ÉļōżņØĆ ņśłļ╣ä ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢśņŚ¼ ļŗżņ¢æĒĢ£ ļåŹļÅäņØś threonineņØś ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ĒÜ©ļŖźņØä ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ļ░░ņ¢æ ņĀäņÜ® blood agar plateņŚÉņä£ ņĖĪņĀĢĒĢśņŚ¼ ļ│Ė Ļ▓░Ļ│╝ ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒÜ©ļŖźņØä 60%, 65% ļ░Å 70% ļåŹļÅäņŚÉņä£ Ļ┤Ćņ░░ņØä ĒĢśņśĆĻĖ░ņŚÉ, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö threonineņØä ņāØņä▒ĒĢśļŖö C. glutamicum ĻĘĀņŻ╝ņÖĆņØś ļ│æĒĢ® Ēł¼ņŚ¼ņŚÉ ļö░ļźĖ ņĀ£ļ░ś ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ņĀ£ĒĢ£ ĻĖ░ļŖźņØä ņŚ░ĻĄ¼ĒĢ£ Ļ▓āņØ┤ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØ┤ļ¤¼ĒĢ£ ļ░░Ļ▓Į ņŚ░ĻĄ¼ņŚÉ ĻĖ░ļ░śĒĢśņŚ¼ Table 1ņŚÉ ņĀ£ņŗ£ĒĢ£ Ļ▓āĻ│╝ Ļ░ÖņØ┤ ņ┤Ø 8Ļ░£ņØś ĻĄ░ņ£╝ļĪ£ ĻĄ¼ļČäĒĢśņŚ¼ threonine ļŗ©ļÅģĻ│╝ ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć Corynebacterium sp. ņÖĆņØś ļ│æĒĢ®ņ£╝ļĪ£ ĻĄ░ņØä ĻĄ¼ņä▒ĒĢśņśĆļŗż.
ņäĖĒżļź╝ 48-well dishņŚÉ 1├Ś104Ļ░£/wellļĪ£ ļÅäĒżĒĢ£ ļŗżņØī DMEM ļ░░ņ¦ĆņŚÉņä£ ļ░░ņ¢æĒĢśņśĆļŗż. ņØ┤Ēøä Ļ░üĻ░üņØś ņŗ£ņĢĮņØä ņØ╝ņĀĢ ņŗ£Ļ░ä ņ▓śļ”¼ĒĢśņŚ¼ MTT solution (ņĄ£ņóģ ļåŹļÅä 1 mg/mL)ņØä Ļ░ĆĒĢśĻ│Ā 2ņŗ£Ļ░ä ļÅÖņĢł ļ░śņØæĒĢ£ Ēøä dimethyl sulfoxideļĪ£ ņÜ®ĒĢ┤ņŗ£Ēé© Ēøä 540 nmņŚÉņä£ ODļź╝ microplate readerļĪ£ ņĖĪņĀĢĒĢśņśĆļŗż.
RNAļŖö TRIzol (Gibco BRL, Rockville, MD, USA)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņČöņČ£ĒĢśņśĆņ£╝ļ®░, ņČöņČ£ļÉ£ RNAļŖö Moloney murine leukemia virus ņŚŁņĀäņé¼ĒÜ©ņåī(Perkin Elmer, Morrisville, NC, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ cDNAļĪ£ ĒĢ®ņä▒ĒĢśņśĆļŗż. PCR ļČäņäØņŚÉ ņé¼ņÜ®ļÉ£ Ļ░üĻ░üņØś primer ņä£ņŚ┤ņØĆ Table 1ņŚÉ ļéśĒāĆļé┤ņŚłņ£╝ļ®░, internal standardļĪ£ņä£ glyceraldehyde 3-phosphate dehydrogenase (GAPDH)ļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż.
ļ░░ņ¢æļÉ£ ņäĖĒżļź╝ phosphate buffered saline ņÜ®ņĢĪņ£╝ļĪ£ ņäĖņ▓ÖĒĢ£ Ēøä, cell lysis buffer (150 mM NaCl, 0.5% triton├Ś100, 50 mM tris-HCl, pH 7.4, 25 mM NaF, 20 mM ethyleneglycol-bis [╬▓-aminoethylether]-N, NŌĆÖ-tetraacetic acid, 1 mM dithiothreitol, 1 mM Na3VO4, Protease Inhibitor Cocktail tablet [Boehringer, Manneim, Germany])ļĪ£ ņÜ®ĒĢ┤ņŗ£ņ╝£ protein lysateļź╝ ļ¦īļōżņŚłļŗż. ņØ┤Ļ▓āņØä sodium dodecyl sulfate-polyacrylamide gel electrophoresisļĪ£ ņĀäĻĖ░ ņśüļÅÖĒĢ£ Ēøä ņĀäĻ░£ņŗ£Ēé© ļŗ©ļ░▒ņ¦łņØä PVDF membrane (Gelman Sciences, Ann Arbor, MI, USA)ņŚÉ ņś«Ļ▓© Ļ░üĻ░üņØś primary antibodyņÖĆ secondary antibodyļĪ£ ļ░śņØæņŗ£Ēé© Ēøä, chemoluminescence systemņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż.
24 well plateņŚÉ 5├Ś105/wellņØś RGM-1 ņäĖĒżļź╝ ļČäņŻ╝ĒĢśĻ│Ā 37Ōäā ņäĖĒż ļ░░ņ¢æĻĖ░(95% air, 5% CO2)ņŚÉņä£ ļ░żņāł ļ░░ņ¢æ Ēøä Ļ░üĻ░üņØś ņŗ£ņĢĮņØä ņØ╝ņĀĢ ņŗ£Ļ░ä ņ▓śļ”¼ĒĢśņśĆļŗż. DMEMņ£╝ļĪ£ ņäĖĒżļź╝ ņö╗ņ¢┤ļéĖ Ēøä 10 ╬╝g/mL DCF-DA (Sigma-Aldrich Co., St. Louis, MO, USA)ļź╝ ļ░░ņ¦ĆņŚÉ ņ▓©Ļ░ĆĒĢśņŚ¼ ņØĖĒüÉļ▓ĀņØ┤Ēä░ņŚÉņä£ 30ļČä ļÅÖņĢł ļ░░ņ¢æĒĢśņśĆļŗż. ļ░░ņ¢æ Ēøä 4ŌäāņØś phosphate-buffered saline (PBS)ļĪ£ ņö╗ņ¢┤ļéĖ ņäĖĒżļź╝ ĒśĢĻ┤æ Ēśäļ»ĖĻ▓Įņ£╝ļĪ£ Ļ┤Ćņ░░ ļ░Å ņ┤¼ņśüĒĢśņśĆļŗż.
DNA ļČäņĀł ĒśäņāüņØä TUNELņØś ļ░®ļ▓Ģņ£╝ļĪ£ ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņäĖĒżļź╝ Lab-Tek chamber slideņŚÉ 1├Ś105Ļ░£/chamberļĪ£ ļČäņŻ╝ĒĢ£ ļŗżņØī 37Ōäā ņäĖĒż ļ░░ņ¢æĻĖ░(95% air, 5% CO2)ļĪ£ ļ░░ņ¢æĒĢśņśĆļŗż. ņØ┤Ēøä Ļ░üĻ░üņØś ņŗ£ņĢĮņØä ņØ╝ņĀĢ ņŗ£Ļ░ä ņ▓śļ”¼ĒĢ£ Ēøä apoptosis detection kit(invitrogen, Denver, CO, USA)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņĀ£ņĪ░ĒÜīņé¼ņØś ņŗżĒŚś ļ░®ļ▓ĢļīĆļĪ£ ņŗ£Ē¢ēĒĢśņśĆļŗż. ļ░░ņ¢æņĢĪņØä ņĀ£Ļ▒░ĒĢśĻ│Ā PBSļĪ£ 3ĒÜī ņäĖņ▓Ö Ēøä 4% paraformaldehydeļź╝ ņ▓©Ļ░ĆĒĢśņŚ¼ ņāüņś©ņŚÉņä£ 20ļČäĻ░ä Ļ│ĀņĀĢĒĢśņśĆļŗż. PBSļĪ£ ļŗżņŗ£ 2ĒÜī ņäĖņ▓Ö Ēøä 0.1% triton X-100ņØä 4ŌäāņŚÉņä£ 5ļČäĻ░ä ņ▓śņ╣śĒĢśĻ│Ā terminal deoxynucleotidyl transferaseņÖĆ nucleotide mixtureļź╝ Ēś╝ĒĢ®ĒĢśņŚ¼ ļ¦īļōĀ ņÜ®ņĢĪņ£╝ļĪ£ 37ŌäāņŚÉņä£ ļ╣øņØä ņ░©ļŗ©ĒĢ£ Ēøä 60ļČäĻ░ä ļ░śņØæņŗ£ņ╝░ļŗż. PBSļĪ£ ņäĖņ▓ÖĒĢśĻ│Ā ļé£ Ēøä, ĒśĢĻ┤æ Ēśäļ»ĖĻ▓Įņ£╝ļĪ£ ņäĖĒżņ×Éļ®Ėņé¼ļź╝ Ļ┤Ćņ░░ĒĢśņśĆļŗż.
Fig. 1AņÖĆ 1BņŚÉņä£ņÖĆ Ļ░ÖņØ┤ 6ņŗ£Ļ░ä ļÅÖņĢł 100 MOI ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ļź╝ ņ£äņĀÉļ¦ē ņāüĒö╝ņäĖĒżņŚÉ Ļ░ÉņŚ╝ņŗ£Ēé© Ļ▓ĮņÜ░ ņŚ╝ņ”Ø ļ¦żĻ░£ņØĖņ×ÉņØĖ IL-1╬▓, IL-8, Cox-2, iNOS mRNAĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆļÉ©ņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż(P<0.01). Western blotņ£╝ļĪ£ ļŗ©ļ░▒ņ¦łņŚÉņä£ļÅä ņ£ĀņØśĒĢ£ ņ”ØĻ░Ćļź╝ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöļŖö ņØ┤ļź╝ ņżæĻ░£ĒĢśļŖö NF-╬║B p65ņÖĆ Ļ░ÖņØĆ ņĀäņé¼ņØĖņ×ÉņØś ĒÖ£ņä▒ĒÖö ņ”ØĻ░ĆņÖĆ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņŚłļŗż(P<0.05; Fig. 1). ĻĘĖļ¤¼ļéś ņØ┤ļ¤¼ĒĢ£ ļ░░Ļ▓Į ĒĢśņŚÉ threonineņØ┤ļéś threonineņØä ņāØņä▒ĒĢĀ ņłś ņ׳ļŖö Corynebacteria sp.ņÖĆņØś ņĖĪņĀĢņØä ĒåĄĒĢśņŚ¼ Ļ┤Ćņ░░ĒĢ£ Ļ░üĻ░ü ĻĘĖļŻ╣ Ļ░äņØś ļ│ĆĒÖöļŖö Fig. 1ņŚÉņä£ ļ│┤ņŚ¼ņŻ╝ļō»ņØ┤ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ threonine Ēł¼ņŚ¼ĻĄ░ņŚÉņä£ ļ¬©ļæÉ ņ£ĀņØśĒĢ£ ļ│ĆĒÖöļź╝ ļ│┤ņŚ¼, Cox-2, iNOSļŖö ļ¼╝ļĪĀ NF-╬║B ļ╣äĒÖ£ņä▒ĒÖöļĪ£ ņØ┤ņ¢┤ņĪīĻ│Ā(P<0.05), ĒŖ╣Ē׳ group 6Ļ│╝ 7ņŚÉņä£ Ļ░Ćņן ņ£ĀņØśĒĢ£ ļ│ĆĒÖöļź╝ ļ│┤ņŚ¼ņŻ╝ņ¢┤ ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö threonine ļŗ©ļÅģņØ┤ļéś ņØ┤ļź╝ ņāØņä▒ĒĢĀ ņłś ņ׳ļŖö CorynebacteriumĻĘĀņŻ╝ņØś brothņÖĆņØś ļ│æĒĢ®ņ£╝ļĪ£ ļŹöņÜ▒ ļæÉļō£ļ¤¼ņ¦ĆļŖö Ļ▓░Ļ│╝ņŚÉ ĻĖ░ņ┤łĒĢśņŚ¼ threonineņØ┤ ņ£äņĀÉļ¦ē ņāüĒö╝ņäĖĒżņŚÉņä£ ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĻĖ░ļŖźņØä ņ£ĀļÅäĒĢ©ņØä ņĢī ņłś ņ׳ņŚłļŗż.
Fig. 2AņÖĆ 2BļŖö ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ Ēøä oxidative stressņÖĆ ņŚ░Ļ┤ĆļÉ£ HIF-1╬▒ņÖĆ acute phase responseļź╝ ņĀäņé¼ĒĢśļŖö c-FosņÖĆ c-JunņØś ļ│ĆĒÖöļź╝ Western blotņ£╝ļĪ£ ņĖĪņĀĢĒĢ£ Ļ▓āņ£╝ļĪ£, ĒŚ¼ ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝(6ņŗ£Ļ░ä, 100 MOI)ņŚÉ ņØśĒĢśņŚ¼ ņ£ĀņØśĒĢśĻ▓ī acute phase response geneņØ┤ ņ”ØĻ░ĆĒĢśļ®░, ļÅÖņŗ£ņŚÉ HIF-1╬▒ņØś ņ”ØĻ░Ćļź╝ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż. ļ░śļ®┤ņŚÉ threonine ļŗ©ļÅģņØ┤ļéś ņāØņä▒ ĻĘĀņŻ╝ņÖĆņØś ļ│æĒĢ® Ēł¼ņŚ¼ņŚÉ ļö░ļØ╝ ņ£ĀņØśĒĢ£ ļ│ĆĒÖöļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłļŖöļŹ░, ĻĄ¼ņ▓┤ņĀüņ£╝ļĪ£ ĒŖ╣Ē׳ group 6Ļ│╝ group 7ņŚÉņä£ ņĢäņŻ╝ ņ£ĀņØśĒĢ£ HIF-1╬▒ņØś Ļ░Éņåīļź╝ ļ│┤ņØĖ ļ░śļ®┤ņŚÉ c-JunĻ│╝ c-FosļŖö group 3ņŚÉņä£ ņ£ĀņØśĒĢ£ Ļ░Éņåīļź╝, c-FosņØś Ļ▓ĮņÜ░ņŚÉļŖö ļ░śļīĆļĪ£ group 6ņŚÉņä£ ņ£ĀņØśĒĢ£ ņ”ØĻ░Ćļź╝ ļ│┤ņŚ¼ņä£ ņØ┤ļ¤¼ĒĢ£ acute phase responderņØś ĒĢĄļé┤ ņØ┤ļÅÖņØś ļ│ĆĒÖöļŖö threonine Ēł¼ņŚ¼Ļ░Ć ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņŚÉ ņ”ēĻ░üņĀüņØĖ ņāØņ▓┤ ļ░śņØæņØä ļ│┤ņŚ¼ņŻ╝ļŖö ņŗØņØ┤ņØĖņ×ÉņØ╝ ņłś ņ׳ņØīņØä ņŗ£ņé¼ĒĢśļŖö ņåīĻ▓¼ņØ┤ļØ╝ ĒĢśĻ▓Āļŗż. ņØ┤ļ¤¼ĒĢ£ ņāØņ▓┤ ļ░śņØæ, ĒŖ╣Ē׳ oxidative stressļź╝ ņŗ£Ļ░üĒÖöĒĢśĻĖ░ ņ£äĒĢśņŚ¼ DCF-DA probeļź╝ ĒÖ£ņÜ®ĒĢ£ DCF ļ░£Ēśä ļ░śņØæņØä confocal imagerļĪ£ ļČäņäØĒĢ£ Fig. 2CņØś Ļ▓░Ļ│╝ļź╝ ļ│┤ļ®┤ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ Ēøä ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆļÉ£ DCFļŖö group 1, 3Ļ│╝ 6ņŚÉņä£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīļÉ©ņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż(P<0.05). Ļ▓░ļĪĀņĀüņ£╝ļĪ£ threonine ļŗ©ļÅģņØ┤ļéś ņØ┤ļź╝ ņāØņä▒ĒĢśļŖö CorynebacteriumņØś Ēł¼ņŚ¼ļŖö ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ņŚÉ ņØśĒĢ£ oxidative stressļéś hypoxia responseļź╝ ņ”ēĻ░üņĀüņ£╝ļĪ£ ļīĆņ▓śĒĢ©ņØä ņĢī ņłś ņ׳ņŚłļŗż.
Fig. 3AņŚÉņä£ļŖö ļīĆĒæ£ņĀüņØĖ host cytoprotective factorņØĖ ĒĢŁņé░ĒÖö ĻĖ░ļŖźņØä ļ│┤ņØ┤ļŖö heme oxygenase-1 (HO-1)Ļ│╝ heat shock protein 70 (HSP70) mRNAļź╝ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ ĒøäņÖĆ Ļ░ü ĻĄ░ Ļ░äņØś ļ░£Ēśä ļ│ĆĒÖöļź╝ ņé┤ĒÄ┤ļ│Ė ļ░ö, ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ Ēøä ļ░£ņāØĒĢśļŖö oxidative stress ļ░Å ņäĖĒż ņé¼ļ®ĖņŚÉļŖö HO-1 ļ░Å HSP70 mRNAņØś ņ£ĀņØśĒĢ£ Ļ░ÉņåīĻ░Ć Ļ┤Ćņ░░ļÉśņŚłņ£╝ļéś(P<0.001), ļ░śļ®┤ņŚÉ Fig. 3AņÖĆ 3BņŚÉņä£ Ļ┤Ćņ░░ļÉśļō»ņØ┤ group 6ņŚÉņä£ ņ£ĀņØśĒĢ£ Nrf2 ņ”ØĻ░ĆņŚÉ ļö░ļźĖ HO-1ņØś ņ”ØĻ░Ćļź╝ ļ│╝ ņłś ņ׳ņŚłļŗż(P<0.001). HSP70ņØś ļ│ĆĒÖöļŖö group 7 ļ░Å group 8ņŚÉņä£ ļæÉļō£ļ¤¼ņ¦ĆĻ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ HO-1ņØä ĒżĒĢ©ĒĢ£ ļŗżļźĖ glutathione-s-transferase ļ░Å NADH dehydrogenase quinone-1 (NQO-1)Ļ│╝ Ļ░ÖņØĆ HO-1ņŚÉ ĒżĒĢ©ļÉśļŖö ņĀäļ░śņĀüņØĖ host defense anti-oxidative responseņŚÉ ļīĆĒĢ£ ļ│ĆĒÖöļź╝ ņČöĻ░ĆĒĢśņŚ¼ ņĖĪņĀĢĒĢśņŚ¼ ļ│Ė ļ░ö, Fig. 3CņŚÉņä£ņÖĆ Ļ░ÖņØ┤ threonine ļŗ©ļÅģņØ┤ļéś CorynebacteriumĻ│╝ņØś ļ│æĒĢ®ņØĆ Nrf-2 ĻĖ░ļ░śņØś HO-1 ļ░śņØæņŚÉ ņŻ╝ļĪ£ ĻĖ░ļ░śĒĢśļŖö ĒĢŁņé░ĒÖö ņ×æņÜ®ņØä ļ│┤ņØ┤ļ®░, ņØ┤ļŖö ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ņŚÉ ņŻ╝ĒÜ©ĒĢśļŖö ļČäņ×ÉņāØļ¼╝ĒĢÖņĀü ļ░śņØæņ×äņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż.
ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņØĆ ņäĖĒż ņé¼ļ®ĖņØś ņ£ĀņØśĒĢ£ ņ”ØĻ░ĆņŚÉ ņØśĒĢśņŚ¼ ņĀÉļ¦ē ņåÉņāü ļ░Å ĻČżņ¢æņØä ņ£Āļ░£ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņל ņĢīļĀżņĀĖ ņ׳ļŗż. Fig. 4AņŚÉņä£ļÅä ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ ĒøäņŚÉļŖö ņäĖĒż ņé¼ļ®Ė ņ¢ĄņĀ£ ļŗ©ļ░▒ņØĖ Bcl-2ņØś Ļ░ÉņåīņÖĆ ņäĖĒż ņé¼ļ®Ė ņ£ĀņĀäņ×ÉņØĖ BaxņØś ņ”ØĻ░Ćļź╝ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłĻ│Ā, ņØ┤ļź╝ in situļĪ£ ņ”Øļ╣ÖĒĢśĻĖ░ ņ£äĒĢ£ Fig. 4BņØś TUNEL ņŚ╝ņāēņŚÉņä£ļÅä ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ apoptosisņØś ņ”ØĻ░ĆĻ░Ć ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ ņØ┤ĒøäņŚÉ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļéś(P<0.01), ļ░śļ®┤ņŚÉ threonine ļŗ©ļÅģņØ┤ļéś Corynebacterium ļÅÖņŗ£ Ēł¼ņŚ¼ĻĄ░ņŚÉņä£ļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ apoptosisņØś Ļ░Éņåīļź╝ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż(P<0.001; Fig. 5A).
Fig. 5BņŚÉņä£ļŖö ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ņŚ░Ļ┤Ć ņäĖĒż ņä▒ņן, ĒśłĻ┤Ć ņä▒ņן ĻĘĖļ”¼Ļ│Ā Fig. 5AņŚÉņä£ļŖö ņāüĒö╝ņäĖĒż ņ”ØņŗØņØĖņ×ÉņŚÉ ļīĆĒĢśņŚ¼ ņé┤ĒÄ┤ļ│┤ņĢśļŗż. ņØ┤ļ»Ė ļ│┤Ļ│ĀļÉ£ ļ░öņÖĆ Ļ░ÖņØ┤ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ ĒøäņŚÉļŖö EGF, PDGFR, TGF-╬▓ ļ░Å VEGFņØś ņ£ĀņØśĒĢ£ ņ”ØĻ░Ćļź╝ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŖöļŹ░(P<0.01), ņØ┤ļ¤¼ĒĢ£ ņåīĻ▓¼ņØĆ ņĢ×ņŚÉņä£ ņØ┤ļ»Ė ņåīĻ░£ļÉ£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņŚÉ ļö░ļźĖ ņŚ╝ņ”Ø ņ”ØĻ░ĆņØś Ļ▓░Ļ│╝ļĪ£ ņĀÉļ¦ē ĒŚłĒśł(ischemia) ņ£ĀļÅäņŚÉ ļö░ļźĖ ņØ┤ņ░©ņĀüņØĖ ļ│ĆĒÖöņÖĆ ņØ╝ņ╣śĒĢśļŖö ņåīĻ▓¼ņØ┤ļ®░, ņ”ØĻ░ĆļÉ£ ņØ┤ļōż ņä▒ņןņØĖņ×ÉļŖö ļ¼┤ļČäļ│äĒĢ£ ņĀÉļ¦ē ņ”ØņŗØņØ┤ļéś ņĢöņä▒ ņŚ╝ņ”ØņØä ņĪ░ņןĒĢĀ ņłś ņ׳Ļ│Ā, ņŚŁņ£╝ļĪ£ ņŚ┤ņĢģĒĢ£ ņ£äņĀÉļ¦ē ņŚ╝ņ”Ø ĒÖśĻ▓ĮņØä ļ░śņśüĒĢ┤ņŻ╝ļŖö Ļ▓░Ļ│╝ļØ╝ ĒĢĀ ņłś ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöņÖĆ ļŗ¼ļ”¼(P<0.01) threonine ļŗ©ļÅģņØ┤ļéś CorynebacteriumĻ│╝ņØś ļ│æĒĢ® Ēł¼ņŚ¼ļŖö ņØ┤ļź╝ ņ£ĀņØśņä▒ņØ┤ ņ׳Ļ▓ī ņĪ░ņĀłĒĢĀ ņłś ņ׳ņŚłĻ│Ā, ĒŖ╣Ē׳ ņĢ×ņäĀ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒĢśĻ▓ī group 6ņØ┤ļéś group 7ņŚÉņä£ņØś ļŹöņÜ▒ ĒśäņĀĆĒĢ£ ļ│ĆĒÖöļź╝ ļ│┤ņŚ¼, ņĀäņ▓┤ņĀüņ£╝ļĪ£ threonine Ēł¼ņŚ¼ļŖö ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņŚÉ ņØśĒĢ£ ņĀ£ļ░ś ņŚ╝ņ”ØņØ┤ļéś ņĢöĒÖöļź╝ ņÖäĒÖöņŗ£Ēé¼ ņłś ņ׳ļŗżļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ĻĘĖļ¤¼ļéś ╬▓-catenin ĒÖ£ņä▒ĒÖöņŚÉ ļö░ļźĖ ņäĖĒż ņ”ØņŗØ ņĖĪļ®┤ņŚÉņä£ļŖö ņ£ĀņØśĒĢ£ ļ│ĆĒÖöĻ░Ć Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŖöļŹ░(Fig. 5B), ņØ┤ļŖö ļ│Ė ņŚ░ĻĄ¼ņØś 100 MOI, 6ņŗ£Ļ░ä Ļ░ÉņŚ╝ņØĆ ņĢäņ¦ü ╬▓-cateninņØś ņ£ĀņØśĒĢ£ ļ│ĆĒÖöļź╝ ņ£ĀļÅäĒĢśļŖö phaseļŖö ņĢäļŗłĻĖ░ ļĢīļ¼ĖņØĖ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉśļéś nuclear fractionņØä ĒÖ£ņÜ®ĒĢ£ ╬▓-cateninņØś nuclear transfer ņŚ░ĻĄ¼ņŚÉņä£ļŖö group 6ņŚÉņä£ ņØ┤ļ»Ė ╬▓-catenin nuclear transferļź╝ ņØ┤ļ»Ė 6ņŗ£Ļ░äņŚÉņä£ļÅä ņĀĆĒĢ┤ņŗ£Ēé¼ ņłś ņ׳ņØīņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż.
Disc diffusion assay ļ░®ļ▓ĢņØä ņé¼ņÜ®ĒĢśņŚ¼ blood agar plateņŚÉņä£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ņŚÉ ļīĆĒĢ£ bactericidal ĒÜ©ļŖźņØä ņĖĪņĀĢĒĢśņśĆļŖöļŹ░, ņØ┤ņĀä ņśłļ╣ä ņŗżĒŚś(Supplementary Fig. 1)ņŚÉņä£ threonine ļŗ©ļÅģņ£╝ļĪ£ļÅä ņ£ĀņØśĒĢ£ ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ĒÜ©ļŖźņØ┤ ņ׳ņØīņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ļ░░Ļ▓Į ņŚ░ĻĄ¼ļź╝ ĻĘ╝Ļ▒░ļĪ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö threonineņØä ņāØņä▒ņŗ£ĒéżļŖö ĻĘĀņŻ╝ņØĖ CorynebacteriaņÖĆņØś ļ│æĒĢ®ņŚÉ ļö░ļźĖ ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ĒÜ©ļŖźņØä ņĖĪņĀĢĒĢśņŚ¼ Fig. 6Ļ│╝ Ļ░ÖņØĆ Ļ▓░Ļ│╝ļź╝ ņ¢╗ņŚłļŗż. Threonine Ļ▓░Ļ│╝ļź╝ ļ░░Ļ▓Įņ£╝ļĪ£ Ēł¼ņŚ¼ņŗ£Ēé© threonineņØĆ CorynebacteriumņŚÉ ņØśĒĢśņŚ¼ ņāØņä▒ņØ┤ ļÉśļ»ĆļĪ£, ļŗżņØīņ£╝ļĪ£ļŖö C. glutamicum, C. ammoniagenes ĻĘĖļ”¼Ļ│Ā ļŗżļźĖ Corynebacterium sp. Ļ░üĻ░üņØś ĻĘĀņŻ╝ ļśÉļŖö ņØ┤ļōż ĻĘĀņŻ╝ļź╝ ļ░░ņ¢æĒĢ£ brothļź╝ ļ│æĒĢ®ĒĢśņŚ¼ Table 2ņÖĆ Ļ░ÖņØĆ ņĪ░ĒĢ®ņ£╝ļĪ£ agar diffusion assay ļ░®ļ▓Ģņ£╝ļĪ£ ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ĒÜ©ļŖźņØä ļ╣äĻĄÉĒĢśņŚ¼ ļ│┤ņĢśļŗż. Fig. 6AņÖĆ Ļ░ÖņØĆ threonine Ļ│╝ļ”ĮņØś ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ĒÜ©ļŖźņØ┤ threonineņŚÉ ĒŖ╣ņØ┤ĒĢ©ņØä ņ”Øļ╣ÖĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝, group 6Ļ│╝ group 7Ļ│╝ Ļ░ÖņØ┤ threonine Ļ│╝ļ”ĮĻ│╝ C. glutamicumĻ│╝ Ļ░ÖņØĆ threonine ņāØņä▒Ļ░ĆļŖź ĻĘĀņŻ╝ņØś brothļź╝ Ļ░ÖņØ┤ ļäŻņØĆ ĻĄ░ņŚÉņä£ Ļ░Ćņן ņ£ĀņØśĒĢ£ ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ▓░Ļ│╝ļź╝ ņ¢╗ņŚłļŗż. ņØ┤ļź╝ ņóĆ ļŹö ņ”Øļ╣ÖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņ¢╗ņ¢┤ņ¦ä brothļź╝ 1/4, 1/40 ĻĘĖļ”¼Ļ│Ā 1/100ļĪ£ ĒؼņäØĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ņØś Ļ▓░Ļ│╝ļź╝ ĒåĄĒĢ®ĒĢśņŚ¼ņä£ļÅä Ļ░ÖņØĆ Ļ▓░Ļ│╝ļź╝ ņ¢╗ņØä ņłś ņ׳ņ¢┤(Supplementary Fig. 2), ņØ┤ņāüņØś Ļ▓░Ļ│╝ļŖö threonine Ļ│╝ļ”Į ļŗ©ļÅģņØĆ ļ¼╝ļĪĀ ņØ┤ļź╝ ņāØņä▒ĒĢśļŖö ĻĘĀņŻ╝ņÖĆņØś ļ│æņÜ®ņ£╝ļĪ£ ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒÜ©ļŖźņØ┤ ņ׳ņØīņØä ņ”Øļ╣ÖĒĢĀ ņłś ņ׳ņŚłļŗż.
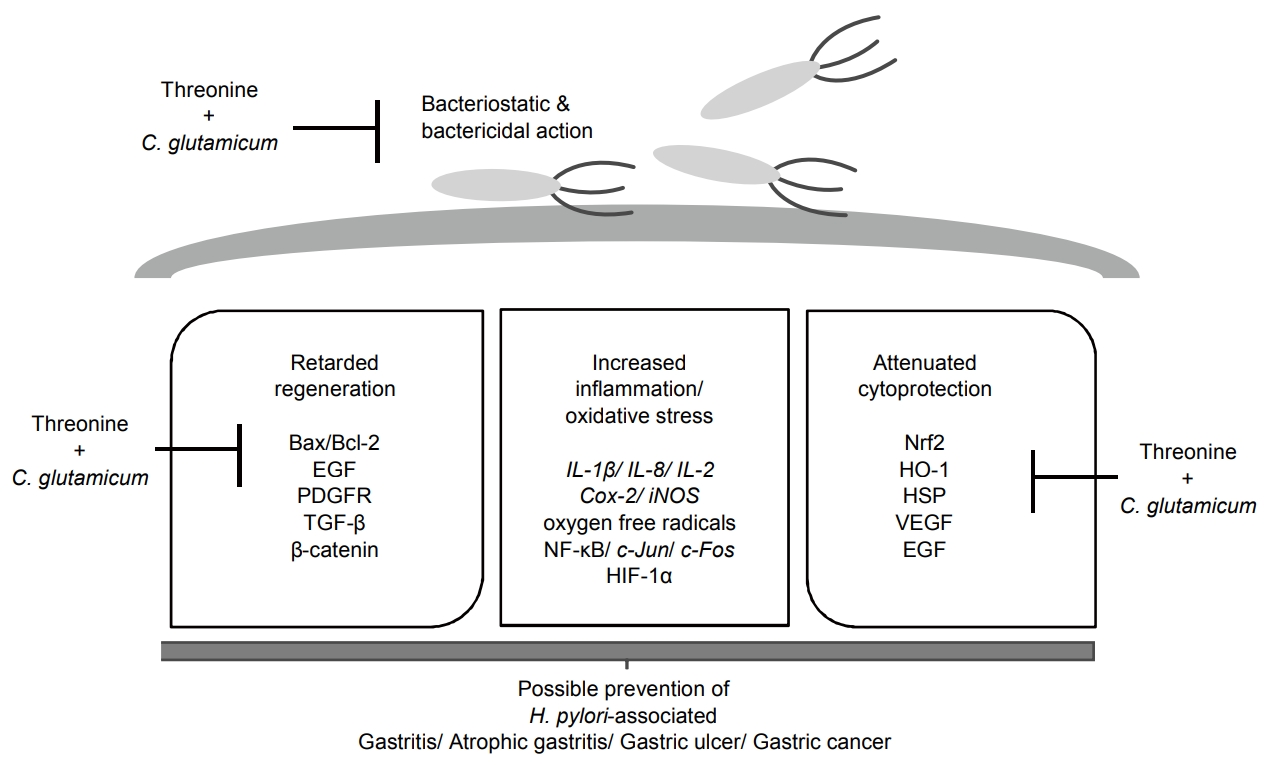
ņØ┤ņāüņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ Fig. 7ņŚÉ Ļ░äļץĒ׳ ņĀĢļ”¼ ļ░Å ņÜöņĢĮĒĢśņśĆļŖö ļ░ö, ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņØĆ IL-1╬▓, IL-8, IL-2, Cox-2, iNOS, NF-╬║B ĒÖ£ņä▒, c-JunĻ│╝ c-Fos ņ”ØĻ░Ć ĻĘĖļ”¼Ļ│Ā HIF-1╬▒ņØś ņ”ØĻ░ĆņŚÉ ĻĖ░ļ░śĒĢśņŚ¼ ĻĖēņä▒/ļ¦īņä▒ ņ£äņŚ╝ņØĆ ļ¼╝ļĪĀ ļ¦īņä▒ ņ£äņČĢņä▒ ņ£äņŚ╝ņØ┤ļéś ņĀäņĢö ļ│æļ│ĆņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ņĢöĒÖöļź╝ ņ£ĀļÅäĒĢ£ļŗż. ņØ┤ļ¤¼ĒĢ£ ļ│æĒā£ņāØļ”¼ļź╝ ņ”ØĻ░Ģņŗ£ĒéżļŖö ļśÉ ļŗżļźĖ ĻĖ░ņĀäņ£╝ļĪ£ Nrf-2, HO-1, Ļ░üņóģ growth factors ļō▒Ļ│╝ Ļ░ÖņØĆ cytoprotectionņØś ņĢĮĒÖöņŚÉ ļö░ļØ╝ ņ×äņāüņĀüņ£╝ļĪ£ļŖö ņ£ä, ņŗŁņØ┤ņ¦Ćņן ĻČżņ¢æ ļ░£ņāØ ņ”ØĻ░Ć ļ░Å ĻČżņ¢æņØś ņ╣śņ£ĀĻ░Ć ļŖ”ņ¢┤ņ¦ĆĻ│Ā, oxidative stress ĻĖēņ”ØņŚÉ ļö░ļźĖ ņäĖĒż ļ│┤ĒśĖ Ļ░Éņåī ĻĘĖļ”¼Ļ│Ā ņŗżņ¦łņĀüņØĖ apoptosisņØś ņ”ØĻ░ĆņÖĆ ņØ┤ĒøäņØś ņĀüņĀłĒĢ£ ņäĖĒż ņä▒ņן ņĪ░ņĀłņØś ņŗżĒī©ņŚÉ ļö░ļźĖ ņĢöĒÖöņØś ļŗ©ņ┤łĻ░Ć ņĀ£Ļ│ĄņØ┤ ļÉśļŖö Ļ▓āņ£╝ļĪ£ ņĢäņŻ╝ ņל ļ░ØĒśĆņĀĖ ņ׳ļŗż[1-3]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØ┤ļ¤¼ĒĢ£ ļ░®ņ¢┤ņØĖņ×ÉņØś Ļ░ÉņåīņÖĆ Ļ░ÖņØĆ ļ░░Ļ▓ĮņŚÉ ļīĆĒĢśņŚ¼ threonine ļŗ©ļÅģ Ēł¼ņŚ¼ļŖö ļ¼╝ļĪĀ ņØ┤ļź╝ ņāØņä▒ĒĢśļŖö ĻĘĀņŻ╝ņØĖ Corynebacterium, ĒŖ╣Ē׳ C. glutamicumņØś ļ│æņÜ® Ēł¼ņŚ¼ļŖö Ļ░Ćņן ņ£ĀņÜ®ĒĢ£ ĒĢŁĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ĒÜ©ļŖźĻ│╝ ĒĢ©Ļ╗ś ņ£äņŚÉ ņŚ┤Ļ▒░ĒĢ£ Ļ░ÉņŚ╝ņŚÉ ļö░ļźĖ ņĀ£ļ░ś ļ│æĒā£ņāØļ”¼ĒĢÖņĀü ĻĖ░ņĀäņØä ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ņĀĆĒĢ┤ĒĢśņŚ¼ņżīņØä ņ”Øļ╣ÖĒĢĀ ņłś ņ׳ņ¢┤, ņØ┤ļź╝ ņØæņÜ®ĒĢśļ®┤ threonineņØĆ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņØ┤ļéś ĻĖ░ĒāĆņØś ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ņ£äņĀÉļ¦ē ņ×ÉĻĘ╣ ļ¼╝ņ¦łņØś ņ”ØĻ░Ć ņāüĒÖ®ņŚÉņä£ ņØ┤ļź╝ ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ļ░®ņ¢┤Ļ░Ć Ļ░ĆļŖźĒĢ£ ņ╣śļŻīņĀ£ļĪ£ņä£ņØś Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗżĻ│Ā ĒĢśĻ▓Āļŗż.
ĻĘĖļ¤¼ļ»ĆļĪ£ ņØ┤ļź╝ ņØĖņ▓┤ ņ¦łĒÖśņŚÉļÅä ņØæņÜ®ņØ┤ Ļ░ĆļŖźĒĢśļéś ņØ┤ļ»Ė ņØĖĻ░äņØĆ threonineļź╝ ĒĢ©ņ£ĀĒĢ£ ļ¦ÄņØĆ ņØīņŗØņØ┤ļéś ņŗØĒÆłņØä ņČ®ļČäĒ׳ ņäŁņĘ©ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ, ņØ┤ļ¤¼ĒĢ£ Ļ░ÉņŚ╝ņŚÉ ļö░ļźĖ ĻĘ╝ļ│ĖņĀüņØĖ ņśüņ¢æ Ļ│ĄĻĖēĻ│╝ Ļ░ÖņØĆ ļīĆņ▒ģņØ┤ Ļ▒░ņØś ņŚåļŖö ļÅÖļ¼╝ņØ┤ļéś Ļ░ĆņČĢņØś ņé¼ļŻīļĪ£ņØś ĒÖ£ņÜ® ļō▒ņ£╝ļĪ£ ĻĖ░ļīĆĻ░Ć ļÉśĻ▓Āļŗż[11,12].
ņ£äņןņØś ļ░®ņ¢┤ņØĖņ×É ņżæ Ļ░Ćņן ņĄ£ņĀäņäĀņŚÉ ņ׳Ļ│Ā ņżæņÜöĒĢśļ®░ pH 2, 3Ļ│╝ Ļ░ÖņØĆ Ļ░Ģņé░ņØś ņ£äņé░ņØä ņżæĒÖöņŗ£Ēé¼ ņłś ņ׳ļŖö ļ░®ņ¢┤ĻĖ░ņĀäņØ┤ ļ░öļĪ£ mucinņØś ĒĢ®ņä▒ņØĖļŹ░, HCO3-ļź╝ ļ│┤ņ£ĀĒĢśĻ│Ā pepsin ļŗ©ļ░▒ ļČäĒĢ┤ļź╝ ņ¢ĄņĀ£ņŗ£Ēé¼ ņłś ņ׳Ļ│Ā, ņØĖņ¦Ćņ¦łņØś ļČłņłśņÜ® ņä▒ņ¦łņØä ņ£Āņ¦Ćņŗ£ņ╝£ņŻ╝ļ®░, ņĀÉņĢĪ gradientļź╝ ļ¦īļōżņ¢┤ ņŻ╝ļŖö ņ£ĀņÜ®ĒĢ£ ņĀÉņĢĪņ¦łņØ┤ ļ░®ņ¢┤ĻĖ░ņĀä ņżæņŚÉ ņĢäņŻ╝ ņżæņÜöĒĢśļŗż ĒĢśĻ▓Āļŗż. ņØ┤ļ¤¼ĒĢ£ ņ£ä mucinņØĆ ņ£äĒæ£ļ®┤ ņĀÉļ¦ēņäĖĒżļéś ņ£äĻ▓ĮļČĆ ņĀÉņĢĪņäĖĒżņŚÉņä£ ņāØņä▒ļÉśļ®░, ĒÅ┤ļ”¼ļ©Ėļź╝ ĒśĢņä▒ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ disulfide bridgeļĪ£ ņĀæļ¬®ļÉ£ glycoprotein subunitņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŖöļŹ░, ņØ┤ļĢī ļŗ╣ņćäļĪ£ ĻĄ¼ņä▒ļÉ£ ņĢäļ»ĖļģĖņé░ ļ╝łļīĆĻ░Ć ĻĄ¼ņĪ░ņāü Ļ░Ćņן ņżæņÜöĒĢśļŗż. ņØ┤ ņČĢņŚÉņä£ ļ░öļĪ£ threonineņØ┤ ņŻ╝ņÜö ĻĄ¼ņä▒ņøÉņØ┤ļ»ĆļĪ£, threonineņØś ņäŁņĘ©ļŖö ņØ┤ļ¤¼ĒĢ£ ļŗ╣ĒÖö ļ░śņØæņØś ņ”ØĻ░Ć ļ░Å ņČĢĒśĢņä▒ņ£╝ļĪ£ ņ¢æņ¦łņØś mucinņØ┤ ņāØņä▒ļÉśĻ▓ī ĒĢśļ»ĆļĪ£ ņĀäņ▓┤ņĀüņ£╝ļĪ£ ņ£ä ļ░®ņ¢┤ņØĖņ×ÉņØś ņ”ØĻ░Ćļź╝ Ļ░ĆņĀĖņśżĻ▓ī ļÉ£ļŗż. ņØ┤ļ¤¼ĒĢ£ ņČĢņØś ņ×æņÜ®ņŚÉ ļīĆĒĢ┤ņä£ļŖö ņĢäņ¦ü ĻĘ£ļ¬ģļÉśņ¦Ć ļ¬╗ĒĢśĻ│Ā ņ׳ņŚłņ£╝ļéś, ņĀĆņ×ÉļōżņØĆ ņłśņ╣© ļ░Å ĻĄ¼ņåŹ ņŖżĒŖĖļĀłņŖż ļ¬©ļŹĖņØ┤ļéś ļŗżļźĖ ĒÖöĒĢÖņĀü ņ×ÉĻĘ╣ ļ¬©ļŹĖ ņŚ░ĻĄ¼ņŚÉņä£ ņČöĻ░ĆņĀüņØĖ ļ░®ņ¢┤ņØĖņ×É ņ”ØĻ░Ģ ĻĖ░ļŖźņØä ĻĘ£ļ¬ģĒĢ£ ļ░ö ņ׳ļŗż[15,16,19-21].
ņĢłņĀĢņä▒ņØ┤ ļåÆĻ│Ā ļŹö ļ¦ÄņØĆ ĒÜ©ļŖźņØ┤ ĻĖ░ļīĆļÉśļŖö threonineņØä ņāØņä▒ Ļ░ĆļŖźĒĢ£ C. glutamicumņØĆ L-threonine ņāØņä▒ņØä ĒĢśļŖö ņĢäņŻ╝ ņżæņÜöĒĢ£ ĻĘĀņŻ╝ņØĖļŹ░, ņØ┤ļ¤¼ĒĢ£ ĻĖ░ņłĀņØĆ ņØ┤ļ»Ė 2000ļģäĻ▓ĮņŚÉ ņÖäņä▒ņØ┤ ļÉśņŚłļŗż. ņäĖĻĘĀņØ┤ ņĢäļ»ĖļģĖņé░ ņāØņä▒ņŚÉ ĒĢäņÜöĒĢ£ ĒÄ®ĒāĆņØ┤ļō£ļź╝ ņČ®ļČäĒ׳ ņäŁņĘ©ĒĢśĻ│ĀņØ┤ļź╝ ņ▓śļ”¼ĒĢ©ņ£╝ļĪ£ņŹ©, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ĒāĆĒéĘņØä ĒĢśļŖö L-threonine ņØ┤ņÖĖņŚÉļÅä L-lysine, putrescineĻ│╝ Ļ░ÖņØĆ ļŗżņ¢æĒĢ£ ņĢäļ»ĖļģĖņé░ņØĆ ļ¼╝ļĪĀ Ļ┤æņ╣śļŻīņŚÉ ņé¼ņÜ®ļÉśļŖö aminolevulinic acid ļō▒ļÅä ļ¦īļōż ņłś ņ׳Ļ▓ī ļÉśņŚłļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņØ┤ļ¤¼ĒĢ£ ĻĖ░ņłĀņØĆ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņé¼ņÜ®ļÉśļŖö L-threonineņØä ņĢäņŻ╝ ļåÆņØĆ ņł£ļÅäļĪ£ ļīĆļ¤ē ņāØņé░ņØ┤ Ļ░ĆļŖźĒĢśĻ▓ī ĒĢ©ņ£╝ļĪ£ņŹ© ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņŗ£ĒĢ£ ņ£äņן ļ│┤ĒśĖ ĒÜ©ļŖźņØĆ ļ¼╝ļĪĀ ņäĖĒż ņ×¼ņāØ ļō▒ņŚÉ ļŗżņ¢æĒĢśĻ▓ī ņé¼ņÜ®ņØ┤ Ļ░ĆļŖźĒĢśĻ│Ā, ļŹö ļéśņĢäĻ░Ćņä£ ņ£äņן ņØ┤ņÖĖņØś ļŗżņ¢æĒĢ£ ņ×¼ņāØņØä ņÜöĒĢśļŖö ņ¦łļ│æņŚÉļÅä ņé¼ņÜ®ņØ┤ Ļ░ĆļŖźĒĢśĻ▓ī ļÉśņŚłļŗż[22-25].
ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ Ļ░ÉņŚ╝ņŚÉ ņØśĒĢ£ ņ£äņןļ│æņØś ļ░£ņāØņØĆ Ļ░ÉņŚ╝ ņŗ£ĻĖ░ ļ░Å Ļ░ÉņŚ╝ņŚÉ ļö░ļźĖ ņłÖņŻ╝ņØś ļ░śņØæņŚÉ ļö░ļØ╝ ņĢäņŻ╝ ļŗżņ¢æĒĢ£ļŹ░, ņØ╝ļ░śņĀüņ£╝ļĪ£ļŖö ĻĖēņä▒/ļ¦īņä▒ ņ£äņŚ╝ņØä ņ£Āļ░£ĒĢ£ļŗż. ņØ┤ļĢī ņ¦Ćļéśņ╣£ ņ×ÉĻ░Ćļ®┤ņŚŁ ļ░śņØæ, ĒŖ╣Ē׳ ļ”╝ĒöäĻĄ¼ ļ░śņØæņ£╝ļĪ£ ņĀÉļ¦ēĻ┤ĆļĀ©ļ”╝ĒöäņĪ░ņ¦ü(mucosa-associated lymphoid tissue, MALT) ļ”╝ĒöäņóģņØ┤ ļ░£ņāØĒĢśļ®░, ļ░śļ®┤ņŚÉ ņ£äņé░ ļČäļ╣äņĪ░ņĀł ņןņĢĀļź╝ ņ£Āļ░£ĒĢĀ Ļ▓ĮņÜ░ ņŗŁņØ┤ņ¦Ćņן ĻČżņ¢æņØ┤ ĻĘĖļ”¼Ļ│Ā ņ¦Ćļéśņ╣£ ņŚ╝ņ”Øļ░śņØæ ņĢģĒÖö ļ░Å ņ¦ĆņåŹņ£╝ļĪ£ļŖö ņ£äņäĀ ĒīīĻ┤┤ļź╝ ņ┤łļלĒĢśļŖö Ļ▓░Ļ│╝ļĪ£ ļ¦īņä▒ ņ£äņČĢņä▒ ņ£äņŚ╝ ļ░Å ņ¦äņĀäņŚÉ ļö░ļźĖ ņ£äņĢöņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. ĻĘĖļ¤░ļŹ░ ņØ┤ļ¤¼ĒĢ£ ņłÖņŻ╝ ļ░śņØæņØś Ļ│ĄĒåĄņĀÉņØĆ Ļ░ÉņŚ╝ ļ░Å ņ¦æļØĮĒÖö Ļ▓░Ļ│╝ļĪ£ ņé░ĒÖöņĀü ņåÉņāü, ļÅÖļ░śļÉśļŖö ņ¦Ćļéśņ╣£ ņŚ╝ņ”Ø ļ░śņØæ ĻĘĖļ”¼Ļ│Ā ņØ┤ņØś ļ│æņØĖņØ┤ ņ¦ĆņåŹļÉśļŖö ņłÖņŻ╝ņØś ņäĖĒż ļ│┤ĒśĖ ņĢĮĒÖö ļō▒ņØ┤ ĻĖ░ļ│ĖņĀüņ£╝ļĪ£ ļ░£ņāØĒĢ£ļŗżļŖö Ļ▓āņØ┤ļŗż. ņØ┤ļ¤¼ĒĢ£ ļ░░Ļ▓Įņ£╝ļĪ£ ņ×äņāüņŚÉņä£ļŖö ņåīĒÖöņä▒ ĻČżņ¢æ ļ░£ņāØ ļ░Å ņ×¼ļ░£, MALT ļ”╝ĒöäņóģĻ│╝ Ļ░ÖņØĆ ņ¦Ćļéśņ╣£ ļ”╝ĒöäĻĄ¼ ļ░śņØæ ĻĘĖļ”¼Ļ│Ā ņ£äņĢö ļ░£ņāØĻ│╝ ņŚ░Ļ┤ĆļÉ£ ņ×¼ļ░£ ļ░®ņ¦Ć ļō▒ņØä ņ£äĒĢ£ ļ¬®Ēæ£ļĪ£ļ¦ī ņĀ£ĻĘĀ ņĀüņØæņ”ØņØ┤ ņĀ£ņĀĢļÉśņ¢┤ ņ׳ņ¦Ćļ¦ī, ļ│æĒā£ņāØļ”¼ĒĢÖņĀü ņĖĪļ®┤ņŚÉņä£ļŖö Ļ░ÉņŚ╝ ļ░Å ņŗ¼ĒĢ£ ņŚ╝ņ”ØĻ│╝ ļ®┤ņŚŁ ļ│ĆĒÖöņŚÉ ļö░ļźĖ ņ┤łĻĖ░ ļ░śņØæņŚÉ ļīĆĒĢ£ ņĀüņĀłĒĢ£ ņĀ£ņ¢┤Ļ░Ć ņĢäņŻ╝ ņżæņÜöĒĢśļŗż ĒĢśĻ▓Āļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņØ┤ļ¤¼ĒĢ£ ļ░░Ļ▓Į ĒĢśņŚÉ ņé¼ļ×īņØĆ ļ¼╝ļĪĀ ņ×ÉĻĘ╣ ļ¼╝ņ¦łņŚÉ ļīĆĒĢ£ ņ¦Ćļéśņ╣£ ņ¦łĒÖś ļ░śņØæņ£╝ļĪ£ ĒÅÉņé¼ļź╝ ĒĢśĻ▒░ļéś ņ£äņן ņ¦łĒÖśņØ┤ ļ│æļ░£ĒĢśĻ│Ā, ĒŖ╣Ē׳ ņŖżĒŖĖļĀłņŖżļź╝ ņØ┤Ļ▓©ļé┤ļŖö ĻĖ░ņĀäņØ┤ļéś ĒÖśĻ▓ĮņØä ļŖźļÅÖņĀüņ£╝ļĪ£ ļīĆņ▓śĒĢĀ ņłś ņŚåļŖö ļÅÖļ¼╝ļōżņŚÉĻ▓īļŖö ņé¼ļŻīņŚÉ ĒżĒĢ©ņØä ņŗ£ĒéżĻ▒░ļéś ļ│äļÅäļĪ£ Ļ│ĄĻĖēĒĢśļŖö ļ░®ļ▓Ģņ£╝ļĪ£ threonineņØä ņäĀņĀ£ņĀü Ēł¼ņŚ¼(preemptive administration)ĒĢśļŖö Ļ▓āņØ┤ ņĢäņŻ╝ ņĀüņĀłĒĢĀ Ļ▓āņØ┤ļŗż[26,27].
Threonine Ēł¼ņŚ¼ņØś Ļ▓░Ļ│╝ļĪ£ ņĢäņŻ╝ ņ£ĀņÜ®ĒĢ£ ĒĢŁņŚ╝ņ”Ø ņ×æņÜ®, ĒĢŁņé░ĒÖö ņ×æņÜ®, ĒĢŁļ│ĆņØ┤ ņ×æņÜ® Ļ▓░Ļ│╝ļź╝ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ĻĘ£ļ¬ģĒĢśņśĆĻ│Ā, ņØ┤ņĀäņØś ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņŖżĒŖĖļĀłņŖż ņŚ░Ļ┤Ć ņ£ä ņåÉņāü ļ¬©ļŹĖņŚÉņä£ļÅä ņĀÉņĢĪ ņāØņä▒ ņ”ØĻ░ĆļŖö ļ¼╝ļĪĀņØ┤Ļ│Ā ĒĢŁņé░ĒÖö, ĒĢŁņäĖĒż ņé¼ļ®Ė ĻĘĖļ”¼Ļ│Ā ņäĖĒż ņ×¼ņāØ ņ┤ēņ¦ä ļō▒ņØś Ļ│ĄĒåĄļÉ£ ĒÜ©Ļ│╝ļź╝ ņØ┤ļ»Ė Ļ┤Ćņ░░ĒĢśņŚ¼[16] threonineņØś Ēł¼ņŚ¼Ļ░Ć ļÅÖļ¼╝ņØś ņ£ä ņåÉņāü ņśłļ░®ņØ┤ļéś ņ╣śņ£ĀņŚÉ ņé¼ņÜ®ņØ┤ Ļ░ĆļŖźĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉśļ®░, ļŹö ļéśņĢäĻ░Ć ņé¼ļ×īņŚÉņä£ļÅä ņØæņÜ®ņØ┤ ĻĖ░ļīĆļÉ£ļŗżĻ│Ā ĒĢśĻ▓Āļŗż. ņ£äņĀÉņĢĪņØĆ Ēæ£ļ®┤ ņ£äņĀÉļ¦ēņäĖĒżņÖĆ ņ£äĻ▓ĮļČĆ ņĀÉņĢĪļČäļ╣äņäĖĒżņŚÉņä£ ĒÖ£ļ░£ĒĢśĻ▓ī ļČäļ╣äļÉśņ¢┤ ņĄ£ņĀäņäĀņØś ņ£ä ļ░®ņ¢┤ņØĖņ×ÉļĪ£ ņ×æņÜ®ņØä ĒĢśļŖöļŹ░, ĻĘĖ ņāØņä▒ Ļ│╝ņĀĢņØä ņé┤ĒÄ┤ļ│┤ļ®┤ ļ░öļĪ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ threonine ņĢäļ»ĖļģĖņé░ņØä ĻĖ░ļ░śņ£╝ļĪ£ ļ”¼ļ│┤ņå£ņŚÉņä£ ļŗ╣ļŗ©ļ░▒ņØ┤ ņāØņä▒ļÉśņ¢┤ glycoside sugar chainņØä ņåīĒżņ▓┤ņŚÉņä£ ĻĄ¼ņä▒ĒĢśņŚ¼, oligomerization ĻĖ░ņĀäņØä ĒåĄĒĢśņŚ¼ ņä▒ņłÖļÉśļ®┤ņä£ ļČäļ╣äĻ░Ć ņ¦äĒ¢ēņØ┤ ļÉ£ļŗż.
ņĀ£ĻĘĀ ņØ┤ņÖĖņØś ņĀæĻĘ╝ ļ░®ļ▓Ģņ£╝ļĪ£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ņŚÉ ņØśĒĢ£ ņŚ¼ļ¤¼ Ļ░Ćņ¦ĆņØś ņäĖĒż ļÅģņä▒ņØä ņĢĮĒÖöņŗ£ĒéżĻ▒░ļéś ņäĖĒż ļ│Ćņä▒ņØä ņ£ĀļÅäĒĢśļŖö Ļ░üņóģ ĻĖ░ņĀäņØä ņĀ£ņ¢┤ĒĢĀ ņłś ņ׳ļŖö ņŗØĒÆłņØ┤ļéś ļ╣äņĀ£ĻĘĀņØś ļ░®ļ▓Ģņ£╝ļĪ£ļŖö ļŗżņ¢æĒĢ£ ņŗØļ¼╝ĒÖöĒĢ®ļ¼╝(phytochemicals)ņØ┤ ĒĢ©ņ£ĀļÉ£ ņŗØĒÆłņØ┤ļéś ļČäļ”¼ļÉ£ ņŗØĒÆłĒÖöĒĢ®ļ¼╝ņØä ņØ┤ņÜ®ĒĢĀ ņłś ņ׳ņ¢┤, ņĀĆņ×ÉļōżņØĆ Ļ│╝Ļ▒░ 20ņŚ¼ļģä ļÅÖņĢł ĒÖŹņé╝, Ļ░Éņ┤ł, ļģ╣ņ░©, Ļ░ĢĒÖ®, ņæź ņČöņČ£ļ¼╝ ļō▒ ņĢäņŻ╝ ļŗżņ¢æĒĢ£ ņĀæĻĘ╝ņØä ĒåĄĒĢ£ ņŚ░ĻĄ¼ļōżņØä ļ░£Ēæ£ĒĢ£ ļ░ö ņ׳ļŖöļŹ░, ņØ┤ļōżņØś Ļ│ĄĒåĄņĀüņØĖ ĒŖ╣ņ¦ĢņØĆ ņäĖĒż ļ¬©ļŹĖņØĆ ļ¼╝ļĪĀ ņ¦łĒÖś ļ¬©ļŹĖ ĻĖ░ļ░śņØś ņ£ĀĒÜ©ņä▒ņŚÉņä£ļÅä ņĢäņŻ╝ ņÜ░ņłśĒĢ£ Ļ▓░Ļ│╝ļź╝ ņ░ŠņØä ņłś ņ׳ņŚłļŗż[28,29]. ĻĘĖļĀćņ¦Ćļ¦ī ņØ┤ļ¤¼ĒĢ£ ņĀæĻĘ╝ņØś ĒĢ£Ļ│äļĪ£ļŖö ņĢäņŻ╝ ņČ®ļČäĒĢ£ ĻĘ╝Ļ▒░ņżæņŗ¼ņØśĒĢÖņĀü Ļ▓░Ļ│╝Ļ░Ć ļČĆņĪ▒ĒĢśļŗżļŖö Ļ▓āĻ│╝ ņØ┤ļōż ļ¼╝ņ¦łļōżņØĆ ļÅģņä▒ĒĢÖņŚÉņä£ ņĀ£ĻĖ░ļÉśļŖö hormesisņØś ņøÉņ╣ÖņØä ļö░ļźĖļŗżļŖö Ļ▓āņØ┤ļŗż. ņ”ē, ņĢĮļ¼╝Ļ│╝ Ļ░ÖņØ┤ ņĢäņŻ╝ ĒŖ╣ņĀĢĒĢ£ ļåŹļÅäļéś Ēł¼ņŚ¼ ņŗ£ņŚÉļŖö ĒÜ©ļŖźņØä ļ│┤ņØ┤ĻĖ░ļŖö ĒĢśļéś ņÜ®ļ¤ē ņØśņĪ┤ņĀüņØ┤ņ¦Ć ņĢŖņĢä ņ¢┤ļ¢ż Ļ▓ĮņÜ░ņŚÉļŖö Ļ│ĀņÜ®ļ¤ēņŚÉņä£ ņśżĒ׳ļĀż ļé«ņØĆ ĒÜ©Ļ│╝ļéś ļČĆņ×æņÜ®ņØä ļ│┤ņØĖļŗżļŖö ņĀÉĻ│╝ ņØ┤ļōżņØś ĒÜ©ļŖźņØä ĻĘ╣ļīĆĒÖöĒĢśĻĖ░ ņ£äĒĢ£ ņĀüņĀł ņÜ®ļ¤ē ļ░Å Ēł¼ņŚ¼ ļ░®ļ▓Ģ ļō▒ņŚÉ ļīĆĒĢ£ ĻĄ¼ņ▓┤ņĀüņØĖ Ļ▓░Ļ│╝Ļ░Ć ņŚåņ£╝ļ»ĆļĪ£ ņ×äņāüņŗ£ĒŚśņØś ņłśņżĆļÅä ļé«ņ¦Ćļ¦ī ņØ╝Ļ┤Ćņä▒ņØ┤ ņ׳ļŖö Ļ▓░Ļ│╝ļź╝ ņĀ£ņŗ£ĒĢĀ ņłś ņŚåļŗżļŖö Ļ▓āņØ┤ļŗż. ĻĘĖļ¤░ļŹ░ ļ░śĒĢśņŚ¼ ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ threonineņØś Ļ▓ĮņÜ░ļŖö ņØ┤ļ¤¼ĒĢ£ ļŗ©ņĀÉņØä ļ¬©ļæÉ ļČłņŗØņŗ£Ēé¼ ņłś ņ׳ņŚłĻ│Ā, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņŗ£ĒĢ£ Ļ▓āĻ│╝ Ļ░ÖņØĆ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņŚÉ ļö░ļźĖ ļ│æĒā£ņāØļ”¼ļź╝ ļ¬©ļæÉ ņ£ĀĒÜ©ĒĢśĻ▓ī ņĪ░ņĀłņØ┤ Ļ░ĆļŖźĒĢśļ®░, ņŚ¼ļ¤¼ ņĪ░Ļ▒┤ņŚÉņä£ ņØ╝ņ╣śļÉ£ Ļ▓░Ļ│╝Ļ░Ć ļéśņś©ļŗżļŖö ņןņĀÉĻ│╝ ņĢłņĀĢņä▒ņØ┤ ļåÆņØĆ ņĢäļ»ĖļģĖņé░ņØ┤ļ»ĆļĪ£ Ēśäņ×¼ļĪ£ļŖö ĒŖ╣ņØ┤ĒĢ£ ļīĆņ▒ģņØ┤ ņŚåļŖö ļÅÖļ¼╝ņØ┤ļéś Ļ░ĆņČĢņØś ņé¼ļŻīļĪ£ ņČ®ļČäĒ׳ Ļ░Ćņ╣śĻ░Ć ļåÆņØä ņłś ņ׳ļŗż.
ņØ┤ņāüņØś Ļ▓░Ļ│╝ļź╝ ņÜöņĢĮĒĢśļ®┤ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ļź╝ ļ¬©ļæÉ ņĀ£Ļ▒░ĒĢśĻ▒░ļéś ņØ┤ļź╝ ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ņ¢ĄņĢĢĒĢśĻĖ░ ņ£äĒĢ£ ņĀ£ļ░ś ļģĖļĀźņØĆ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņŚÉ ņØśĒĢ£ ĻĖēņä▒/ļ¦īņä▒ ņ£äņŚ╝ņØś ņ╣śļŻīļŖö ļ¼╝ļĪĀ, ņåīĒÖöņä▒ ĻČżņ¢æ, MALT ļ”╝ĒöäņóģņØ┤ļéś ņ£äņäĀņĢöņØś ņśłļ░®, ņĄ£ĻĘ╝ņŚÉļŖö Ļ░üņóģ ņ£äņן ņÖĖņØś ņŚ¼ļ¤¼ ņ¦łĒÖśļōżņØś ņøÉņØĖņ£╝ļĪ£ ĻĘ£ļ¬ģļÉśĻ│Ā ņ׳ņ¢┤ ņĀÉņ░© ņØ┤ ĻĘĀņŻ╝ņŚÉ ņØśĒĢ£ ņŚ░Ļ┤Ć ņ¦łĒÖśņØś ņ╣śļŻīļĪ£ ņĀüņØæņ”ØņØ┤ ĒÖĢļīĆļÉśĻ│Ā ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ņ£äņן ņÖĖ ņ¦łĒÖśņØś Ļ░ĆļŖźĒĢ£ ļ│æņØĖņ£╝ļĪ£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ exosomeņŚÉ ņØśĒĢ£ Ļ░ĆļŖźņä▒Ļ│╝ molecular mimicryņŚÉ ņØśĒĢ£ ņ×ÉĻ░Ć ļ░śņØæņ£╝ļĪ£ ļ░ØĒśĆņĀĖ ņ׳ņ£╝ļéś ņĢäņ¦üĻ╣īņ¦Ć ņé¼ļ×īņŚÉņä£ļÅä ĻĘ£ļ¬ģļÉśņ¦Ć ļ¬╗ĒĢ£ ņāüĒÖ®ņŚÉņä£ ļÅÖļ¼╝ņØ┤ļéś Ļ░ĆņČĢļōżņŚÉņä£ ļ©╝ņĀĆ Ļ│ĀļĀżļÉśņ¢┤ņĢ╝ ĒĢĀ ņé¼ĒĢŁņØĆ ņĢäļŗłļŗż. ņØ┤ļ¤¼ĒĢ£ ļ░░Ļ▓ĮņŚÉņä£ ļ│Ė ņŚ░ĻĄ¼ņ¦äļōżņØ┤ ĻĘ£ļ¬ģĒĢ£ threonine Ļ│╝ļ”ĮņØĆ Ē¢źĒøä ļÅÖļ¼╝ņØś ņé¼ļŻīņŚÉ ņé¼ņÜ®ļÉśĻ▒░ļéś ļŗ©ļÅģņ£╝ļĪ£ ļ│┤ņČ®ĒĢ┤ņżä ņłś ņ׳ļŖö ņĢäņŻ╝ ņ£ĀņÜ®ĒĢ£ ņä▒ļČäņ×äņØä ĻĘ£ļ¬ģĒĢśņśĆĻ│Ā ļŗżĒ¢ēĒ׳ļÅä ļŗ©ļ░▒ņ¦ł ņ×¼ņĪ░ĒĢ® ļ░®ļ▓Ģ ļō▒ņØś ĒśäņĀĆĒĢ£ ļ░£ņĀäņ£╝ļĪ£ ļ│Ė ņŚ░ĻĄ¼ņÖĆ Ļ░ÖņØ┤ C. glutamicumĻ│╝ Ļ░ÖņØĆ ĻĘĀņŻ╝ņØś ĒÖ£ņÜ®ņ£╝ļĪ£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ļŖö ļ¼╝ļĪĀ ņØ┤ņÖĖņØś ļŗżņ¢æĒĢ£ ņ£äņן ņ×ÉĻĘ╣ ļ¼╝ņ¦łļōżņŚÉ ļīĆĒĢŁĒĢśļŖö ņĢäņŻ╝ ņóŗņØĆ ņ╣śļŻīļ▓ĢņØ╝ ņłś ņ׳ņØīņØä ņ×ģņ”ØĒĢĀ ņłś ņ׳ņŚłļŗż.
Supplementary Materials
Supplementary┬ĀFig.┬Ā1.
Disk diffusion assay under Helicobacter pylori culture, hemolysis status according to different doses of threonine.
Supplementary┬ĀFig.┬Ā2.
Disk diffuse assay to analyze the anti-H. pylori of threonine alone and combination with synthesizing bacteria with dilutional broth from each group; comparison with non-treated samples. The mean halo in each group in a different subdivision (├Ś1/4, ├Ś1/40, and ├Ś1/100 dilution). H. pylori, Helicobacter pylori; MOI, multiplicity of infection.
Fig.┬Ā1.
Changes in the inflammatory mediators according to group. (A) RT-PCR for IL-1╬▓ and IL-8 mRNA. (B) RT-PCR for Cox-2 and iNOS mRNA. All results from triplicate measurement. (C) Western blot for Cox-2 and iNOS. All groups treated with threonine show the attenuating effect of H. pylori-induced Cox-2. (D) Western blot for p-NF-╬║B p65. Among the NF-╬║B components, significant changes are noted in NF-╬║B p65 activation with H. pylori infection, of which activations are significantly repressed with threonine and Corynebacterium glutamicum. H. pylori, Helicobacter pylori; MOI, multiplicity of infection; RT-PCR, reverse transcriptase-polymerase chain reaction; IL, interleukin; GAPDH, glyceraldehyde 3-phosphate dehydrogenase.
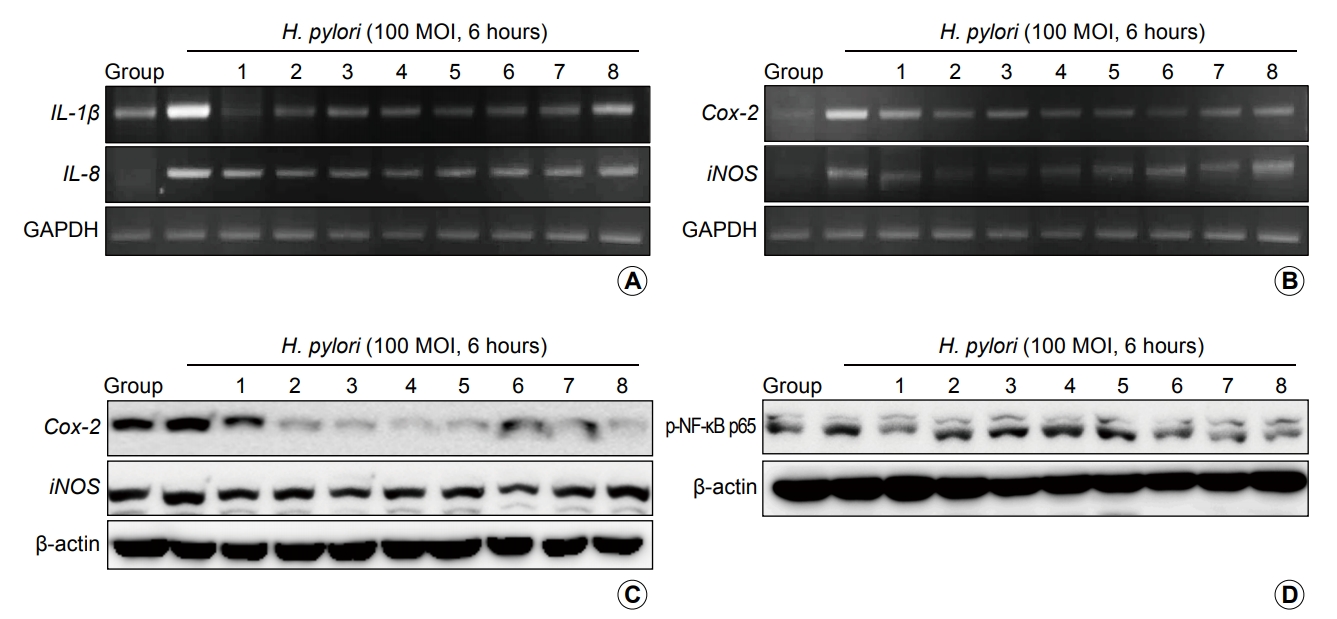
Fig.┬Ā2.
Changes related to oxidative stress according to group. (A) Western blot for HIF-1╬▒. (B) Western blot for c-Jun and c-Fos. (C) Confocal imaging for DCF-DA, ├Ś400, lower graphs show mean counter of DCF positive cells in ├Ś400 field. H. pylori, Helicobacter pylori; MOI, multiplicity of infection; DCF-DA, 2',7'-dichlorofluorescein-diacetate.

Fig.┬Ā3.
Changes in the phase 2 host defense genes including its transcription factor Nrf2. (A) RT-PCR for HO-1 and HSP70 mRNA. (B) Western blot for Nrf2 in nuclear fractions. Significantly increased nuclear translocations of Nrf-2 are noted in group 6~8. (C) Western blot for GST-pi, HO-1, and NQO-1. H. pylori, Helicobacter pylori; MOI, multiplicity of infection; HO-1, heme oxygenase-1; HSP70, heat shock protein 70; GAPDH, glyceraldehyde 3-phosphate dehydrogenase; GST, glutathione-s-transferase; NQO-1, dehydrogenase quinone-1; RT-PCR, reverse transcriptasepolymerase chain reaction.

Fig.┬Ā4.
Changes in the apoptotic executors and TUNEL showing apoptotic cells. (A) Western blot for Bax and Bcl-2. (B) TUNEL in situ hybridization, ├Ś200 (upper), and mean apoptotic index according to group (lower). H. pylori, Helicobacter pylori; MOI, multiplicity of infection.
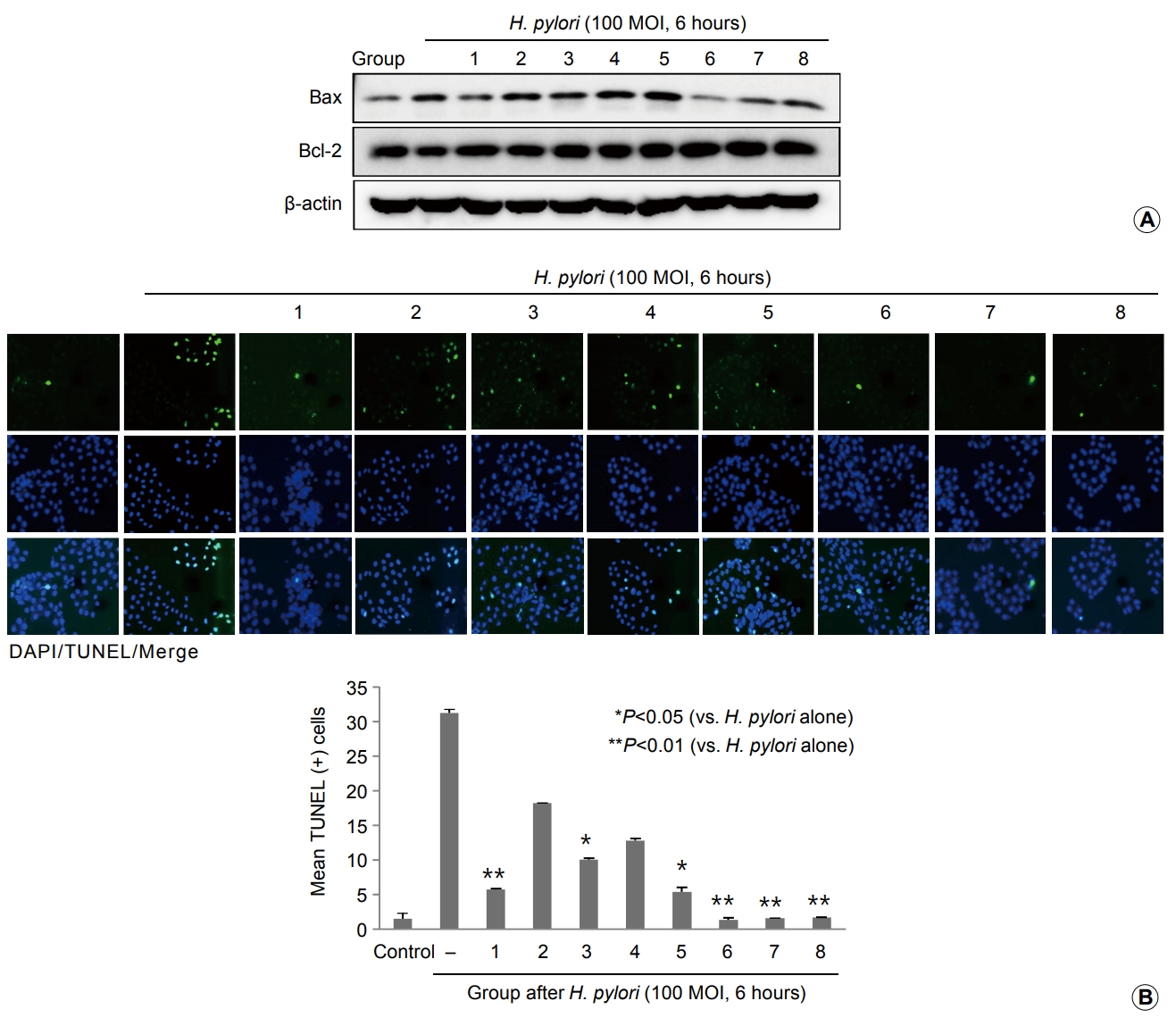
Fig.┬Ā5.
Changes in angiogenic growth factors and ╬▓-catenin according to group. (A) Western blot for p-╬▓-catenin in cytoplasmic fraction and ╬▓-catenin in nuclear fraction according to group. (B) Western blot for EGF, PDGFR, TGF-╬▓, and VEGF. H. pylori, Helicobacter pylori; MOI, multiplicity of infection.

Fig.┬Ā6.
Disk diffuse assay to analyze the anti-Helicobacter pylori factors. (A) Photo showing halo around disc accompanied with the description of each group. All experiments were repeated thrice in order to have mean value. (B) According to representative photo as shown in Fig. 1A, halo around disc in 8 groups were measured and mean values are shown in graph.

Fig.┬Ā7.
Schematic presentation explaining the effects of threonine and C. glutamicum. H. pylori infection leads to gastritis, peptic ulcer disease, and carcinogenesis, during which increased mutagenic inflammation and oxidative stress, attenuated cytoprotection, and retarded/deranged regeneration prevail. Consequent to these disasters triggered by H. pylori, chronic atrophic gastritis, intestinal metaplasia, and dysplasia develop, due to which H. pylori infection had been defined as a class I carcinogen. In this background, threonine granules alone or combination with threonine-producing bacteria, C. glutamicum affords significant regulating action mechanisms. Our study proves the merits of threonine as important regulating agent against H. pylori infection in veterinary or clinical medicine. C. glutamicum, Corynebacterium glutamicum; H. pylori, Helicobacter pylori; IL, interleukin; HO-1, heme oxygenase-1; HSP, heat shock protein.
Table┬Ā1.
List of Primer Sequences Used for RT-PCR Analysis
Table┬Ā2.
Group Description to Denote the Anti-Helicobacter Properties of Threonine Alone and Combination with Corynebacterium Species
REFERENCES
1. Goh KL. Lessons learnt from the epidemiology of Helicobacter pylori infection in Malaysia: JGHF Marshall and Warren lecture 2017. J Gastroenterol Hepatol 2018;33:1177ŌĆō1184.


2. Forbes GM, Glaser ME, Cullen DJ, et al. Duodenal ulcer treated with Helicobacter pylori eradication: seven-year follow-up. Lancet 1994;343:258ŌĆō260.


3. Forbes GM, Warren JR, Glaser ME, Cullen DJ, Marshall BJ, Collins BJ. Long-term follow-up of gastric histology after Helicobacter pylori eradication. J Gastroenterol Hepatol 1996;11:670ŌĆō673.


4. Dhungat JV. Barry Marshall and Robin Warren: H. pylori in peptic ulcer. J Assoc Physicians India 2016;64:104.
5. Fock KM, Graham DY, Malfertheiner P. Helicobacter pylori research: historical insights and future directions. Nat Rev Gastroenterol Hepatol 2013;10:495ŌĆō500.




6. Copeland CE, Stahlfeld K. Two tall poppies and the discovery of Helicobacter pylori. J Am Coll Surg 2012;214:237ŌĆō241.


7. Sugano K, Hiroi S, Yamaoka Y. Prevalence of Helicobacter pylori infection in Asia: remembrance of things past? Gastroenterology 2018;154:257ŌĆō258.


8. Rugge M, Genta RM, Di Mario F, et al. Gastric cancer as preventable disease. Clin Gastroenterol Hepatol 2017;15:1833ŌĆō1843.


10. De Witte C, Ducatelle R, Haesebrouck F. The role of infectious agents in the development of porcine gastric ulceration. Vet J 2018;236:56ŌĆō61.


11. Swaby H, Gregory NG. A note on the frequency of gastric ulcers detected during post-mortem examination at a pig abattoir. Meat Sci 2012;90:269ŌĆō271.


12. Laine L, Takeuchi K, Tarnawski A. Gastric mucosal defense and cytoprotection: bench to bedside. Gastroenterology 2008;135:41ŌĆō60.


13. Tarnawski A, Ahluwalia A, Jones MK. Gastric cytoprotection beyond prostaglandins: cellular and molecular mechanisms of gastroprotective and ulcer healing actions of antacids. Curr Pharm Des 2013;19:126ŌĆō132.


14. Atay S, Tarnawski AS, Dubois A. Eicosanoids and the stomach. Prostaglandins Other Lipid Mediat 2000;61:105ŌĆō124.


15. An JM, Kang EA, Han YM, et al. Dietary threonine prevented stress-related mucosal diseases in rats. J Physiol Pharmacol 2019;70:467ŌĆō478.
16. Faure M, Mettraux C, Moennoz D, et al. Specific amino acids increase mucin synthesis and microbiota in dextran sulfate sodium-treated rats. J Nutr 2006;136:1558ŌĆō1564.



17. Dong X, Quinn PJ, Wang X. Metabolic engineering of Escherichia coli and Corynebacterium glutamicum for the production of L-threonine. Biotechnol Adv 2011;2:11ŌĆō23.

18. Ichikawa T, Ishihara K, Saigenji K, Hotta K. Stimulation of mucus glycoprotein biosynthesis in rat gastric mucosa by gastrin. Biochem Pharmacol 1993;46:1551ŌĆō1557.


19. Hayashida H, Ishihara K, Ichikawa T, et al. Expression of a specific mucin type recognized by monoclonal antibodies in the rat gastric mucosa regenerating from acetic acid-induced ulcer. Scand J Gastroenterol 2001;36:467ŌĆō473.


20. Ikezawa T, Goso Y, Ichikawa T, et al. Appearance of specific mucins recognized by monoclonal antibodies in rat gastric mucosa healing from HCl-induced gastric mucosal damage. J Gastroenterol 2004;39:113ŌĆō119.



21. Feng L, Zhang Y, Fu J, et al. Metabolic engineering of Corynebacterium glutamicum for efficient production of 5-aminolevulinic acid. Biotechnol Bioeng 2016;113:1284ŌĆō1293.


22. Nguyen AQ, Schneider J, Reddy GK, Wendisch VF. Fermentative production of the diamine putrescine: system metabolic engineering of Corynebacterium glutamicum. Metabolites 2015;24:211ŌĆō231.

23. Xu J, Han M, Zhang J, Guo Y, Zhang W. Metabolic engineering Corynebacterium glutamicum for the L-lysine production by increasing the flux into L-lysine biosynthetic pathway. Amino Acids 2014;46:2165ŌĆō2175.



24. Dong X, Quinn PJ, Wang X. Microbial metabolic engineering for L-threonine production. Subcell Biochem 2012;64:283ŌĆō302.


25. Diesveld R, Tietze N, F├╝rst O, et al. Activity of exporters of Escherichia coli in Corynebacterium glutamicum, and their use to increase L-threonine production. J Mol Microbiol Biotechnol 2009;16:198ŌĆō207.


26. Simic P, Sahm H, Eggeling L. L-threonine export: use of peptides to identify a new translocator from Corynebacterium glutamicum. J Bacteriol 2001;183:5317ŌĆō5324.



27. Jeong M, Park JM, Han YM, et al. Dietary prevention of Helicobacter pylori-associated gastric cancer with kimchi. Oncotarget 2015;6:29513ŌĆō29526.










