|
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 21(1); 2021 > Article |
|
Abstract
Esophageal squamous cell carcinoma is the seventh most common cancer and the sixth most common cause of cancer death worldwide. Esophageal squamous dysplasia is the only histopathology that predicts the development of esophageal squamous cell carcinoma. It is difficult to identify esophageal squamous dysplasia by conventional endoscopy; however, Lugol chromoendoscopy is useful for the diagnosis of such a lesion. In addition, advance endoscopic detection techniques, such as image-enhanced endoscopy (especially, narrow-band imaging), magnifying endoscopy, and endocytoscopy, are helpful in detecting esophageal squamous dysplasia. Similar to the treatment for early esophageal cancer, endoscopic resection such as endoscopic mucosal resection and endoscopic submucosal dissection is the choice of treatment for esophageal squamous dysplasia. This review discusses esophageal squamous dysplasia in detail, especially in terms of endoscopic diagnosis and clinical management.
식도암은 전 세계적으로 일곱 번째로 흔한 악성 종양이고 여섯 번째로 흔한 암 관련 사망 원인으로, 2008년에는 약 50만명이 사망하여 전체 암 사망의 5.3%를 차지하고 있다[1]. 식도암에는 선암(adenocarcinoma)과 편평세포암종(squamous cell carcinoma) 두 가지 주요 조직병리학적 유형이 있으며, 우리나라에서는 식도암의 약 90% 이상이 편평세포암종이다. 2015년 한국중앙암등록사업(Korean Central Cancer Registry)에 따르면 1년간 2,420명에서 식도암이 발생하였으며, 연령 표준화 발생률은 인구 10만 명당 2.7명이었다[2,3].
식도 편평상피세포 이형성(squamous dysplasia)은 식도 편평세포암종의 발생을 예측하는 유일한 조직병리학적 소견으로, 상피 이형성의 정도가 심할수록 편평세포암종의 위험이 증가된다고 알려져 있다[4]. 1987년 중국 Linxian 지역에서 682명의 환자를 대상으로 한 3.5년간의 전향적 관찰 연구에 의하면, 식도암 발생의 비교 위험도는 경도(mild) 이형성의 경우 2.2 (95% 신뢰구간 0.7~7.5), 중등도(moderate) 이형성의 경우 15.8 (95% 신뢰구간 5.9~42.2), 중증도(severe) 이형성의 경우 72.6 (95% 신뢰구간 29.8~176.9)으로 나타났다[4]. 최근 이들 환자를 대상으로 13.5년간 장기간 추적 관찰한 결과, 저도 이형성 환자군의 24%, 중등도 이형성 환자군의 50%, 중증도 이형성 환자군의 74%에서 편평세포암종이 발생하였다[5]. 하지만 아직까지 편평세포암종의 전암성 병변인 식도 이형성이 발견될 때 어떻게 대처할 것인가에 대해서는 의견 일치를 보지 못하고 있어, 본고에서는 식도 편평상피세포 이형성의 진단 및 향후 처치에 대하여 기술하고자 한다.
1990년도 세계보건기구(World Health Organization, WHO) 분류에서 편평상피세포의 이형성은 구조적(architectural), 세포적(cytological) 이상을 가지고 있는 전암성 병변으로 기술하였다[6]. 전통적으로 편평상피세포 이형성은 경도, 중등도, 중증도로 분류되었다[7,8]. 경도 이형성은 이형성 세포가 기저층에서 1/3 미만을 차지하는 것, 중등도 이형성은 이형성 세포가 기저층에서 1/3에서 2/3를 차지하는 것, 중증도 이형성은 이형성 세포가 기저층에서 2/3 이상을 차지하는 것으로 분류하였다[9,10].
그러나 2000년도 WHO 분류에서는 이형성을 암이라고 판정할 수 없는 상피내 종양(intraepithelial neoplasia)으로 정의하고, 경도와 중등도 이형성을 저도 상피내 종양(low-grade intraepithelial neoplasm)으로, 중증도 이형성과 상피내암(carcinoma in situ)을 고도 상피내 종양(high-grade intraepithelial neoplasm)으로 크게 두 가지로 구분하였다[11]. WHO 분류는 표층으로의 세포 분화의 이상이 진단 및 이형성 정도 구분의 주축이 되고 있다. 즉, 종양성 이형성 세포가 상피의 거의 전 층을 치환한 경우(표층 분화가 나타나지 않는 경우)를 상피내암으로, 저도 이형성은 이형성 세포가 상피 심층 1/2 이하를 차지하는 경우로, 고도 이형성은 이형성 세포가 상피 심층 1/2 이상을 차지하는 것으로 분류하고 있다(Fig. 1) [12].
서구와 일본의 식도 편평세포암종 및 편평상피세포 이형성의 판정에 대한 기준에서는 많은 차이가 있다[11]. 이는 일본에서 식도 편평세포암종의 발생률, 특히 조기 편평세포암종의 발생률이 미국보다 높고, 또한 예후가 좋은 것과 연관이 있다[9,11,12]. 일본의 병리의사들은 핵의 확대(nuclear enlargement), 다형성(pleomorphism), 과염색증(hyperchromasia)과 같은 핵의 소견을 중요하게 생각한다[11]. 반면에, 서구에서는 암 진단을 침윤 소견에 따라 판정하기 때문에 상피 내의 이형성 병변은 핵의 소견과 상관없이 이형성으로만 진단된다. 여기에는 염증성 이형성, 재생성 이형성, 종양성 이형성, 양성 및 악성이 불명확한 병변들이 포함되어 있다[11].
내시경 검사 시 식도 편평상피세포 이형성은 보통 평편한 병변이나 발적, 결절(nodule), 판(plaque) 또는 미란으로 보인다(Fig. 2A, B) [13,14]. 일반적으로 식도 편평상피세포 이형성으로 여겨지는 병변은 통상 내시경 관찰에서는 발견이 어려우며, 주위의 식도 점막과 유사하게 관찰되는 평활한 표면 점막에서 요오드 염색 후에 발견되는 경우가 많다. 요오드 용액 산포 시 이형성 영역은 염색이 되지 않는데, 이는 글리코겐(glycogen)이 정상 식도 편평상피의 심층에 풍부하여 글리코겐을 소실한 점막 부위에는 염색이 되지 않기 때문이다[15,16]. IIb 형태의 조기 식도암이나 고도 이형성 병변의 요오드 염색의 특징은 부정형이고 가장자리가 뾰족뾰족한 돌출을 보이는 황색조의 경계가 명료한 불염대 병변이며(Fig. 2B, C), 염색 후 시간이 경과하면 불염대 내에 분홍색(salmon pink)의 색조를 나타내는 부분이 출현하는 경우가 많다(pink color sign) (Fig. 2C). 이에 비하여 저도 이형성 병변은 부정형의 요오드 불염 소견을 보이는데, 자세히 관찰 시 불염부의 표면은 약하게 염색되며 내부에는 좀 더 진하게 염색되는 부분이 있는 경우가 많은데(Fig. 2A), 이는 고도 이형성 병변에 비하여 글리코겐이 일부 남아 있기 때문으로 생각된다[17].
최근 협대역 영상(narrow-band imaging, NBI)과 같은 영상 강화 내시경(image-enhanced endoscopy, IEE)의 사용이 증가함에 따라 이전에는 요오드 염색을 시행하지 않으면 발견할 수 없었던 병변도 IEE로 발견이 가능해졌다[18]. NBI 관찰 시 이형성 병변은 흔히 다갈색의 영역이 존재하는, 경도의 함요를 나타내는 병변으로 보이며, 내부에는 상피 유두 내 모세혈관 루프(intraepithelial papillary capillary loop, IPCL)의 증식이 관찰되지 않는다(Fig. 2A). 함요를 나타내는 이형성 병변은 IIc형 조기 식도암과의 감별이 문제가 되는데, IIc형 m1 암의 경우에는 다갈색의 점막 변화 내에 IPCL 증식, 확장, 사행, 구경부동 등이 관찰된다(Fig. 2C) [18,19]. 따라서 NBI 관찰 시에 다갈색의 점막 변화 내에 IPCL 증식 유무를 확인하는 것이 암과의 감별에 도움이 된다. NBI로 발견된 병변을 다시 백색광으로 관찰하면 옅은 발적을 나타내는 함요성 병변으로 관찰된다. 즉, NBI로 병변 발견 후에는 백색광 관찰에서도 병변 인식이 가능하다. 그러나 짧은 시간 내에 식도를 관찰하는 현재의 검사 체계에서는 백색광 관찰만으로 발견이 어려우므로, 상세한 점막 변화를 관찰하기 위한 보조 진단법으로 NBI와 같은 IEE를 사용하는 것이 추천된다.
이형성을 나타내는 병변에는 발적을 나타내는 함요성 병변뿐만 아니라 평편한 병변 및 백색 또는 발적을 보이는 융기성 병변이 있다. 이형성으로 진단되는 융기성 병변(IIa)은 대부분 표면에 미세한 요철이 발견되는, 전체적으로는 높이가 낮은 융기로 보인다. NBI 관찰 시 저도 이형성의 경우 IPCL 증식이 관찰되지 않지만 고도 이형성의 경우는 IPCL 증식이 관찰된다(Fig. 2B). 그러므로 IIa형 m1 암과 편평유두종(squamous papilloma)과의 감별을 위해서는 요오드 염색이 유용하다. IIa형 암은 황색조의 불염대 병변으로 보이고, 편평유두종은 표면이 진하게 염색된다. 반면 이형성의 경우 전체적으로는 불염대 소견을 보이나 표면은 약하게 염색되고, 불염대 곳곳에 진하게 염색되는 부분들이 관찰된다[20].
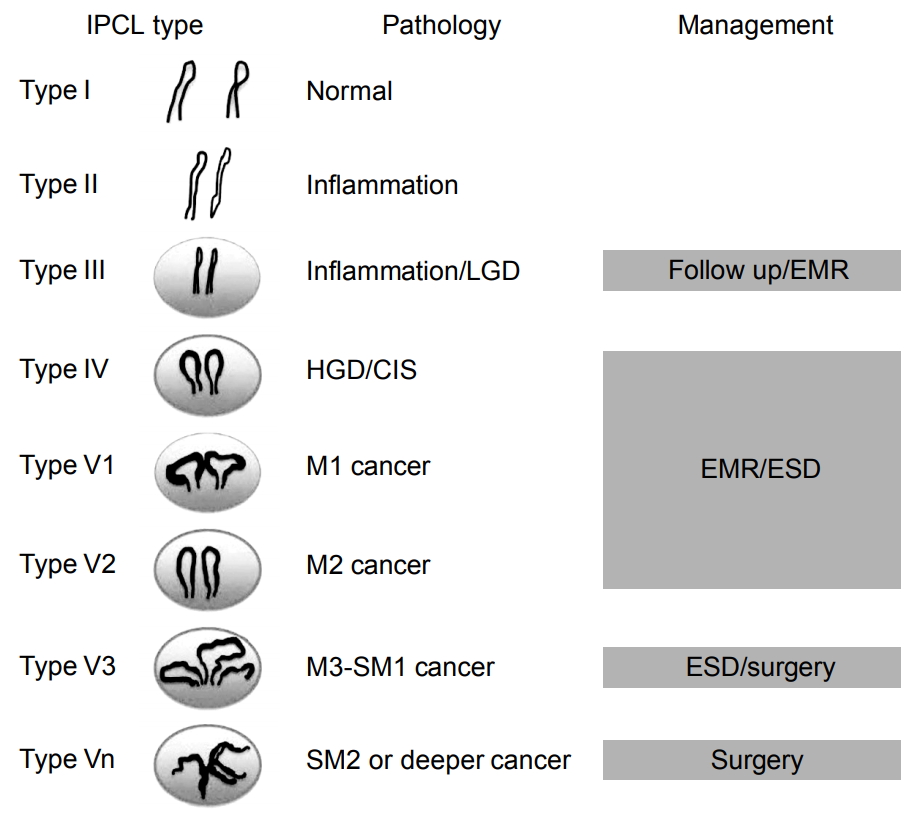
최근 고해상도 확대 내시경의 등장으로 편평상피 영역에서 IPCL 패턴을 관찰함으로써 조직의 이형성도를 어느 정도 추정할 수 있다[21]. 여기에 NBI와 같은 IEE의 등장으로 갈색 고리 모양의 점들로 나타나는 IPCL을 더욱 선명하게 관찰할 수 있게 되었다. 상피내암에서는 요오드에 염색되지 않는 부위(불염대)에서 IPCL의 변화인 ‘확장, 사행, 구경부동, 형상 불균일’의 4개 요소가 발견되는 경우가 많다[22]. IPCL 패턴은 type I (정상 점막)에서 type V까지 나뉘어진다(Fig. 3). Type II는 염증에 해당하고 type III는 염증이나 저도 이형성, type IV, V는 고도 이형성이나 편평세포암종에 해당한다. Type V1은 m1 암에 해당하는 경우가 많으며, 이는 조직의 구조 이형성을 반영하고 있는 것으로 추정된다. 여기서 중요한 것은 편평한 작은 병변에서 내시경적 이형성의 진단이 치료의 방침에 반영되는 것으로, type III는 경과 관찰, type IV 이상은 내시경 점막 절제술이나 내시경 점막하 박리술 등과 같은 내시경 치료의 대상이 된다[21,23,24]. 최근 세포내시경(endocytoscopy)을 사용한 세포 관찰을 통하여 내시경적 이형성의 진단이 시도되고 있어 장래에 내시경적 이형도의 진단에 상용될 것으로 기대된다[25].
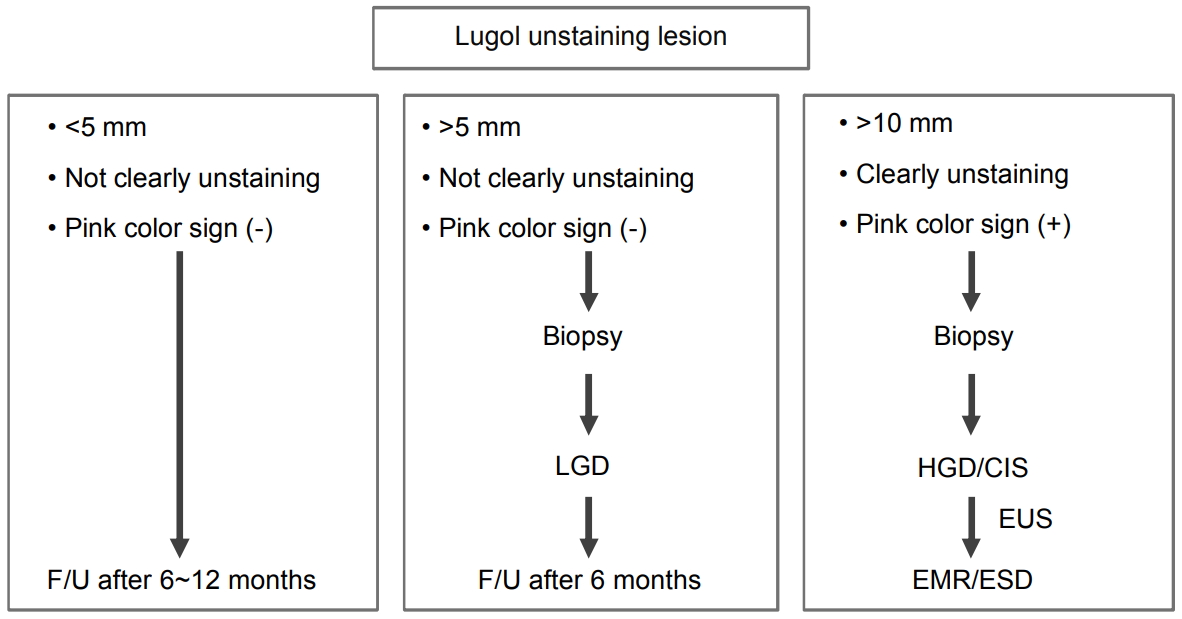
저자의 이전 연구에 의하면 식도 이형성 및 조기 식도암의 경우 내시경 생검 결과와 내시경 절제술 후 병리 결과가 일치하지 않는 경우는 34.5%이며, 이 중 대부분의 경우에서 조직학적 등급이 높아졌다[26]. 그러므로 내시경 검사 시 이형성이나 식도암 의심 병변을 발견한 경우, 요오드 염색을 시행하여 불염대의 형태를 잘 관찰하고 조직검사 결과를 확인한 후 치료 방침을 결정하는 것이 바람직하다(Fig. 4) [20].
1) 크기 5 mm 이상, 경계가 명료한 부정형의 불염대이고, 가장자리가 뾰족뾰족한 돌출을 나타내면서 pink color sign 양성인 요오드 불염대는 암일 가능성이 많으며(Fig. 2C), 크기가 10 mm를 넘는 경우에는 조직검사를 시행하고 암으로 진단될 경우 내시경 절제술을 시행한다. 만일 이형성으로 진단되어도 내시경 소견에서 암이 의심되는 경우에는 환자에게 충분히 설명한 뒤 전 생검 목적으로 내시경 절제술을 시행한다. 경우에 따라서는 10 mm 이하의 경우에서는 생검을 시행함으로써 병변의 존재 진단이 어려워지는 경우도 있으므로, 3개월 후에 다시 검사를 시행하여 확대 관찰이나 IEE 관찰로 병소 내부의 IPCL을 확인하고 암이 의심되는 경우에는 전 생검 목적으로 내시경 절제술을 시행한다.
2) 크기가 5 mm 이상, 경계가 명료하고 부정형이기는 하지만 비교적 일정한 형태를 나타내고, 가장자리도 약간 둥근 느낌이 있는 불염대이며, 불염대의 표면이 요오드로 담염되는 경우에는 이형성의 가능성이 많다(Fig. 2A, B). 10 mm를 넘는 증례는 적으나 크기가 큰 경우에는 진단 목적으로 조직을 생검한다. 이형성으로 진단되어도 크기가 큰 경우에는 일부에 암이 포함되어 있을 가능성을 부정할 수 없으므로 내시경 절제술이 필요하다. 하지만 병변이 갑자기 커지는 경우는 거의 없으므로 서둘러 치료 계획을 세울 필요는 없다. 크기가 5~10 mm, 불염대 표면이 약하게 염색되는 경우에는 6개월 후에 다시 검사를 실시하여 이상이 있다고 지적된 요오드 불염대의 존재 부위를 확실히 기재해둔다. 재검 시에는 확대 관찰이나 IEE 관찰을 시행하고, 병소 내부의 IPCL의 유무를 확인한다. 내부에 IPCL의 증식이 관찰되는 경우에 암이 의심되면 전 생검 목적으로 내시경 절제술을 시행한다. 재검 시에 빈번하게 요오드 염색을 시행하면 요오드에 의한 식도 점막 자극이 강하기 때문에 요오드 염색에 의하여 식도 점막 상피가 박리되고, 이후 재생 상피가 형성되어 일시적으로 병변의 형태 및 경계가 변화되어 존재 진단을 어렵게 하는 경우가 있으므로 주의가 필요하다.
CONFLICTS OF INTEREST
Gwang Ha Kim is an editor-in-chief of the Journal but did not involve in the peer reviewer selection, evaluation, or decision process of this article. No other potential conflicts of interest relevant to this article were reported.
Fig. 1.
Histopathologic findings of esophageal squamous dysplasia. (A) Low-grade dysplasia (H&E, ×100). (B) High-grade dysplasia (H&E, ×100).
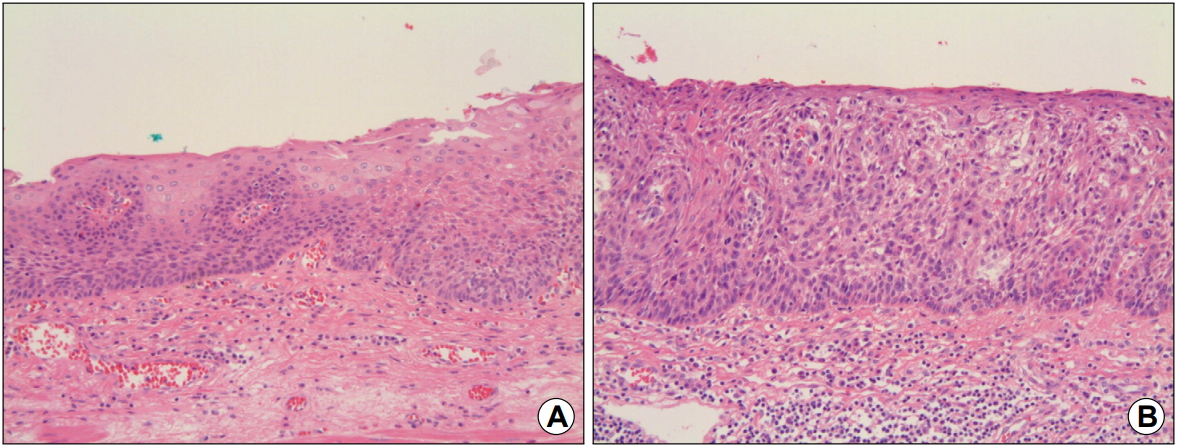
Fig. 2.
Representative cases of (A) low-grade dysplasia, (B) high-grade dysplasia, and (C) early esophageal cancer. NBI, narrow-band imaging; ME-NBI, magnifying endoscopy with narrow-band imaging.
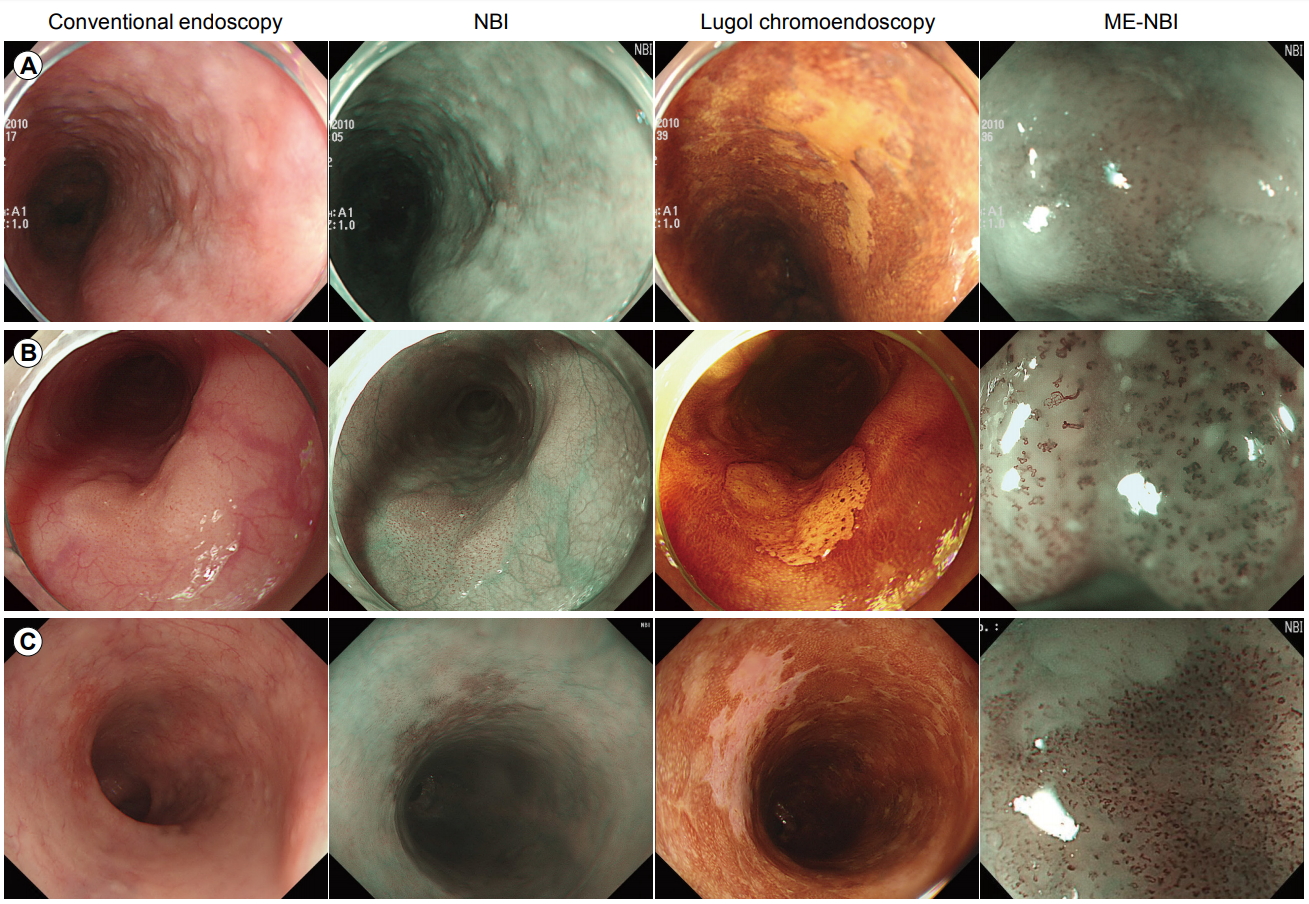
Fig. 3.
Classification of intraepithelial papillary capillary loop pattern for esophageal lesions. IPCL, intraepithelial papillary capillary loop; LGD, low-grade dysplasia; HGD, high-grade dysplasia; CIS, carcinoma in situ; EMR, endoscopic mucosal resection; ESD, endoscopic submucosal dissection. Adapted from the article of Inoue et al. Stomach Intestine 2007;42:161-171, with permission [21].
REFERENCES
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018;68:394–424.


2. Jung HK. Epidemiology of and risk factors for esophageal cancer in Korea. Korean J Helicobacter Up Gastrointest Res 2019;19:145–148.


3. Jung KW, Won YJ, Kong HJ, Lee ES.; Community of Population-Based Regional Cancer Registries. Cancer statistics in Korea: incidence, mortality, survival, and prevalence in 2015. Cancer Res Treat 2018;50:303–316.




4. Dawsey SM, Lewin KJ, Wang GQ, et al. Squamous esophageal histology and subsequent risk of squamous cell carcinoma of the esophagus. A prospective follow-up study from Linxian, China. Cancer 1994;74:1686–1692.


5. Wang GQ, Abnet CC, Shen Q, et al. Histological precursors of oesophageal squamous cell carcinoma: results from a 13 year prospective follow up study in a high risk population. Gut 2005;54:187–192.



6. Watanabe H, Jass JR, Sobin LH. Histological typing of oesophageal and gastric tumours. 2nd ed. Berlin: Springer-Verlag, 1990.
7. Kuwano H, Baba K, Ikebe M, Adachi Y, Toh Y, Sugimachi K. Histopathology of early esophageal carcinoma and squamous epithelial dysplasia. Hepatogastroenterology 1993;40:222–225.

8. Kuwano H, Watanabe M, Sadanaga N, Ikebe M, Mori M, Sugimachi K. Squamous epithelial dysplasia associated with squamous cell carcinoma of the esophagus. Cancer Lett 1993;72:141–147.


10. Saeki H, Kimura Y, Ito S, Miyazaki M, Ohga T. Biologic and clinical significance of squamous epithelial dysplasia of the esophagus. Surgery 2002;131(1 Suppl): S22–S27.


11. Schlemper RJ, Dawsey SM, Itabashi M, et al. Differences in diagnostic criteria for esophageal squamous cell carcinoma between Japanese and Western pathologists. Cancer 2000;88:996–1006.



12. Gabbert HE, Shimoda T, Hainaut P, Nakamura Y, Field JK, Inoue H. Squamous cell carcinoma of the oesophagus. In: Hamilton SR, Aaltonen LA, editors. Pathology and genetics of tumours of the digestive system. World Health Organization classification of tumours. Lyon: IARC Press, 2000. p. 8–19.
13. Dawsey SM, Wang GQ, Weinstein WM, et al. Squamous dysplasia and early esophageal cancer in the Linxian region of China: distinctive endoscopic lesions. Gastroenterology 1993;105:1333–1340.


14. Shimizu M, Ban S, Odze RD. Squamous dysplasia and other precursor lesions related to esophageal squamous cell carcinoma. Gastroenterol Clin North Am 2007;36:797–811.


15. Dawsey SM, Fleischer DE, Wang GQ, et al. Mucosal iodine staining improves endoscopic visualization of squamous dysplasia and squamous cell carcinoma of the esophagus in Linxian, China. Cancer 1998;83:220–231.


16. Hashimoto CL, Iriya K, Baba ER, et al. Lugol's dye spray chromoendoscopy establishes early diagnosis of esophageal cancer in patients with primary head and neck cancer. Am J Gastroenterol 2005;100:275–282.


17. Shimizu Y, Omori T, Yokoyama A, et al. Endoscopic diagnosis of early squamous neoplasia of the esophagus with iodine staining: high-grade intra-epithelial neoplasia turns pink within a few minutes. J Gastroenterol Hepatol 2008;23:546–550.


18. Park JM. Endoscopic techniques for early detection of esophageal cancer. Korean J Helicobacter Up Gastrointest Res 2019;19:149–155.


19. Lee MW, Kim GH, I H, et al. Predicting the invasion depth of esophageal squamous cell carcinoma: comparison of endoscopic ultrasonography and magnifying endoscopy. Scand J Gastroenterol 2014;49:853–861.


20. Momma K, Yoshida M, Fujiwara J, et al. Squamous cell dysplasia of the esophagus – studies on endoscopic findings and clinical management. Stomach Intestine 2007;42:147–159.
21. Inoue H, Kawa M, Sato Y, et al. Endoscopic diagnosis of tissue atypia (EA) in the esophageal squamous epithelium – IPCL pattern classification and ECA classification. Stomach Intestine 2007;42:161–171.
22. Inoue H, Honda T, Nagai K, et al. Ultra‐high magnification endoscopic observation of carcinoma in situ of the esophagus. Dig Endosc 1997;9:16–18.

23. Kumagai Y, Toi M, Inoue H. Dynamism of tumour vasculature in the early phase of cancer progression: outcomes from oesophageal cancer research. Lancet Oncol 2002;3:604–610.


24. Gong EJ, Kim DH. Endoscopic treatment for esophageal cancer. Korean J Helicobacter Up Gastrointest Res 2019;19:156–160.


-
METRICS

-
- 2 Crossref
- 10,499 View
- 206 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Diagnosis of Adenocarcinoima of the Esophageal Junction2012 September;12(3)
Medical and Endoscopic Management of Achalasia2014 June;14(2)