서 론
식도게실(esophageal diverticulum)은 드문 식도 질환으로 내시경이나 식도조영술(esophagography) 검사를 시행하면 가끔씩 관찰된다. 식도게실은 대부분 증상이 없으나 일부에서는 삼킴곤란, 역류, 흉통, 구취(halitosis), 목 이물감(globus) 등의 증상을 일으킨다[1]. 증상이 있는 식도게실은 치료가 필요하며, 전통적으로는 수술적인 치료가 이루어져 왔다[2]. 과거에는 주로 Zenker 게실에서 경성 내시경 혹은 연성 내시경을 이용한 중격 절개술(septotomy)이 시행되었으나, 최근에는 식도 내시경 점막하 터널 절제술(endoscopic submucosal tunnel dissection)을 이용한 치료 내시경 경험이 쌓이면서 Zenker 게실 및 다른 식도게실에 대해서도 다양한 방식의 내시경 치료가 적용되고 있다[3].
본고에서는 식도게실의 정의, 분류, 진단 및 치료에 대해 정리하며 특히 최근 발표되고 있는 새로운 내시경 치료에 대해서 소개하고자 한다.
본 론
1. 식도게실의 분류, 역학 및 임상상
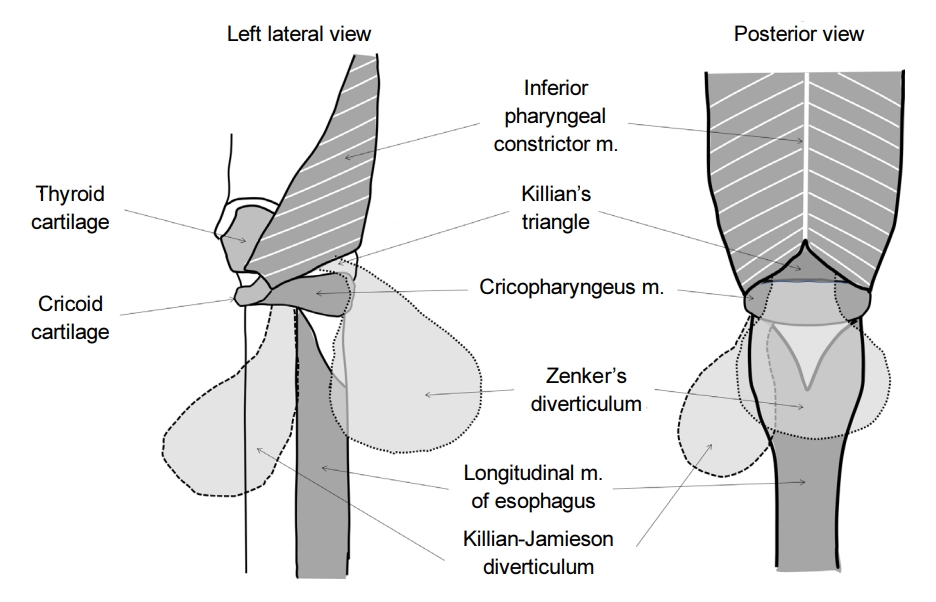
식도게실은 크게 게실이 식도 벽 전층을 포함하는 진성 게실(true diverticulum)과 근육층이 소실된 부위로 점막 및 점막하층이 빠져나오는 가성 게실(false diverticulum)로 분류할 수 있다. 또한 식도게실은 발생 기전에 따라서 내강 내 압력 증가로 인한 탈장(herniation)으로 인해 생기는 압출형 게실(pulsion diverticulum)과 식도 벽 외부, 종격동, 기관지, 림프절의 염증 반응으로 인해 식도벽이 관강 밖으로 잡아당겨지는 견인형 게실(traction diverticulum)로 나뉠 수 있다. 압출형 게실은 가성 게실인 경우가 많으며, 견인형 게실은 모두 진성 게실이다. 식도게실은 위치에 따라서 주로 경부 식도에 발생하는 Zenker 게실, 중부 식도에 발생하는 게실(Rokitansky diverticulum) 그리고 횡격막 상방의 하부식도에서 발생하는 횡격막 상부 식도게실(epiphrenic diverticulum)로 구분할 수 있다.
위치에 따른 분류는 발생 기전과 밀접하게 연관되어 있다. 식도게실의 발생기전이나 병태생리는 잘 알려져 있지는 않다. 하지만 Zenker 게실이나 횡격막상부 식도게실은 식도의 기능 장애와 동반되어 있으며, 가성 게실이면서 압출형 게실이다. 특히 횡격막상부 식도게실은 식도이완불능증(achalasia)이나 미만성 식도경련증(distal esophageal spasm)과 연관되어 있는 경우가 많다[4]. 반면 중부 식도의 게실은 대부분 진성 게실이고 종격동 염증에 의한 견인형 게실이다. 우리나라에서 가장 흔한 종격동 염증의 원인은 결핵이며, 결핵에 의한 식도게실의 경우 색소 침착(anthracotic pigmentation)이 동반되어 있는 경우를 확인할 수 있다.
식도게실 중 가장 흔한 것은 Zenker 게실이다. 사실 가장 흔하다고 해도 유병률은 0.01~0.11%, 연간 발생률은 100,000명당 2명 정도로 드물며, 인종이나 지역에 따른 변이도 알려져 있어서 서양인에 비해 동양인에서 더 드물게 보고된다[5]. Zenker 게실은 주로 남성, 70대 이후에 가장 흔한 것으로 알려져 있다[6]. 다만 이러한 역학적인 특성은 주로 증상이 있는 환자에 대한 것이므로 무증상 환자를 포함한 유병률은 알기 어렵다. Zenker 게실은 식도 점막이 갑상인두근(thyropharyngeus muscle)과 윤상인두근(cricopharyngeus muscle) 사이의 Killian’s triangle을 통해 후방으로 빠져나오게 되면서 발생한다. Zenker 게실의 변형으로는 Killian-Jamieson 게실이 있는데, 이는 윤상인두근과 식도의 윤상근(circular muscle), 종주근(longitudinal muscle) 사이의 공간을 통해 측면으로 식도 점막이 빠져나오게 되면서 발생한다(Fig. 1). 실제 임상에서는 식도조영술과 내시경 검사를 시행하였을 때 Zenker 게실은 식도 후벽에서, Killian-Jamieson 게실은 식도 전외측에서 관찰되는 것으로 구분할 수 있다[7]. 전술한 바와 같이 Zenker 게실은 가성 게실이며 압출형 게실이다. 아마도 상부식도조임근(upper esophageal sphincter, UES)의 신전성(compliance) 저하와 관련이 있을 것으로 생각되지만 정확한 기전은 알려져 있지 않다[8]. 일부 연구에서는 인후두의 수축과 UES의 열림 사이의 조화운동불능(incoordination)이 Zenker 게실 환자에서 확인되었다고 보고하고 있다[9,10].
Zenker 게실이 증상을 일으키는 기전은 다음과 같다[11]. 처음에는 Zenker 게실로 인한 증상이 경미하지만, 게실주머니로 음식이나 물이 넘어가게 되면서 게실이 점차 커지고 아래로 쳐지게 되면 게실주머니가 식도 내강을 누르게 된다. 증상이 심한 Zenker 게실인 경우에는 식도 내강은 매우 좁아져 있으면서 대부분의 음식물이 게실주머니로 내려가게 되면서 증상을 유발하게 된다. 이 경우 목에 덩어리가 만져지는 것(cervical borborygmus)이 특징적이며, 증상이 심한 경우 잘 먹지 못하게 되어 체중 감소 및 영양 결핍이 발생할 수 있다[12]. 목이 쉼(hoarseness), 기침, 흡인성 폐렴은 30~40%의 환자에서 보고되고 있다[13]. 소화되지 않은 음식물의 역류(regurgitation) 및 구취 등도 흔하다. 일부 환자에서는 복용 중인 알약이나 캡슐이 게실주머니 내에 걸려서 약 효과가 떨어질 수 있다[14]. Zenker 게실의 궤양이나 출혈도 발생할 수 있고 내시경적 지혈술이 필요한 경우가 있으며[15,16], 드물게는 목 통증, 객혈이나 토혈과 같은 경고 증상(alarm symptom)이 있는 경우 Zenker 게실주머니(diverticular sac) 안에 편평상피세포암(squamous cell carcinoma)이 동반되어 있을 수 있고 유병률은 Zenker 게실 환자의 0.4~1.5%로 알려져 있다[17,18].
한편 횡격막상부 식도게실은 식도 하부, 좌측보다는 우측 식도벽에 주로 발생하며, 위 분문부(cardia)에서 4~8 cm 상방에서 기원한다[19]. 횡격막상부 식도게실의 유병률은 이전 연구에 따르면 0.015% 정도이며, 전체 식도게실의 10% 미만을 차지하는 드문 질환이다. 전술한 바와 같이 식도운동장애와 동반되는 경우가 많아서 진단 및 치료에서 주의가 필요하다[20].
최근 아칼라지아 치료로 경구 내시경 근절개술(per oral endoscopic myotomy, POEM)을 많이 시행하고 큰 표재성 식도암 혹은 식도 상피하종양의 치료로 점막하 터널링 내시경 절제술(submucosal tunnelling endoscopic resection) 방법이 많이 적용되면서, 해당 시술 후 의인성 게실(iatrogenic diverticula)의 발생에 대한 우려가 있다. 특히 하부식도의 우측 벽은 해부학적으로 약하여 게실이 생기기 쉬우므로 POEM 시술 후 비정상적인 식도 체부 수축이 남아 있는 경우 이 부위에 의인성 게실이 발생할 수 있다[21,22]. 따라서 해당 시술 전에는 식도 내압 검사를 시행하여 type III 아칼라지아 혹은 Jackhammer esophagus와 같은 식도운동장애가 동반되어 있는지 확인하고 근절개술을 시행할 때 이를 고려하여 긴 근절개술을 시행해야 시술 후 의인성 게실이 발생하는 것을 예방할 수 있다[1].
2. 식도게실의 진단
대부분의 식도게실은 상부위장관 내시경에서 확인할 수 있다. 다만 Zenker 게실인 경우 내시경 검사 시 각별한 주의가 필요한데 내시경 경험이 많지 않은 시술의가 내시경을 시행하게 되면 게실주머니 쪽으로 무리하게 내시경을 진입하다가 천공이 발생할 수 있기 때문이다.
식도게실의 정확한 진단은 식도조영술로 할 수 있다[23]. 작은 Zenker 게실의 경우 정지 영상만으로는 진단이 어려울 수 있어 역동적 연속 투시 영상(dynamic continuous fluoroscopic imaging)이 필요할 수 있다. 심한 경우 조영제가 흡인되는 것을 확인할 수도 있다. 조영제가 저류되어 있는 게실주머니가 식도 후벽부에 관찰되는 경우 Zenker 게실로, 식도의 측면, 정확히는 경부식도의 근위부 전측면에서 게실이 나오면서 윤상인두근 아래로 관찰되는 경우 Killian-Jamiason 게실로 진단될 수 있다. Zenker 게실의 진단에서는 중격의 길이, 게실 입구의 직경, 게실주머니의 크기, 식도와 게실주머니 사이의 연부 조직의 두께 등을 평가하는 것이 중요하며 이를 통해 최선의 치료 방법을 결정할 수 있다[24]. 크기가 큰 Zenker 게실의 경우 경부 초음파로 확인되기도 하고[25], 게실 치료 전 전산화단층촬영(computed tomography)을 시행하여 게실의 크기 및 동반된 폐와 종격동의 염증을 확인할 수 있다.
3. 식도게실의 치료
1) 수술적 치료
일반적으로 증상이 없는 게실은 특별한 치료가 필요 없다. 하지만 삼킴곤란이나 역류, 목 이물감, 구취, 만성 기침, 흡인성 폐렴 등의 전형적인 증상이 동반되어 있는 경우에는 치료가 필요하다.
우선 상부 식도게실 혹은 Zenker 게실의 외과적인 치료는 문제가 되는 게실을 제거(diverticulectomy)하거나 혹은 게실을 위쪽으로 붙이는 게실고정술(diverticulopexy)을 시행하면서 예방을 위해 윤상인두근 혹은 게실 중격(septum)에 대한 근절개술(myotomy)을 함께 시행할 수 있다[6]. 일반적으로는 전신마취 하에 좌측 경부 절개술로 시행하게 되는데, 이전 연구에 따르면 종격동염, 되돌이 후두 신경 손상(recurrent laryngeal nerve injury), 침샘 누공(salivary fistula), 식도 협착 등 심각한 합병증의 발생이 4~30%로 높게 보고되었으며, 수술로 인한 치명률도 1~2%로 보고되었다[28,29]. 앞서 설명한 바와 같이 Zenker 게실이 주로 70대 이후의 고령에서 흔하며 수술로 인한 높은 이환율 및 사망률을 고려할 때 내시경적 접근이 어려운 증례나 크기가 크고 중격의 길이가 긴 경우, 내시경적 치료를 실패한 경우에 수술적 치료를 고려할 수 있다[1]. 일반적으로 수술적인 치료는 증상을 동반하는 Zenker 게실 환자의 15~68%에서 적응증이 된다[30,31].
한편 증상을 동반하는 중부 식도게실이나 횡격막상부 식도게실의 경우에도 수술적 치료는 게실을 제거하는 것이며, 이 경우 최근에는 흉강경을 이용한 최소 침습적 수술(minimally invasive laparoscopic surgery)이 주로 이루어지고 있다[32,33]. 전술한 바와 같이 대부분의 경우 식도운동장애가 동반되어 있으므로 식도이완불능증이 동반된 경우 근절개술 및 항역류 수술(anti-reflux procedure)을 함께 시행해야 환자의 근본적인 문제를 해결하고 시술 후 발생하는 위식도 역류 질환(gastroesophageal reflux disease)을 예방할 수 있다[34].
2) 내시경적 치료
한편 이전부터 Zenker 게실에 대해서는 내시경적 치료가 시도되어 왔다. 내시경적 치료는 게실의 중격, 즉 윤상인두근을 절개하는 윤상인두근 절개술(cricopharyngotomy) 혹은 중격절개술을 시행하여 게실 입구의 예각(acute angle)을 없애 주어 기능적인 이상을 교정해 주는 것이다[12].
과거에는 주로 이비인후과에서 경성 내시경(rigid diverticuloscope)을 이용한 게실 절개술(diverticulotomy)이 많이 시행되어 왔다. 이비인후과에서는 경부 절개술을 시행하는 경부접근법과 구분하여 경구접근법으로 명명하기도 한다. 이전 연구에 따르면 경성 내시경의 시술 합병증은 7~18%로 보고되고 있는데, 이 중 치아 손상 발생은 2%, 천공은 2%, 종격동염(mediastinitis)의 발생도 약 2%로 보고되었으며, 전반적인 증상 개선 효과는 대략 90%, 재발률은 10%로 보고되었다[6,12].
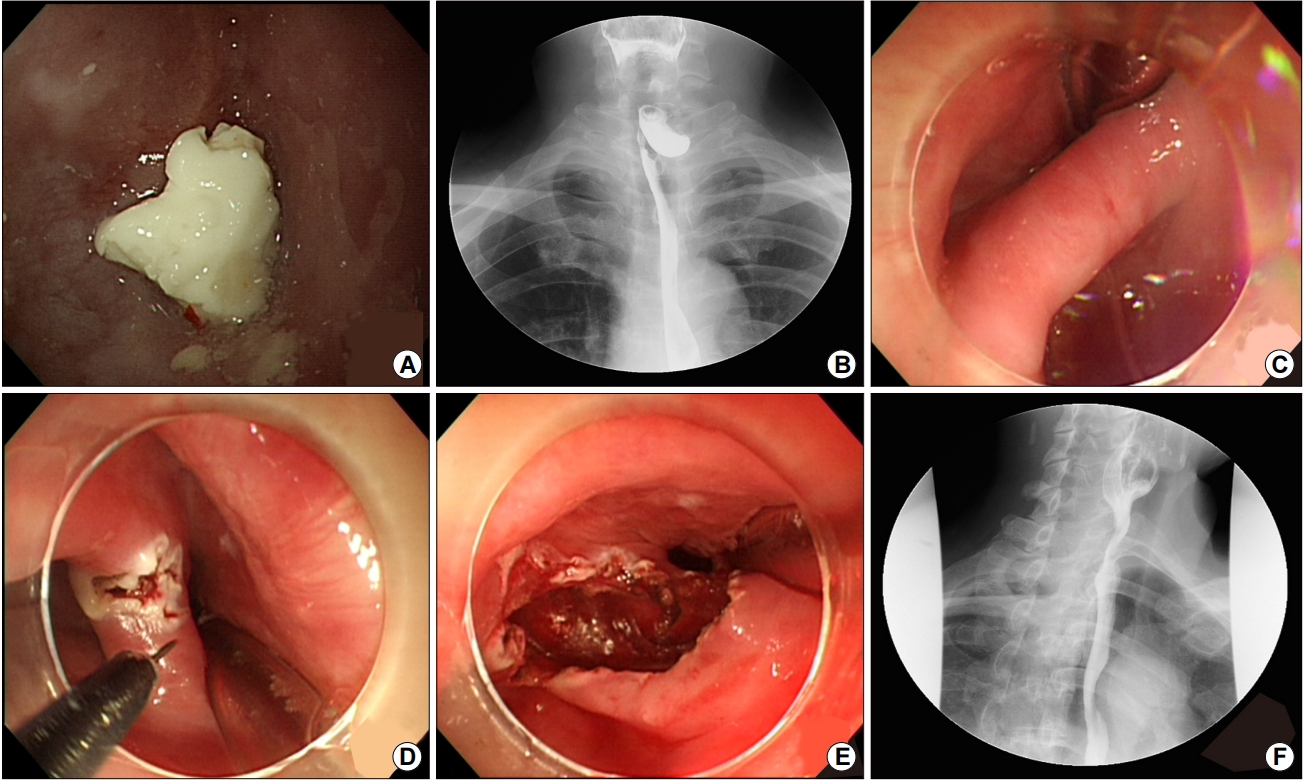
한편 1990년대 중반부터 연성 내시경(flexible endoscopy)을 이용한 중격 절개술(flexible endoscopic septum division, FESD)이 임상에서 시행되어 왔다(Fig. 2) [35]. 시술 방법은 경성 내시경을 이용한 방법과 동일하게 진행되어 중격 전층을 절개한다. 이전 연구 결과를 보면 FESD는 90% 이상의 시술 성공률과 함께 경성 내시경을 이용한 시술보다 낮은 합병증을 보여주었으며, 만족스러운 증상 호전 효과가 1년 이상 장기간 지속되며, 재발률도 11.6% 정도로 낮았다[36]. FESD는 비교적 간단한 시술이어서 Zenker 게실의 내시경 치료 방법 중 1차 치료로 인정되고 있다[37,38].
한편 최근 “third space endoscopy”가 널리 각광받으면서, Zenker 게실의 치료에 이러한 최신 술기를 적용하고자 하는 시도가 있었다. 이러한 시술은 Zenker 경구 내시경 근절개술(Zenker peroral endoscopic myotomy, Z-POEM)로 명명되며, 이는 식도이완불능증의 치료에 적용되는 경구 내시경 근절개술(POEM)과 유사한 시술이다. 이전의 FESD와 비교하면 게실 중격의 전층을 절개하는 것이 아니라 점막하 터널(submucosal tunnelling)을 시행하고 중격의 근층만 선택적으로 절개할 수 있어 점막을 보전하며(maintaining the mucosal integrity), 중격의 길이가 긴 게실에 대해서도 천공이나 종격동염과 같은 합병증 위험 없이 시술이 가능하다는 장점이 있다[36].
또한 최근 Z-POEM의 임상 성적에 대한 75명의 다국적 연구 결과를 보면 술기 자체의 성공률(technical success)은 97.3%, 평균 10개월간의 추적 관찰 기간 동안 92%의 환자에서 삼킴곤란 증상 호전 효과를 보여주었다[39]. 시술로 인한 천공 등의 합병증 발생 위험은 있으나 대부분 보존적 치료로 호전되었으며, 합병증으로 인해 수술을 시행한 증례는 보고되지 않았으며, 중환자실 입실이 필요한 정도의 심각한 합병증은 1명으로 매우 드물었다. 하지만 Z-POEM이 모든 환자에서 용이하지는 않을 수 있다. 근절개술을 하기 위해서는 중격보다 1~3 cm 근위부에 점막하 터널을 위한 입구(entry)를 만들어야 하는데 해부학적으로 상부식도조임근 위치이기 때문에 근육 경련(muscle spasm)이 발생하기 쉬워서 시술 난이도가 높은 경우가 많기 때문이다. 따라서 Z-POEM은 대부분 2 cm 이상의 긴 중격을 가지는 Zenker 게실에 대해서 우선적으로 고려한다.
한편 Z-POEM의 장점은 살리고, 시술의 편의성은 높이는 방법으로 경구 내시경적 중격 절개술(peroral endoscopic septotomy, POES) 방법이 최근 제시되었다[36,40]. POES는 상부식도 조임근 부위에 입구를 만들어 중격까지 점막하 터널을 만드는 대신 중격 시작 부위에 중격의 장경(long axis)을 따라 점막층을 절개한 후 중격 근층을 절개하는 시술이다. 시술 후에는 입구를 클립을 이용하여 봉합하여 점막의 연속성을 유지할 수 있다(Fig. 3). 최근 2 cm 미만의 중격을 가진 Zenker 게실 환자 20명에 대해서 POES를 시행한 이탈리아 임상 연구 결과가 발표되었다[41]. 모든 환자에서 전신마취 없이 시술이 진행되었으며, 시술 시간은 13.8±5.1분으로 짧았고 시술 후 95% (19/20)에서 증상 호전을 보였고, 1년 추적 관찰 기간 동안 증상의 재발은 없었다고 보고하였다. 향후 다른 연구자들의 추가 연구 결과를 주목할 필요가 있다.
정리하면 Zenker 게실의 내시경적 치료로는 고전적으로는 경성 내시경을 이용한 중격 절개술을 시행할 수 있으나, 현재는 연성 내시경을 이용한 시술이 주로 시행되고 있으며, FESD, Z-POEM, POES 방법을 적용해 볼 수 있다. 이 중 FESD와 같은 전통적인 중격 절개술 방법은 천공의 위험 때문에 중격 절개를 게실의 기저부까지 충분히 시행하기 어려워 증상의 재발 가능성이 있는 반면, Z-POEM (POES) 방법은 기저부까지 제한 없이 절개가 가능한 장점이 있다. Zenker 게실이 있더라도 증상이 없거나 70세 이상의 고령인 경우 경과 관찰이나 보존적인 치료가 선호된다. 한편 젊고 증상이 동반된 경우 적극적인 치료를 고려하게 되는데, 치료 방법의 결정은 중격의 길이 및 게실주머니의 크기가 될 것이다[42]. 2 cm 미만의 작은 게실은 FESD 혹은 POES 시술을 적용해 볼 수 있겠으며, 2 cm 이상의 중격을 가지는 큰 게실에 대해서는 POES를 포함하는 Z-POEM 시술 혹은 수술적인 치료를 고려할 수 있다.
한편 횡격막상부 식도게실에 대해서도 최근 경구 내시경 근절개술의 방법이 적용될 수 있다(Fig. 4). 통상적으로 diverticulum POEM (D-POEM)으로 명명되며, Zenker 게실의 내시경 치료와 동일하게 D-POEM은 중격 절개술을 통해 예각을 줄여주어 게실로 인한 기능 장애를 개선하는 것이 목적이다. 최근 D-POEM의 치료 성적이 보고되기 시작하고 있다[43]. 13명의 환자에 대하여 D-POEM 시술 후 2년간 추적 관찰을 시행했던 한 연구 결과를 소개하면, 13명 중 10명이 식도운동장애를 가지고 있었으며(achalasia: 6, hypercontractile esophagus: 2, unspecified: 2), D-POEM의 평균 시술 시간은 70분(범위: 40~120분), 근절개를 시행한 총 길이는 중앙값 10 cm (범위: 6~20 cm), 위 근절개를 시행한 길이의 중앙값은 3 cm (범위: 1~3 cm), 시술 성공률은 92.3% (12/13), Eckardt 점수 3점 이하로 정의되는 일차 결과(primary outcome)는 84.6% (11/13), 시술 합병증은 4명(30.7%)에서 발생되었으며 기복강(pneumoperitoneum), 점막 손상 및 누출(leakage)이 보고되었다. 시술 후 5명(38.5%)에서 역류성 식도염이 발생하였다. 이러한 결과를 보면 아직까지는 D-POEM이 임상에서 안전하게 적용될 수 있을지 추가 연구가 필요해 보인다. 하지만 횡격막상부 식도게실은 식도이완불능증과 동반되는 경우가 많으며, 이러한 식도운동장애를 함께 치료하는 것이 환자의 증상 개선 측면에서는 효과적인 접근 방법이 된다[44]. 따라서 식도이완불능증과 횡격막상부 식도게실이 함께 있는 환자에서 통상적인 내시경 근절개술과 D-POEM을 함께 시행하는 것을 고려해 볼 수 있다[45]. 다만 이러한 환자에서 게실은 치료하지 않고 내시경 근절개술만 시행해도 증상이 호전되었다는 증례보고도 있어서 실제 환자에서는 신중한 접근이 필요할 것으로 생각된다[46].
결 론
지금까지 식도게실의 분류, 진단 및 치료, 특히 최근의 내시경적 치료 방법에 대해서 알아보았다. 식도게실은 기전 및 위치 등에 따라 분류할 수 있으며, 가장 흔한 식도게실은 Zenker 게실이다. 일반적으로 증상이 없는 게실은 치료하지 않으며, 증상이 있는 게실은 수술적, 내시경적 치료 대상이 된다. 특히 내시경적 치료 방법 중 FESD뿐 아니라 최근 POES, Z-POEM, D-POEM 등이 수술에 비해 안전하고 효과적인 치료 방법으로 제시되고 있다. 국내에서도 POES, Z-POEM, D-POEM 시술 증례들이 보고되고 있다. 하지만 FESD를 제외한 내시경 치료 방법에 대한 연구 결과는 추시가 필요하다. 마지막으로 횡격막 상부 식도게실의 경우 동반된 식도운동 질환 여부 확인이 중요하며, 식도운동 질환 여부에 따라 치료 전략이 바뀔 수 있다.