 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 23(1); 2023 > Article |
|
Abstract
Gastric subepithelial tumors (SETs) are usually asymptomatic and are often detected incidentally during screening endoscopy. A gastric inverted hyperplastic polyp (IHP) is characterized by downward growth of hyperplastic mucosa into the submucosal layer. Owing to these characteristics, a gastric IHP is frequently misdiagnosed as a SET. Gastric IHPs are asymptomatic in most cases and are discovered incidentally. Notably, IHPs may be accompanied by an adenocarcinoma or anemia owing to chronic bleeding associated with this lesion; therefore, endoscopic submucosal dissection is recommended for complete excision of IHPs measuring > 2 cm. We report a case of gastric IHP that was diagnosed during screening endoscopy in an asymptomatic patient. We observed a whitish purulent exudate expressed from the SET, and endoscopic ultrasonography revealed a SET originating from the muscularis mucosa. Endoscopic submucosal dissection was performed to remove the SET, and final histopathological findings revealed a gastric IHP. This case report highlights that IHPs should be suspected in patients with a SET associated with whitish exudates.
위 함몰증식성 폴립은 드문 형태의 양성 폴립이며 1993년 Kamata 등[1]이 처음으로 대장의 유사 질환에 빗대어 함몰증식성 폴립이라고 기술하였다. 현재까지 위 함몰증식성 폴립의 병인은 정확히 밝혀지지 않았으며 일반적인 폴립들이 위의 내강쪽으로 자라는 것과 다르게 점막 성분이 점막하층을 향해 아래쪽으로 자라는 것이 특징이다. 이러한 이유로 위 함몰증식성 폴립은 상부위장관 내시경 및 내시경 초음파에서 상피하종양 또는 악성 종양으로 오인되는 경우가 많아 정확한 진단에 어려움이 있다. 위 함몰증식성 폴립은 증상이 없는 경우가 대부분이지만 간혹 만성 출혈에 의해 빈혈이 나타날 수 있으며 약 20%에서 악성 종양이 동반될 수 있다[2,3]. 저자들은 위의 위장관 기질 종양이 의심되어 내시경적 절제술을 시행한 후 병리학적으로 위 함몰증식성 폴립이 진단된 증례를 경험하여 보고하고자 한다.
45세 여성이 건강검진 상부위장관 내시경 검사에서 위 상피하종양이 의심되어 내원하였다. 환자가 호소하는 특별한 증상은 없었고 기저 질환 및 과거력, 가족력은 없었다. 생체 징후는 안정적이었고 신체 검진에서 특이 소견은 없었으며 혈액 검사에서도 이상 소견은 없었다. 상부위장관 내시경 검사에서 정상 위점막을 보이는 약 2.0 cm 크기의 상피하종양이 위 분문에서 관찰되었고, 상피하종양 외에 다른 내시경 소견은 관찰되지 않았다. 상피하종양을 겸자로 눌렀을 때 단단한 경도를 보였고 종양의 중심부는 미란성 변화가 관찰되었으며 이곳에서 끈적한 점액물질이 흘러나오고 있었다(Fig. 1). 내시경 검사 시 시행한 조직 검사에서는 방추상세포의 증식이 관찰되었다. 내시경 초음파 검사에서 2.0 cm 크기의 저에코성의 경계가 뚜렷한 불균질성 종양이 확인되었고, 낭성 변화 등의 다른 변화는 관찰되지 않았으며 병변은 점막근층에서 기원하여 외부 구조물에 의한 압박을 배제할 수 있었다(Fig. 2). 복부 전산화단층촬영에서는 상부 체부의 2.0 cm 크기의 상피하종양 외에는 특이 소견은 보이지 않았다.
이상의 소견으로부터 점막근층에서 기원하는 위점막하 종양을 의심하였으며 표면에 미란성 변화도 동반되어서 내시경적 절제술을 통한 제거를 계획하였다. 진정 내시경으로 내시경하 점막하 박리술을 시행하였고, 특별한 합병증 없이 시술을 종료하였다(Fig. 3). 육안적으로 절제된 병변은 2.0×2.0 cm 크기를 보였다. 제거된 조직은 조직학적으로는 인접한 점막의 점막근층에 연결되는 평할근 다발로 둘러싸여 있는 모양을 보였다. 고배율상에서는 정상 위점막 구조를 보존하고 있었고 내강과 연결되는 함몰된 중심부는 위소와상피세포의 증식 및 관찰이 관찰되었으며 점막하층은 염증세포의 침윤 및 산재된 평활근이 관찰되었다(Fig. 4). 이러한 조직 소견을 근거로 환자는 최종적으로 위 함몰증식성 폴립으로 진단 후 추가적인 처치 없이 추적 관찰 중에 있다.
이 연구는 가톨릭중앙의료원 임상연구심사위원회(CMC IRB)의 심사 후 심사 면제를 받았다(OC22ZASI0159/2022-3372-0001).
국가암검진사업의 시행으로 40세 이상 우리나라의 국민은 매 2년마다 상부위장관 내시경 검사를 시행받게 되면서 무증상인 상태에서 우연히 발견되는 상피하종양의 빈도가 증가하고 있다. 국내에서 위 상피하종양의 유병률은 1.7%로 보고되었으며 위 상피하종양의 원인은 혈관성 병변, 낭종, 지방종, 위장관 간질 종양, 평활근종, 유암종, 이소성 췌장, 림프종 등과 같은 양성부터 악성 종양까지 다양하다[4]. 이 중 대부분은 증상이 없고 내시경 검사만으로도 어느 정도 감별진단이 가능하고, 더 이상의 검사 및 치료가 필요하지 않은 경우가 많다.
무증상으로 발견된 성인의 위 상피하종양에 대한 국내 가이드라인은 아직 없다. 일본과 미국 가이드라인을 검토해보면 1) 종양의 크기가 2 cm 이상으로 크거나 2) 출혈 또는 폐쇄 등의 증상이 동반된 경우, 3) 악성화를 의심할 만한 소견(불규칙한 경계면, 궤양 동반, 급격한 크기 변화, 불균질한 성상)이 있는 경우에는 위 상피하종양의 수술적 제거를 권유한다. 내시경 절제의 기준은 명확히 제시되어 있지 않으나 크기가 2 cm 이하이고 고유근층을 침범하지 않은 경우에는 내시경 절제가 가능한 것으로 보고되고 있다[5,6]. 본고에서는 건강검진으로 시행한 위내시경 검사에서 우연히 발견된 위 상피하종양 소견으로 내원한 환자에서 내시경적 점막하 박리술을 통해서 위 함몰증식성 폴립을 진단한 증례를 소개하였다.
위 함몰증식성 폴립은 위의 내강을 향해 자라는 일반적인 증식성 폴립과 달리 점막하층 또는 점막근층을 향해 자라는 소견을 보인다. 따라서 병리학적으로 진단되기 전까지는 상피하종양으로 종종 오인된다. 주요 발병 위치는 상부 체부와 기저부이며 명확한 발생 원인 및 병태생리에 대해서는 알려진 바가 없으나 선천적 이형성 또는 후천적 염증의 두 가지 가설이 제기되고 있다. 최근에는 반복되는 상피 조직의 염증이 점막근층의 균열을 만들고 치유 과정에서 발생하는 조직의 변형이 점막하층으로 자라는 폴립을 형성한다는 후천적 염증 가설이 제시되고 있다[7-9].
위 함몰증식성 폴립 자체는 양성 병변이며 악성 종양과의 연관성이 명확히 알려져 있지 않으나 함몰증식성 폴립 내에서 위샘암종이 함께 보고되는 경우가 20% 정도이다[2,10,11]. 이는 폴립 속의 과증식성에서 이형성으로의 이행 부위와 이형성에서 샘암종으로의 이행 부위가 관찰되므로 과증식성-이형성-샘암종으로의 이행을 통해 함몰증식성 폴립에서 악성 종양이 발생할 수 있음을 시사한다. 따라서 2 cm 이상 크기의 함몰증식성 폴립에서는 이형성 또는 악성화 가능성이 있으므로 정확한 진단과 치료가 필요하다. 이러한 악성 동반 위험성 때문에 위 함몰증식성 폴립 환자에서 내시경 점막하 박리술 등을 통한 병변의 완전 절제와 조직학적 진단을 권유한다[2,8,10,12].
위 함몰증식성 폴립은 2016년도부터 현재까지 본 증례를 포함하여 7개의 문헌에서 19개의 증례가 보고되었다(Table 1). 증례를 고찰하였을 때 환자들의 평균 연령은 53세로 남성 10명(52%), 여성 9명(28%)으로 성별 간의 유의한 차이는 없었다. 증상에 대해 언급한 7개의 증례를 분석하였을 때 무증상이 4명(57%)으로 가장 많았고 복부불편감 2명, 전신쇠약감 1명이 뒤를 이었다. 폴립의 위치는 체부가 15예(79%)로 가장 많이 발견되었고, 기저부 2예, 전정부 1예, 분문부 1예 순이었으며 폴립의 크기는 18개의 증례를 분석한 결과 평균 2.6 cm였고 폴립의 모양은 이전의 Yamada I, II 유형을 sessile, Yamada III, IV 유형을 pedunculated로 구분하였을 때 sessile이 16예(89%), pedunculated가 2예(11%)로 sessile이 우세하였다. 폴립의 특징은 미란/궤양성 변화가 9예(47%)로 가장 많았고, 백색의 점액물질이 관찰된 증례는 본 증례 포함 3예가 있었으며, 정상 점막의 특징만을 보이는 증례도 4예가 있었다. Gastric wedge resection로 제거한 2개의 증례를 제외하고는 17개의 증례 모두 내시경 점막하 박리술을 이용하여 폴립을 완전 제거하였고, 이 중 3예(16%)에서 샘암종이 2예(10%)에서 gastric inflammatory myofibroblastic tumor이 발견되었다.
본 증례에서는 무증상 성인에서 우연히 발견된 위 상피하종양을 내시경하 점막하 박리술로 제거하여 위 함몰증식성 폴립으로 진단하였다. 이 환자처럼 위 상피하종양의 표면에서 점액물질이 보이는 경우에는 위 함몰증식성 폴립의 가능성이 있으므로 내시경적 절제술 등 적극적인 진단을 위한 시술을 권고한다.
Fig. 1.
Esophagogastroduodenoscopy image showing a submucosal mass with central ulceration in the gastric cardia.
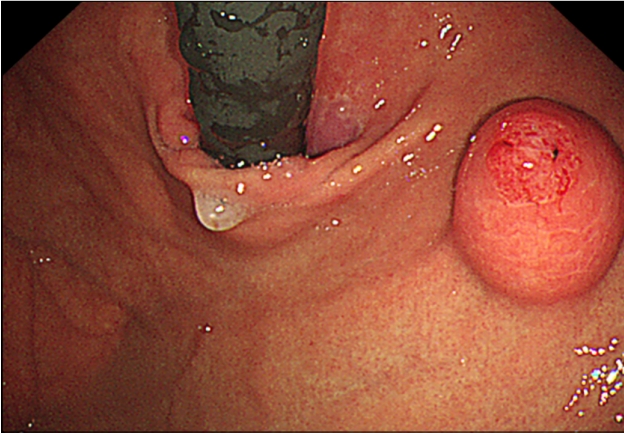
Fig. 2.
EUS image showing a heterogeneous hypoechoic tumor (24.0×17.0 mm) in the muscularis mucosa of the gastric wall (green arrow).
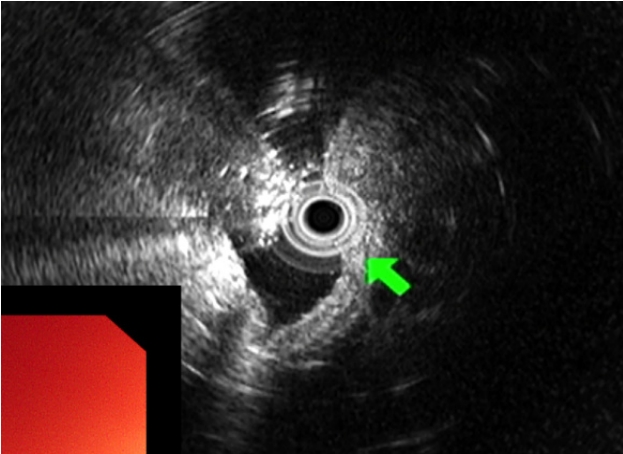
Fig. 3.
Endoscopic submucosal dissection was performed to remove the subepithelial tumor. (A) Whitish sticky mucinous material is observed at the orifice of the lesion. (B) Image showing successful endoscopic submucosal dissection. (C) Image showing the resected specimen measuring 2.0×2.0 cm.

Fig. 4.
(A) Histopathological findings (low-power view) of the resected lesion showing a well-circumscribed mass characterized by downward growth of the hyperplastic mucosa into the submucosal layer (H&E stain, ×10). (B) Magnified view showing hyperplasia and cystic dilatation of the gastric glands extending into the submucosal layer. There is no architectural or cytological atypia (H&E stain, ×100).
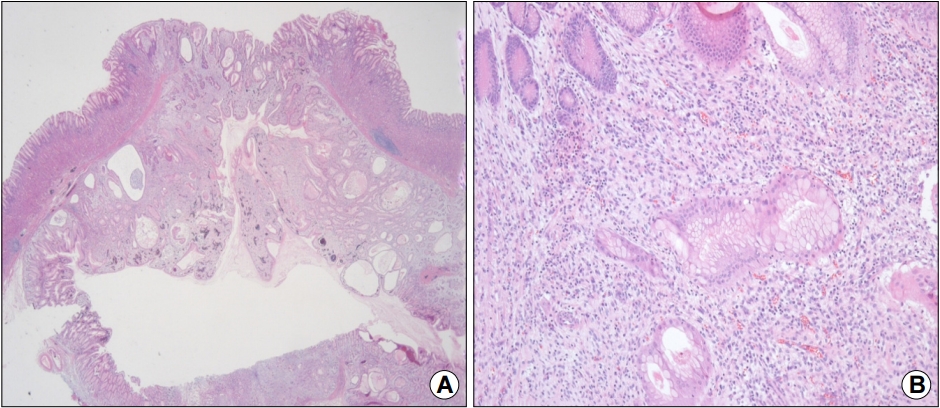
Table 1.
Cases of Gastric Inverted Hyperplastic Polyps Identified in the Published Literature
| Study | Age (years)/sex | Symptoms | Location | Gross type | Size (cm) | Associated findings | Treatment | Coexisting carcinoma |
|---|---|---|---|---|---|---|---|---|
| Lee et al. [4] (2016) | 41/M | Epigastric discomfort | HB/GC | Sessile | 1.7 | Central ulceration | ESD | No |
| Noh et al. [9] (2016) | 58/F | Asymptomatic | HB/PW | Sessile | 2.5 | Central ulceration | Gastric wedge resection | Inflammatory myofibroblastic tumor |
| Yun et al. [3] (2016) | 64/F | Dizziness general weakness | LB/GC | Sessile | 1.5 | Central erosion | ESD | No |
| Matsui et al. [13] (2018) | 37/F | Asymptomatic | Fundus | Sessile | 1.0 | Milky mucous component | ESD | No |
| Koh et al. [14] (2019) | 46/M | Asymptomatic | HB/AW | Sessile | 2.0 | Central ulceration | Gastric wedge resection | Inflammatory myofibroblastic tumor |
| Ng et al. [15] (2022) | 50/F | Abdominal pain | MB/GC | Sessile | NA | Hyperemic elevation | ESD | No |
| Kim et al. [16] (2021) | 72/F | NA | Fundus | Sessile | 2.0 | Hyperemic elevation | ESD | Yes |
| 50/M | NA | Antrum | Sessile | 1.5 | Hyperemic elevatation | ESD | Yes | |
| 51/M | NA | Body | Sessile | 1.2 | Erosion | ESD | Yes | |
| 51/M | NA | Body | Sessile | 1.4 | Depression | ESD | No | |
| 50/F | NA | Body | Sessile | 1.0 | Milky mucous component | ESD | No | |
| 34/F | NA | Body | Sessile | 1.3 | Depression | ESD | No | |
| 69/M | NA | Body | NA | 1.0 | NA | ESD | Yes (separate carcinoma) | |
| 77/M | NA | Body | Sessile | 2.5 | Erosion | ESD | Yes (separate carcinoma) | |
| 70/M | NA | Body | Sessile | 1.3 | Intact | ESD | Yes (separate carcinoma) | |
| 58/M | NA | Body | Sessile | 1.0 | Intact | ESD | No | |
| 54/F | NA | Body | Pedunculated | 1.5 | Intact | ESD | No | |
| 35/M | NA | Body | pedunculated | 2.2 | Intact | ESD | No |
REFERENCES
1. Kamata Y, Kurotaki H, Onodera T, Nishida N. An unusual heterotopia of pyloric glands of the stomach with inverted downgrowth. Acta Pathol Jpn 1993;43:192–197.


2. Odashima M, Otaka M, Nanjo H, et al. Hamartomatous inverted polyp successfully treated by endoscopic submucosal dissection. Intern Med 2008;47:259–262.


3. Yun JT, Lee SW, Kim DP, et al. Gastric inverted hyperplastic polyp: a rare cause of iron deficiency anemia. World J Gastroenterol 2016;22:4066–4070.



4. Lee YH, Joo MK, Lee BJ, et al. Inverted hyperplastic polyp in stomach: a case report and literature review. Korean J Gastroenterol 2016;67:98–102.


6. Park JJ. Long-term outcomes after endoscopic treatment of gastric gastrointestinal stromal tumor. Clin Endosc 2016;49:232–234.




7. Kono T, Imai Y, Ichihara T, et al. Adenocarcinoma arising in gastric inverted hyperplastic polyp: a case report and review of the literature. Pathol Res Pract 2007;203:53–56.


8. Kim HS, Hwang EJ, Jang JY, Lee J, Kim YW. Multifocal adenocarcinomas arising within a gastric inverted hyperplastic polyp. Korean J Pathol 2012;46:387–391.



9. Noh BJ, Min JW, Sung JY, Park YK, Lee J, Kim YW. Inflammatory myofibroblastic tumor-like stromal proliferation within gastric inverted hyperplastic polyp. Pathol Int 2016;66:180–182.



10. Lee SJ, Park JK, Seo HI, et al. A case of gastric inverted hyperplastic polyp found with gastritis cystica profunda and early gastric cancer. Clin Endosc 2013;46:568–571.




11. Mori H, Kobara H, Tsushimi T, et al. Two rare gastric hamartomatous inverted polyp cases suggest the pathogenesis of growth. World J Gastroenterol 2014;20:5918–5923.



12. Jung M, Min KW, Ryu YJ. Gastric inverted hyperplasic polyp composed only of pyloric glands: a rare case report and review of the literature. Int J Surg Pathol 2015;23:313–316.



13. Matsui S, Kashida H, Kudo M. Gastric inverted hyperplastic polyp mimicking a papilla. Am J Gastroenterol 2018;113:462.

14. Koh J, Lee KL, Lee MS, Ahn HS, Chang MS. Gastric inverted hyperplastic polyp with inflammatory myofibroblastic tumor-like stroma, mimicking GI stromal tumor. Gastrointest Endosc 2019;89:433–435.


-
METRICS

-
- 0 Crossref
- 1,304 View
- 37 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Subepithelial Tumor Diagnosed after Endoscopic Submucosal Dissection2022 December;22(4)
Strategies that Reduce Post-endoscopic Submucosal Dissection Bleeding2021 September;21(3)
Atypical Scar Patterns after Gastric Endoscopic Submucosal Dissection2021 March;21(1)






