|
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 22(1); 2022 > Article |
|
Abstract
Gastric cancer is the most prevalent malignant tumor in Korea. Histologically, it is often classified into intestinal-type and diffuse-type. Intestinal-type gastric cancer is known to occur mainly from chronic gastritis caused by Helicobacter pylori (H. pylori) through atrophic gastritis and intestinal metaplasia, a precancerous change of the mucosa, whereas diffuse-type gastric cancer is caused by H. pylori infection, wherein active inflammation of the gastric mucosa occurs without precancerous changes in the mucosa. Compared with intestinal-type gastric cancer, it occurs at a young age, there is no difference in male to female ratio, or tends to occur more in women, and is more aggressive than intestinal-type gastric cancer. Intestinal-type gastric cancer is predominant in East Asian populations such as Koreans and Japanese, whereas diffuse-type gastric cancer has more uniform geographic distribution. In the present manuscript, I have reviewed diffuse-type gastric cancer, distinct from intestinal-type gastric cancer.
ņ£äņĢöņØĆ ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ Ļ░Ćņן ĒØöĒĢ£ ņĢģņä▒ ņóģņ¢æņ£╝ļĪ£ ņĪ░ņ¦üĒĢÖņĀüņ£╝ļĪ£ ĒØöĒ׳ ņןĒśĢ(intestinal-type)Ļ│╝ ļ»Ėļ¦īĒśĢ(diffuse-type) ņ£äņĢöņ£╝ļĪ£ ļČäļźśĒĢśņŚ¼ ņ¢ĖĻĖēļÉ£ļŗż. ņןĒśĢ ņ£äņĢöņØĆ ņŻ╝ļĪ£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ (Helicobacter pylori, H. pylori)ņŚÉ ņØśĒĢ┤ ņ£Āļ░£ļÉ£ ļ¦īņä▒ ņ£äņŚ╝ņŚÉņä£ ņ£äņČĢņä▒ ņ£äņŚ╝ ļ░Å ņןņāüĒö╝ĒÖöņāØņØś ņĀäņĢö ņĀÉļ¦ē ļ│ĆĒÖöļź╝ Ļ▒░ņ│É ļ░£ņāØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŖö ļ░śļ®┤ņŚÉ, ļ»Ėļ¦īĒśĢ ņ£äņĢöņØĆ H. pyloriņŚÉ ņØśĒĢ£ ņ£äņĀÉļ¦ēņØś ĒÖ£ļÅÖņä▒ ņŚ╝ņ”ØņØ┤ ņĀäņĢö ņĀÉļ¦ē ļ│ĆĒÖöļź╝ Ļ▒░ņ╣śņ¦Ć ņĢŖĻ│Ā ļ░£ņāØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[1-4]. ņןĒśĢ ņ£äņĢöĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņĀŖņØĆ ļéśņØ┤ņŚÉ ļ░£ņāØĒĢśĻ│Ā ļé©ļģĆļ╣äņŚÉ ņ░©ņØ┤Ļ░Ć ņŚåĻ▒░ļéś ņŚ¼ņä▒ņŚÉņä£ ļŹö ļ░£ņāØĒĢśļŖö Ļ▓ĮĒ¢źņØ┤ ņ׳Ļ│Ā, ņןĒśĢ ņ£äņĢöņŚÉ ļ╣äĒĢ┤ Ļ│ĄĻ▓®ņĀü ņä▒Ē¢źņØä ļ│┤ņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[5,6]. ņןĒśĢ ņ£äņĢöņØĆ ņÜ░ļ”¼ļéśļØ╝ņÖĆ ņØ╝ļ│ĖĻ│╝ Ļ░ÖņØĆ ļÅÖņĢäņŗ£ņĢäņŚÉņä£ ņÜ░ņäĖĒĢśĻ▓ī ļ░£ņāØĒĢśļéś ļ»Ėļ¦īĒśĢ ņ£äņĢöņØĆ ņןĒśĢ ņ£äņĢöņŚÉ ļ╣äĒĢ┤ ņ¦ĆņŚŁņĀüņ£╝ļĪ£ (geographically) ļŹö ĻĘĀņØ╝ĒĢśĻ▓ī ļČäĒżļÉ£ļŗż[7]. ļ│ĖĻ│ĀņŚÉņä£ļŖö ņØ┤ņÖĆ Ļ░ÖņØ┤ ņןĒśĢĻ│╝ ĻĄ¼ļ│äļÉśļŖö ļ»Ėļ¦īĒśĢ ņ£äņĢöņŚÉ ļīĆĒĢ┤ Ļ▓ĆĒåĀĒĢ┤ļ│┤ļÅäļĪØ ĒĢśĻ▓Āļŗż.
ļ»Ėļ¦īĒśĢ ņ£äņĢöņØĆ ņ£äņĢöņØś ņŚ¼ļ¤¼ ļ│æļ”¼ĒĢÖņĀü ļČäļźś ņ▓┤Ļ│ä ņżæ Lauren ļČäļźśņŚÉ ņØśĒĢ£ļŗż. ņåīĒÖöĻĖ░ļé┤Ļ│╝ ņØśņé¼ņŚÉĻ▓ī ņØĄņłÖĒĢ£ ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀ ņŗ£ ņĀüņÜ®ļÉśļŖö ļ│æļ”¼ ļČäļźśļ▓ĢņŚÉ ņØśĒĢ£ ļ»ĖļČäĒÖöĒśĢ(undifferentiated-type) ņ£äņĢöņØś ļīĆļČĆļČäņØ┤ ļ»Ėļ¦īĒśĢ ņ£äņĢöņŚÉ ĒĢ┤ļŗ╣ļÉ£ļŗż. ņØ╝ļ│ĖņØś ļČäļźśļĪ£ļŖö signet-ring cell carcinoma (sig)ņÖĆ poorly differentiated adenocarcinoma (por) ņżæ non-solid ĒśĢĒā£(por2)Ļ░Ć ļ»Ėļ¦īĒśĢ ņ£äņĢöņŚÉ ņåŹĒĢśļ®░, World health Organization (WHO) 2019 ļČäļźś ņ▓┤Ļ│äļĪ£ļŖö poorly cohesive type (signet-ring cell phenotype, other cell types)ņØ┤ ļ»Ėļ¦īĒśĢ ņ£äņĢöņŚÉ ņåŹĒĢ£ļŗż(Table 1).
SigņÖĆ por2Ļ░Ć ļ»Ėļ¦īĒśĢ ļ░Å ļ»ĖļČäĒÖöĒśĢ ņ£äņĢöņ£╝ļĪ£ Ļ░ÖņØ┤ ļČäļźśļÉśĻ│Ā ņ׳ņ£╝ļéś ņŗżņĀ£ ņāØļ¼╝ĒĢÖņĀü Ē¢ēĒā£(biologic behavior) ņĖĪļ®┤ņŚÉņä£ ļÅÖņØ╝ĒĢśĻ▓ī ļČäļźśĒĢśļŖö Ļ▓āņØ┤ ļ¦×ļŖöņ¦ĆņŚÉ ļīĆĒĢ┤ņä£ļŖö ņóĆ ļŹö Ļ▓Ćņ”ØņØ┤ ĒĢäņÜöĒĢĀ ņłś ņ׳ļŗż. ņ£äņĢöņØ┤ ņ¦äĒ¢ēĒĢśļ®┤ņä£ ĒśĢĒā£ĒĢÖņĀü ļČäĒÖöĻ░Ć ņĀĆļČäĒÖöļĪ£ ļ│ĆĒÖöĒĢĀņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ sigņÖĆ por2ņØś ņāØļ¼╝ĒĢÖņĀü Ē¢ēĒā£ņØś ņ░©ņØ┤ļŖö ņĪ░ĻĖ░ņ£äņĢöņŚÉņä£ ņ░©ņØ┤ļź╝ ļ│┤ņØ╝ ņłś ņ׳ļŗż. ņŗżņĀ£ ņĪ░ĻĖ░ņ£äņĢö Ļ┤ĆļĀ© ņŚ░ĻĄ¼ļōżņŚÉņä£ sig ļ░Å por2 Ļ░äņŚÉ ņ░©ņØ┤ļź╝ ļ│┤ņ×äņØä ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŖöļŹ░ ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ Ēøä ņĄ£ņóģ ļ│æļ”¼ Ļ▓░Ļ│╝ņŚÉņä£ sigņØś Ļ▓ĮņÜ░ļŖö ņłśĒÅēņĀłņĀ£ņŚ░ ņ╣©ļ▓öņØ┤ ņ¢æņä▒ņØĖ Ļ▓ĮņÜ░Ļ░Ć, porņØś Ļ▓ĮņÜ░ļŖö ņłśņ¦üņĀłņĀ£ņŚ░ ņ╣©ļ▓öņØ┤ ņ¢æņä▒ņØĖ Ļ▓ĮņÜ░Ļ░Ć ņāüļīĆņĀüņ£╝ļĪ£ ļ╣łļ▓łĒĢśņśĆļŗż[8-11]. ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļČłņÖäņĀä ņĀłņĀ£ ņżæ Ļ░Ćņן ĒØöĒĢ£ ņØ┤ņ£ĀĻ░Ć porņØś Ļ▓ĮņÜ░ļŖö ņłśņ¦üņĀłņĀ£ņŚ░ ņ╣©ļ▓ö ņ¢æņä▒(51.1%)ņØ┤ņŚłĻ│Ā, sigņØś Ļ▓ĮņÜ░ļŖö ņłśĒÅēņĀłņĀ£ņŚ░ ņ╣©ļ▓ö ņ¢æņä▒(63.3%)ņ£╝ļĪ£ ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļ®░, ĻĄŁļé┤ ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ ļĀłņ¦ĆņŖżĒŖĖļ”¼ ļČäņäØ Ļ▓░Ļ│╝ņŚÉņä£ļÅä ļČłņÖäņĀä ņĀłņĀ£ņØś Ļ▓ĮņÜ░ ņłśņ¦üņĀłņĀ£ņŚ░ ņ╣©ļ▓ö ņ¢æņä▒ņØ┤ por, sig Ļ░üĻ░ü 60.0%, 25.0%, ņłśĒÅēņĀłņĀ£ņŚ░ ņ╣©ļ▓ö ņ¢æņä▒ņØĆ por, sig Ļ░üĻ░ü 26.7%, 50.0%ļĪ£ ļ│┤Ļ│ĀĒĢśņśĆ ļŗż[8-11]. ļśÉĒĢ£, ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö porĻ│╝ sigņØś 1,295Ļ░£ņØś ņłśņłĀ ļ│æļ│ĆĻ│╝ 176Ļ░£ņØś ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ ļ│æļ│ĆņØä ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ļ»Ėļ¦īĒśĢņ£╝ļĪ£ Ļ░ÖņØ┤ ļČäļźśļÉśĻ│Ā ņ׳ļŖö sigņÖĆ por2Ļ░Ć ļ”╝ĒöäņĀł ņĀäņØ┤ ļ░Å ļ”╝ĒöäĒśłĻ┤Ćņ╣©ļ▓öĻ│╝ Ļ░ÖņØĆ ņāØļ¼╝ĒĢÖņĀü Ē¢ēĒā£ņŚÉņä£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆņ£╝ļ®░, ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ ņØ┤Ēøä ņĀłņĀ£ņŚ░ ņ¢æņä▒ņŚÉ ņ׳ņ¢┤ņä£ļÅä ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż[10].
ņØ┤ņÖĆ Ļ░ÖņØĆ ņŚ¼ļ¤¼ Ļ▓░Ļ│╝ļōżņØ┤ 2010ļģä WHO classificationņŚÉņä£ poorly cohesive carcinoma ĒĢśļéśļĪ£ ļČäļźśĒĢ£ Ļ▓āņØä 2019ļģäņŚÉ ļ░£Ēæ£ļÉ£ Ļ░£ņĀĢĒīÉņŚÉņä£ļŖö poorly cohesive carcinoma ļé┤ņŚÉņä£ sig ĒśĢĒā£ņÖĆ ļŗżļźĖ ĒśĢĒā£ļĪ£ ļČäļźśĒĢ£ ņØ┤ņ£ĀņØ╝ Ļ▓āņØ┤ļŗż. ņØ┤ņÖĆ Ļ░ÖņØĆ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ļŖö ņøÉņØĖ ņżæ ĒĢśļéśļŖö sigņÖĆ porņØś ņĢöņäĖĒż ņä▒ņן Ēī©Ēä┤(growth pattern)ņØś ņ░©ņØ┤ļĪ£, ņĪ░ĻĖ░ņØś sigņØś Ļ▓ĮņÜ░ ņĢöņäĖĒżņØś ņä▒ņן Ēī©Ēä┤ņØ┤ ņĖĪļ░®ĒśĢņØ┤ ņÜ░ņäĖĒĢśĻ│Ā, porņØś Ļ▓ĮņÜ░ļŖö ņłśņ¦üĒśĢņØ┤ ņÜ░ņäĖĒĢśĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņČöņĖĪļÉ£ļŗż. ņŗżņĀ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö sigņŚÉņä£ ņŻ╝ļ│Ć ņĀÉļ¦ēņØ┤ ņ£äņČĢņä▒ ņ£äņŚ╝ņØ┤ļéś ņןņāüĒö╝ ĒÖöņāØĻ│╝ Ļ░ÖņØ┤ mechanical barrierĻ░Ć ņĢĮĒĢ┤ņĀĖ ņ׳ļŖö ļ¦īņä▒ ņĀÉļ¦ē ļ│ĆĒÖöĻ░Ć ļÅÖļ░śļÉśļŖö Ļ▓ĮņÜ░ ņĖĪļ░®ĒśĢ ņä▒ņן Ēī©Ēä┤ņØ┤ ļŹö ļæÉļō£ļ¤¼ņ¦ĆĻ▓ī ļéśĒāĆļé©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż[12,13].
Next generation sequencing, RNA sequencing, Whole genome sequencing ļ░®ļ▓Ģņ£╝ļĪ£ ņ£äņĢöņØś ļČäņ×ÉņāØļ¼╝ĒĢÖņĀü ļČäļźśĻ░Ć Ļ░ĆļŖźĒĢ┤ņĪīĻ│Ā, ņĢö Ļ▓īļåł ņĢäĒŗĆļØ╝ņŖż (The Cancer Genome Altas, TCGA) ņŚ░ĻĄ¼ ļ░Å Asian Cancer Research Group (ACRG) cohortņŚÉņä£ ņ£äņĢöņØś ļČäņ×ÉņāØļ¼╝ĒĢÖņĀü ļČäļźśļź╝ ņĀ£ņŗ£ĒĢśņśĆļŗż[14-16]. TCGA ņŚÉņä£ļŖö ņ£äņĢöņØä 4Ļ░£ņØś ļČäņ×É ĒĢśņ£ä ņ£ĀĒśĢ ņ”ē, EBV ņ¢æņä▒, microsatellite unstable, genomically stable (GS), chromosomal instabilityļĪ£ ļČäļźśĒĢśņśĆĻ│Ā, ņØ┤ ņżæ ļ»Ėļ¦īĒśĢ ņ£äņĢöņØś ļīĆļČĆļČäņØĖ ņĢĮ 73%Ļ░Ć GSļĪ£ ļČäļźśļÉśņŚłļŗż. GS ļé┤ņŚÉņä£ ļåÆĻ▓ī Ļ┤Ćņ░░ļÉ£ ņ▓┤ņäĖĒż ļÅīņŚ░ļ│ĆņØ┤ļŖö CDH1 ļÅīņŚ░ļ│ĆņØ┤Ļ░Ć ņĢĮ 37%, RHOA ļÅīņŚ░ļ│ĆņØ┤Ļ░Ć ņĢĮ 15%, CLDN18-ARHGAP ņ£ĄĒĢ®(fusion)ņØ┤ ņĢĮ 15%ņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŗż. ĒĢ£ņŚ░ĻĄ¼ņŚÉņä£ TCGA ļČäļźśļź╝ ĻĖ░ļ░śņ£╝ļĪ£ ņśłņĖĪļ¬©ļŹĖņØä ļ¦īļōżĻ│Ā ļæÉ Ļ░£ņØś ļīĆĻĘ£ļ¬© ņĮöĒśĖĒŖĖļĪ£ Ļ▓Ćņ”ØĒĢśņśĆņØä ļĢī GS cohortĻ░Ć ņłśņłĀ Ēøä ļ│┤ņĪ░ĒĢŁņĢöņÜöļ▓Ģ ņØ┤Ēøä ņ×¼ļ░£ļźĀņØ┤ ļåÆĻ│Ā ņśłĒøäĻ░Ć ļéśņü©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż[15].
ACRGņŚÉņä£ļÅä ņ£äņĢöņØä 4Ļ░£ņØś ņĢäĒśĢņ£╝ļĪ£ ļČäļźśĒĢśņśĆļŗż[16]. Ļ░Ćņן ņóŗņØĆ ņśłĒøäļź╝ ļ│┤ņØ┤ļŖö microsatellite unstableĻĄ░ ļ░Å 3Ļ░£ņØś microsatellite stable (MSS)ĻĄ░ ņ”ē, MSS/TP53-ĒÖ£ņä▒, MSS/TP53-ļ╣äĒÖ£ņä▒ ļ░Å MSS/epithelial to mesenchymal transition (EMT)ĻĄ░ņ£╝ļĪ£ ļČäļźśĒĢśņśĆļŗż[16]. ņØ┤ ņżæ TCGAņØś GSņÖĆ Ļ░Ćņן ņ£Āņé¼ĒĢ£ ĻĄ░ņØĆ MSS/EMTĻĄ░ņ£╝ļĪ£ 80% ņØ┤ņāüņØ┤ ļ»Ėļ¦īĒśĢ ņ£äņĢöņ£╝ļĪ£, CDH1 ņåīņŗż, Ļ░Ćņן ļČłļ¤ēĒĢ£ ņśłĒøä, ņ¦äļŗ© ļŗ╣ņŗ£ ņ¦äĒ¢ēņä▒ ļŗ©Ļ│ä, ļåÆņØĆ ņ×¼ļ░£ļźĀ, ļ│Ąļ¦ē ņĀäņØ┤ņØś ĒŖ╣ņä▒ņØä ļ│┤ņśĆļŗż. ļśÉĒĢ£ ļÅīņŚ░ļ│ĆņØ┤ ļ░£ņāØļźĀņØ┤ ļŗżļźĖ ĻĄ░ņŚÉ ļ╣äĒĢ┤ ļé«ņĢśļŗż. ņØ┤ļŖö ļ»Ėļ¦īĒśĢ ņ£äņĢöņŚÉņä£ ņĢöĒÖö Ļ│╝ņĀĢ ĻĘ£ļ¬ģ ļ░Å ņ╣śļŻīņĀ£ Ļ░£ļ░£ņØä ņ£äĒĢ£ driver gene ļ░£ĻĄ┤ņØ┤ ņ¢┤ļĀżņøĆņØä ņŗ£ņé¼ĒĢ£ļŗż.
ņןĒśĢ ņ£äņĢö ļ░£ņāØņŚÉ ņ׳ņ¢┤ņä£ļŖö H. pylori Ļ░ÉņŚ╝Ļ│╝ ĒĢ©Ļ╗ś ņżæņÜöĒĢśĻ▓ī ņ¢ĖĻĖēļÉśļŖö correa cascade ļ░Å ņŚ¼ļ¤¼ ņ£ĀņĀäņĀü ņÜöņØĖ, ĒÖśĻ▓ĮņĀü ņÜöņØĖ ļō▒ņØ┤ Ļ┤ĆņŚ¼ļÉ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[17]. ĒĢśņ¦Ćļ¦ī ņןĒśĢ ņ£äņĢö ļ░£ņāØņŚÉņä£ ņżæņÜöĒĢśĻ▓ī ņ¢ĖĻĖēļÉśļŖö ĒÖśĻ▓Į ņÜöņØĖ ļ░Å ļ¦īņä▒ ņŚ╝ņ”Ø cascadeļŖö ļ»Ėļ¦īĒśĢ ņ£äņĢö ļ░£ņāØņŚÉņä£ļŖö ļŹ£ Ļ┤ĆņŚ¼ĒĢ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż. ņ”ē, ļ»Ėļ¦īĒśĢ ņ£äņĢö ļ░£ņāØņŚÉ ņ׳ņ¢┤ņä£ ņ£ĀņĀäņĀü ņåīņØĖņØ┤ ņżæņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśņ¦Ćļ¦ī ņ£äņĢöņØś ļČäņ×ÉņāØļ¼╝ĒĢÖņĀü ļČäļźśņŚÉņä£ļÅä ņĢī ņłś ņ׳ļō»ņØ┤ ļ»Ėļ¦īĒśĢ ņ£äņĢöĒÖö Ļ│╝ņĀĢņØś ĻĘ╝ļ│ĖņĀüņØĖ ļČäņ×É Ļ▓ĮļĪ£ļŖö ņĢäņ¦ü ņל ĻĘ£ļ¬ģļÉśņ¦Ć ņĢŖņĢśļŗż. ĻĘĖļ¤╝ņŚÉļÅä ņØ┤ņĀä ņ£äņĢöņØś ļČäņ×ÉņĀü ļ│æĒā£ ņāØļ”¼ļź╝ ņÜöņĢĮĒĢ£ ļ│┤Ļ│Āļź╝ ļ░öĒāĢņ£╝ļĪ£ ļ»Ėļ¦īĒśĢ ņ£äņĢö ļ░£ņāØņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö ļČäņ×É ņāØļ¼╝ĒĢÖņĀü ņÜöņåīļōżņØä ņĀĢļ”¼ĒĢ┤ļ│┤ļ®┤ Table 2ņÖĆ Ļ░Öļŗż[17-26]. ņ”ē, ļ»Ėļ¦īĒśĢ ņ£äņĢö ļ░£ņāØņŚÉņä£ Ļ░Ćņן ņżæņÜöĒĢ£ Ēśäņāü ņżæ ĒĢśļéśņØĖ ņäĖĒżĻ░ä ņĀæņ┤ēĻ│╝ Ļ┤ĆļĀ©ļÉ£ E-cadherinĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņ£ĀņĀäņ×É ļ░Å ļČäņ×É Ļ▓ĮļĪ£, H. pyloriņÖĆ Ļ┤ĆļĀ©ļÉ£ ĻĖ░ņĀäļōżņØ┤ļŗż.
ņ£äņĢöņØś ņ¦äļŗ©ņŚÉ ņ׳ņ¢┤ņä£ Ļ░Ćņן ņżæņÜöĒĢ£ Ļ▓āņØĆ ļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ņØ┤ļŗż. ļ»Ėļ¦īĒśĢ ņ£äņĢöņØ┤ ņןĒśĢ ņ£äņĢöņŚÉ ļ╣äĒĢ┤ ņāØļ¼╝ĒĢÖņĀü Ē¢ēĒā£Ļ░Ć Ļ│ĄĻ▓®ņĀüņØ┤Ļ│Ā ņśłĒøäĻ░Ć ļČłļ¤ēĒĢśļŗżĻ│Ā ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ņ¦Ćļ¦ī ņĪ░ĻĖ░ņŚÉ ņ¦äļŗ©ļÉĀ Ļ▓ĮņÜ░ ņśłĒøäļŖö ņ¢æĒśĖĒĢśļŗż. ļ»Ėļ¦īĒśĢ ņ£äņĢö ņżæ sigņØś Ļ▓ĮņÜ░ļŖö ļ¦ÄņØĆ ņŚ░ĻĄ¼ņŚÉņä£ ņĪ░ĻĖ░ ņ¦äļŗ© ņŗ£ ļ”╝ĒöäņĀł ņĀäņØ┤Ļ░Ć ņśżĒ׳ļĀż ļé«Ļ│Ā ņśłĒøäļÅä ņóŗļŗżĻ│Ā ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[27-30]. ļö░ļØ╝ņä£, ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ£ ņĪ░ĻĖ░ ņ¦äļŗ©ņØ┤ ļ¦żņÜ░ ņżæņÜöĒĢśļŗż.
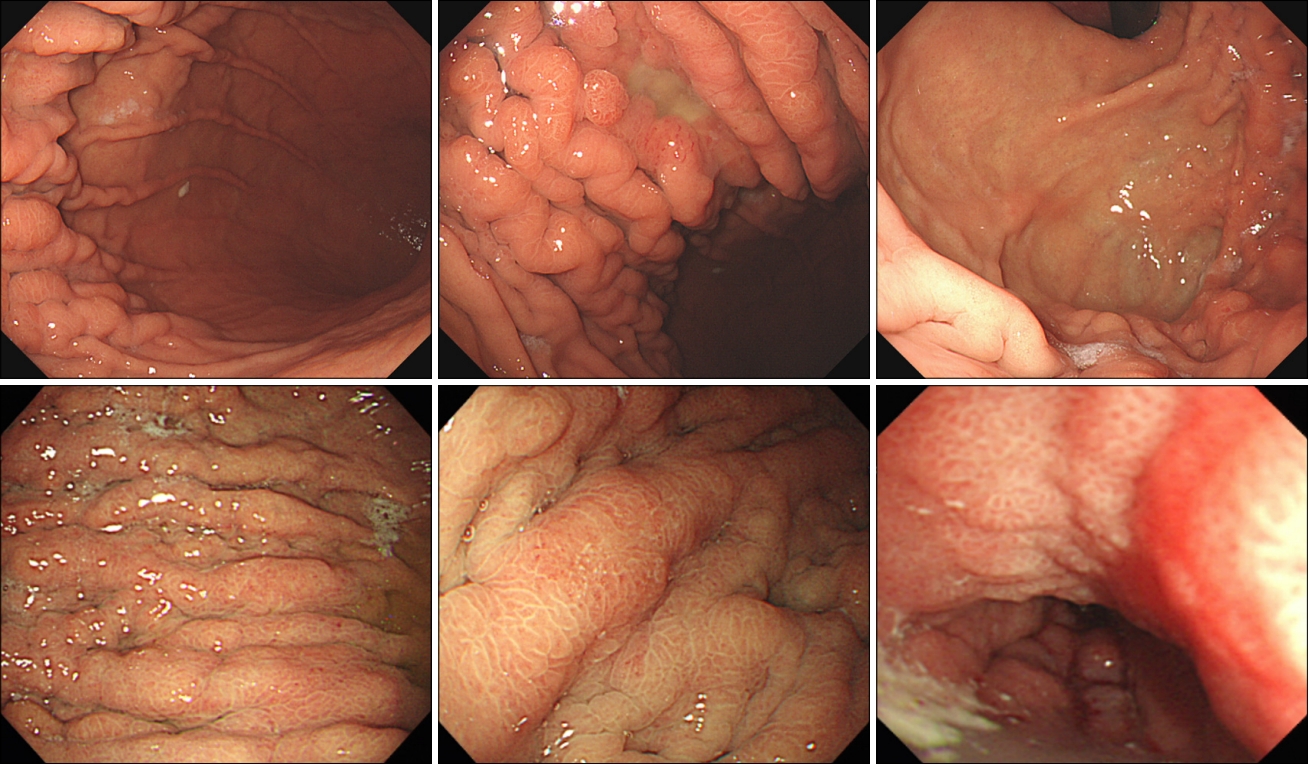
ņĪ░ĻĖ░ņ£äņĢöņØś ļČäĒÖöļÅäņŚÉ ļö░ļźĖ ļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ņØä ļČäņäØĒĢ£ ņŚ░ĻĄ¼ļź╝ ļ│┤ļ®┤ ņ£ĄĻĖ░ĒśĢ(I, IIa)ņØĆ ņןĒśĢ ņ£äņĢöņŚÉņä£ Ļ░Ćņן ļ¦ÄņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, ĒÄĖĒÅēĒśĢ(IIb)ņØĆ ļ»Ėļ¦īĒśĢ ņ£äņĢö ņżæņŚÉņä£ļÅä sigņŚÉņä£ Ļ░Ćņן ĒØöĒĢśĻ▓ī Ļ┤Ćņ░░ļÉśņŚłļŗż[31]. ĒÄĖĒÅēĒśĢņØĆ ņ£ĄĻĖ░ļéś ĒĢ©ļ¬░ņØ┤ ļÅÖļ░śļÉśņ¦Ć ņĢŖņØĆ ņāēņĪ░ ļ│ĆĒÖöņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ļŹö ļ®┤ļ░ĆĒĢ£ Ļ┤Ćņ░░ņØ┤ ņÜöĻĄ¼ļÉ£ļŗż. ļö░ļØ╝ņä£ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ ņŗ£ ļ»Ėļ¦īĒśĢ ņĪ░ĻĖ░ņ£äņĢöņØś ņĪ░ĻĖ░ ņ¦äļŗ©ņØä ņ£äĒĢ┤ ņāēņĪ░ ļ│ĆĒÖöĻ╣īņ¦Ć Ļ╝╝Ļ╝╝Ē׳ ņé┤Ēö╝ļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśĻ▓Āļŗż. Fig. 1ņØĆ ĒÄĖĒÅēĒśĢņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ ļ»Ėļ¦īĒśĢ ņĪ░ĻĖ░ņ£äņĢöņØś ļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ļōżņØ┤ļŗż. ļ│æļ│ĆņØś ņāēņĪ░ ļ│ĆĒÖöļź╝ Ļ╝╝Ļ╝╝Ē׳ Ļ▓ĆĒåĀĒĢśļŖö Ļ▓āņØĆ ļ│æļ│Ć ņ¦äļŗ©ļ┐Éļ¦ī ņĢäļŗłļØ╝ ļ│æļ│ĆņØś Ļ▓ĮĻ│äļź╝ ļ¬ģĒÖĢĒ׳ ĒÅēĻ░ĆĒĢśļŖö Ļ▓āņŚÉļÅä ņżæņÜöĒĢśļŗż.
ļśÉĒĢ£ ļ»Ėļ¦īĒśĢ ņ£äņĢöņØś ļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ņŚÉņä£ ņżæņÜöĒĢ£ Ļ▓āņØĆ ņ¦äĒ¢ēĒśĢ ņ£äņĢö ņżæ ļ│┤ļ¦ī 4ĒśĢņØ┤ļŗż. ļ│┤ļ¦ī 4ĒśĢņØś ļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ņØ┤ ļ»Ėļ¦īĒśĢ ņ£äņĢöņØś ļīĆĒæ£ņĀü ĒŖ╣ņ¦Ģ ņżæ ĒĢśļéśņ×äņØĆ ņל ņĢīļĀżņĀĖ ņ׳ļŗż. ņØ┤ ņåīĻ▓¼ņØ┤ ņżæņÜöĒĢ£ ņØ┤ņ£ĀļŖö ņØ╝ļ░śņĀüņØĖ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņŚÉņä£ ņ£ĪņĢłņĀüņ£╝ļĪ£ ĒŖ╣ņ¦ĢņĀü ļ│æļ│ĆņØ┤ ņŚåņ¢┤ņä£ Ļ░äĻ│╝ļÉśĻĖ░ ņēĮĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ņĀÉļ¦ē ļ│ĆĒÖö ņŚåļŖö ņĢöņäĖĒż ņĀÉļ¦ēĒĢś ņ╣©ņ£żņ£╝ļĪ£ ņĪ░ņ¦ü Ļ▓Ćņé¼ņŚÉņä£ ņ£äņØīņä▒ņØ┤ ļ¦ÄĻĖ░ ļĢīļ¼ĖņŚÉ ņ¦äļŗ©ņĀü ņĖĪļ®┤ņŚÉņä£ ļ¦żņÜ░ ņżæņÜöĒĢ£ ļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ņØ┤ļŗż. ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ ņŗ£ Ļ│ĄĻĖ░ ņŻ╝ņ×ģņŚÉļÅä ņ£äĻ░Ć ņל ņŗĀņĀäļÉśņ¦Ć ņĢŖĻ│Ā ņŻ╝ļ”äņØ┤ ļ╣äĒøä ļÉśņ¢┤ņ׳ļŖö Ļ▓āņØ┤ Ļ░Ćņן ĒŖ╣ņ¦ĢņĀüņØĖ ņåīĻ▓¼ņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ļ»Ėļ×Ćņä▒ ĒĢ©ļ¬░ ļō▒ ņĀÉļ¦ē ļ│ĆĒÖöĻ░Ć ļÅÖļ░śļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ņ׳ļŖöļŹ░, ņĪ░ņ¦ü Ļ▓Ćņé¼ļŖö ņĀÉļ¦ē ļ│ĆĒÖöĻ░Ć ļÅÖļ░śļÉ£ ļČĆņ£äņŚÉņä£ ĒĢśļŖö Ļ▓āņØ┤ ņ¦äļŗ©ņØä ļåÆņØ╝ ņłś ņ׳ļŗż. Fig. 2ļŖö ļ»Ėļ¦īĒśĢ ņ£äņĢöņØś ļ│┤ļ¦ī 4ĒśĢ ļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ļōżņØ┤ļŗż. ļ░śļ│ĄņĀü ņāØĻ▓Ć, ņĀÉļ¦ēļ░Ģļ”¼ņłĀĻ│╝ ĒĢ©Ļ╗ś ņĀłņĀ£ļ®┤ ņāØĻ▓Ć ļō▒ ņĀüĻĘ╣ņĀü Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ£ ņ¦äļŗ©ņØ┤ ņĢłļÉśļŹöļØ╝ļÅä ļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ņØ┤ Ļ░ĢļĀźĒĢśĻ▓ī ņØśņŗ¼ļÉĀ Ļ▓ĮņÜ░ņŚÉļŖö ņłśņłĀņĀü ĒÖĢņ¦ä ļ░Å ņ╣śļŻīļź╝ ļÅÖņŗ£ņŚÉ ņŗ£Ē¢ēĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż.
ļ»Ėļ¦īĒśĢ ņĪ░ĻĖ░ņ£äņĢö ņ╣śļŻīņŚÉ ņ׳ņ¢┤ņä£ ļé┤ņŗ£Ļ▓ĮņĀü ņĀłņĀ£ņłĀņØĆ 2 cm ņØ┤ĒĢśņØś ĻČżņ¢æņØä ļÅÖļ░śĒĢśņ¦Ć ņĢŖļŖö ņĀÉļ¦ēņĢöņØś Ļ▓ĮņÜ░ņŚÉ ņŗ£Ē¢ēļÉĀ ņłś ņ׳ļŗż. ņØ┤ Ļ▓ĮņÜ░ ņ£äņĢöņØś Ēæ£ņżĆ ņ╣śļŻīļŖö ņ£ä ņĀłņĀ£ņłĀņØ┤ļ®░ ļé┤ņŗ£Ļ▓ĮņĀłņĀ£ņłĀņØĆ ņĢäņ¦üĻ╣īņ¦Ć ņŗ£ĒŚśņĀü ņ╣śļŻīņŚÉ ĒĢ┤ļŗ╣ļÉśņ¦Ćļ¦ī[32,33], Ēśäņ×¼ ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŖö ļ»ĖļČäĒÖöĒśĢ ņĪ░ĻĖ░ņ£äņĢöņŚÉņä£ ņłśņłĀĻ│╝ ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀņŚÉ ļīĆĒĢ£ ĻĄŁļé┤ ņĀäĒ¢źņĀü ļŗżĻĖ░Ļ┤Ć ņŚ░ĻĄ¼(ClinicalTrial.gov: NCT04890171, CRIS: KCT0006159) Ļ▓░Ļ│╝ļź╝ ĒåĄĒĢ┤ ņ╣śļŻī ņĀäļץņØ┤ ĒÖĢļ”ĮļÉĀ Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆĒĢ£ ļŗż. ĻĘĖļÅÖņĢł ļ│┤Ļ│ĀļÉ£ ļīĆļČĆļČäņØś ņŚ░ĻĄ¼ļōżņØ┤ ĒøäĒ¢źņĀü ļČäņäØņØ┤Ļ│Ā ņØ╝ļ│ĖņŚÉņä£ ļ│┤Ļ│ĀĒĢ£ ļ»ĖļČäĒÖöĒśĢ ņĪ░ĻĖ░ņ£äņĢöņØś ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀņŚÉ ļīĆĒĢ£ ļŗżĻĖ░Ļ┤Ć ņĀäĒ¢źņĀü Ļ┤Ćņ░░ ņŚ░ĻĄ¼ļÅä ņłśņłĀĻ│╝ņØś ļ╣äĻĄÉĻ░Ć ņĢäļŗī ļŗ©ņØ╝ĻĄ░ ņŚ░ĻĄ¼ļØ╝ļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ĻĖ┤ ĒĢśņ¦Ćļ¦ī, ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ļōżņØä ļ│╝ ļĢī Ēśäņ×¼Ļ╣īņ¦Ć ļ│┤Ļ│ĀļÉ£ ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀ ņĀüņØæņ”Ø ļé┤ņŚÉņä£ ĻĘ╝ņ╣śņĀü ņĀłņĀ£Ļ░Ć ņØ┤ļŻ©ņ¢┤ņ¦ä Ļ▓ĮņÜ░ ņśłĒøäļŖö ņ¢æĒśĖĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[8,9,34-38]. ĒĢśņ¦Ćļ¦ī, ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀ ĻĖ░ņżĆņØś ļČäĒÖöĒśĢ ņĪ░ĻĖ░ņ£äņĢöņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ņןĒśĢ ņĪ░ĻĖ░ņ£äņĢöĻ│╝ ļ╣äĻĄÉĒĢĀļĢī ĻĘ╝ņ╣ś ņĀłņĀ£ņ£©ņØ┤ ņāüļīĆņĀüņ£╝ļĪ£ ļé«ņØĆ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ļŗż[9]. ļö░ļØ╝ņä£ ļ»ĖļČäĒÖöĒśĢ ņĪ░ĻĖ░ņ£äņĢöņŚÉņä£ ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ļź╝ ņŗ£Ē¢ēĒĢĀ ļĢī ĻĘ╝ņ╣śņĀłņĀ£Ļ░Ć ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖö ņĀäļץņØ┤ ņżæņÜöĒĢĀ ņłś ņ׳ļŗż[5,39].
ļ»ĖļČäĒÖöĒśĢ ņĪ░ĻĖ░ņ£äņĢöņŚÉņä£ ĻĘ╝ņ╣śņĀü ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀņØ┤ ļÉśĻĖ░ ņ£äĒĢ┤ņä£ļŖö Ļ░ü ņäĖĒż ĒśĢĒā£ņŚÉ ļö░ļźĖ ņāØļ¼╝ĒĢÖņĀü Ē¢ēĒā£ļź╝ Ļ│ĀļĀżĒĢ£ ņĀæĻĘ╝ņØ┤ ĒĢäņÜöĒĢĀ ņłś ņ׳ļŗż. ņ£äņŚÉ ņ¢ĖĻĖēĒĢ£ļīĆļĪ£ sigņÖĆ porņØĆ ņä▒ņן Ēī©Ēä┤ņØ┤ ļŗżļź┤ĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ļź╝ Ļ│ĀļĀżĒĢ£ ņ░©ļ│äĒÖöļÉ£ ņĀæĻĘ╝ņØ┤ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ļŗż (Fig. 3). PorņØĆ ņłśņ¦üĒśĢ ņä▒ņן Ēī©Ēä┤ņ£╝ļĪ£ ņĀÉļ¦ēĒĢś ņ╣©ļ▓ö ņŚ¼ļČĆņŚÉ ļīĆĒĢ£ ņŗĀņżæĒĢ£ ĒīÉļŗ©ņØ┤, sigņØś Ļ▓ĮņÜ░ļŖö ņłśĒÅēņĀü ņä▒ņן Ēī©Ēä┤ņ£╝ļĪ£ ļ│æļ│Ć Ļ▓ĮĻ│äņŚÉ ļīĆĒĢ£ ņŗĀņżæĒĢ£ ĒīÉļŗ©ņØ┤ ĒĢäņÜöĒĢśļŗż. ļ»ĖļČäĒÖöĒśĢ ņĪ░ĻĖ░ņ£äņĢöņŚÉņä£ ņóģņ¢æ Ļ▓ĮĻ│äņØś ņĀĢĒÖĢĒĢ£ ņśłņĖĪņØä ņ£äĒĢ┤ ņāēņåī ļé┤ņŗ£Ļ▓Į ļ░Å ĒśæļīĆņŚŁ ĒÖĢļīĆļé┤ņŗ£Ļ▓Į(narrow-band imaging with magnifying endoscopy, NBI-ME) ņé¼ņÜ®ņØĆ ļČäĒÖöĒśĢ ņĪ░ĻĖ░ņ£äņĢöļ│┤ļŗż ļÅäņøĆņØ┤ ļÉśņ¦Ć ņĢŖļŗżĻ│Ā ņĢīļĀżņĀĖ ņÖöļŗż[40-42]. sigļŖö ņóģņóģ Ēæ£ņ×¼ņä▒ ņĀÉļ¦ē ļ│ĆĒÖö ņŚåņØ┤ ņāüĒö╝ĒĢś ĒÖĢņé░ Ēī©Ēä┤ņØä ļ│┤ņØ┤ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ĻĘĖļ¤¼ļéś ņØ┤Ēøä NBI-MEĻ░Ć ļ│æļ│Ć Ļ▓ĮĻ│ä ĒīÉļŗ©ņŚÉ ļÅäņøĆņØ┤ ļÉ©ņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŖöļŹ░, ņØ┤ļōż ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĢöņäĖĒż ņ╣©ņ£żņŚÉ ļö░ļźĖ ņĀÉļ¦ēņĖĄņØś ļ│ĆĒÖöļź╝ ļ░öĒāĢņ£╝ļĪ£ NBI-MEņØś ņåīĻ▓¼ņØä extended intervening component pattern(ņĢöņäĖĒżĻ░Ć ņ”ØņŗØ ņśüņŚŁņŚÉ ĻĄŁĒĢ£); wavy microvessel pattern(ņĢöņäĖĒżĻ░Ć Ēæ£ļ®┤ņĖĄņŚÉņä£ ņ”ØņŗØ ņśüņŚŁņ£╝ļĪ£ ĒÖĢņן), corkscrew pattern(ņĢöņäĖĒżĻ░Ć ņĀäņ▓┤ ņĀÉļ¦ēņ£╝ļĪ£ ĒÖĢņן)ņØś 3Ļ░Ćņ¦Ć Ēī©Ēä┤ņ£╝ļĪ£ ļČäļźśĒĢśņśĆļŗż[43-45]. Corkscrew patternņØĆ ļ»ĖļČäĒÖöĒśĢ ņĪ░ĻĖ░ņ£äņĢöņØś NBI-MEņØś ņל ņĢīļĀżņ¦ä ĒśĢĒā£ņØ┤ļéś, ņØ┤ļŖö ņóģņ¢æ ņäĖĒżĻ░Ć ņĀÉļ¦ē ņĀäņ▓┤ļź╝ ņ░©ņ¦ĆĒĢĀ ļĢī Ļ┤Ćņ░░ļÉĀ ņłś ņ׳ļŗż. ņ”ē, ĻĘĖļÅÖņĢł ļŗżļźĖ ļæÉ Ļ░Ćņ¦Ć Ēī©Ēä┤ņØä NBI-MEĻ░Ć ļåōņ│żņØä ņłś ņ׳ņ£╝ļ®░, ņØ┤Ļ▓āņØ┤ ņ¦ĆĻĖłĻ╣īņ¦Ć NBI-MEņØś ņŚŁĒĢĀņØ┤ ļ»ĖļČäĒÖöĒśĢ ņĪ░ĻĖ░ņ£äņĢöņŚÉņä£ ņĀ£ĒĢ£ņĀüņØ┤ņŚłļŹś ņØ┤ņ£ĀņØ┤ļŗż. NBI-MEļŖö sigņŚÉņä£ ņóģņ¢æ ņäĖĒżĻ░Ć ņ░©ņ¦ĆĒĢśļŖö ņ£äņ╣śņŚÉ ļö░ļØ╝ ņØ┤ļ¤¼ĒĢ£ ņäĖ Ļ░Ćņ¦Ć ņ£ĀĒśĢņØä ĻĖ░ļ░śņ£╝ļĪ£ ņóģņ¢æ Ļ▓ĮĻ│äļź╝ ņĀĢĒÖĢĒĢśĻ▓ī ņśłņĖĪĒĢśļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ļŗż. ņĢäņ¦üĻ╣īņ¦Ć ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀņŚÉ ņ׳ņ¢┤ņä£ safety marginņŚÉ ļīĆĒĢ£ ņĀĢņØśĻ░Ć ņŚåļŖöļŹ░, ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ļé┤ņŗ£Ļ▓Į ņÖäņĀä ņĀłņĀ£ ņØ┤Ēøä ņĀłņĀ£ ļ│ĆņŚ░ņŚÉ ņ×öņŚ¼ ņĢöņäĖĒżĻ░Ć ļé©ņĢäņ׳ļŖö Ļ▓ĮņÜ░ļź╝ ļČäņäØĒĢśņśĆņØä ļĢī sig, porņØś ļ»ĖļČäĒÖöĒśĢ ņĪ░ĻĖ░ņ£äņĢöņØś Ļ▓ĮņÜ░Ļ░Ć ņ£äĒŚśņØĖņ×É ņżæ ĒĢśļéśņśĆĻ│Ā, 3 mm ļ»Ėļ¦īņØś safety marginņØ┤ ņ£äĒŚśņØĖņ×É ņżæ ĒĢśļéśņśĆļŗż[46]. ļö░ļØ╝ņä£ ļ»ĖļČäĒÖöĒśĢ ņĪ░ĻĖ░ņ£äņĢöņØś Ļ▓ĮņÜ░ ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ ņØ┤Ēøä ņĀłņĀ£ļ®┤ņŚÉ ņĢöņäĖĒżĻ░Ć ņŚåļŹöļØ╝ļÅä 3 mm ļ»Ėļ¦īņØś safety marginņØĖ Ļ▓ĮņÜ░ņŚÉļŖö ņĀłņĀ£ļ®┤ņŚÉ ņ×öņŚ¼ ņĢöņäĖĒż Ļ░ĆļŖźņä▒ņØä Ļ│ĀļĀżĒĢśņŚ¼ ļ®┤ļ░ĆĒĢ£ ņČöņĀü Ļ┤Ćņ░░ņØ┤ ĒĢäņÜöĒĢĀ ņłś ņ׳ļŗż[46]. ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ ņØ┤Ēøä Ēśäņ×¼ņØś ņÖäņĀä ņĀłņĀ£ ĻĖ░ņżĆņØä ļ▓Śņ¢┤ļéśļ®┤ ņØ╝ļ│ĖņØś Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉņä£ļŖö eCURA ņŗ£ņŖżĒģ£ņŚÉ ņżĆĒĢśņŚ¼ ņČöĻ░Ć ņłśņłĀņØä ĻČīĒĢśĻ│Ā ņ׳ļŗż[32]. ĒĢśņ¦Ćļ¦ī ĻĄŁļé┤ ņŚ░ĻĄ¼ņŚÉ ņØśĒĢśļ®┤ ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀ ņØ┤Ēøä ņłśĒÅēņĀłņĀ£ņŚ░ ņ╣©ļ▓öļ¦ī ņ¢æņä▒ņØĖ ļČłņÖäņĀä ņĀłņĀ£ņØś Ļ▓ĮņÜ░ļŖö ņłśņłĀņĀü ņĀłņĀ£ Ēøä ļ”╝ĒöäņĀł ņĀäņØ┤Ļ░Ć Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśĻ│Ā[47], ļé┤ņŗ£Ļ▓ĮņĀü ņČöĻ░Ć ņ╣śļŻīļ¦īņ£╝ļĪ£ļÅä ņāØņĪ┤ņ£©ņØ┤ ņÜ░ņłśĒĢ©ņØä ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ņ¢┤ņä£ ņČöĻ░Ć ņ╣śļŻī ņĀäļץņŚÉ ļīĆĒĢ┤ņä£ļŖö Ē¢źĒøä ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż[48].
ņØ╝ļ░śņĀüņ£╝ļĪ£ Ēś╝ĒĢ®ĒśĢ(mixed-type) ņĪ░ĻĖ░ņ£äņĢöņØś ņśłĒøäĻ░Ć ļČłļ¤ēĒĢśļ®░ ņØ┤ ņżæ ļ»ĖļČäĒÖöĒśĢ ņÜ░ņäĖ Ēś╝ĒĢ®ĒśĢņØś Ļ▓ĮņÜ░ ļŹö ļČłļ¤ēĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│Ā ļÉśļéś ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ ņĀüņÜ® ļō▒ ņ░©ļ│äņĀü ņ╣śļŻīņĀäļץņØ┤ ĒĢäņÜöĒĢ£ņ¦ĆņŚÉ ļīĆĒĢ┤ ņä£ļŖö ņČöĒøä ņŚ░ĻĄ¼Ļ░Ć ļŹö ĒĢäņÜöĒĢśļŗż[39].
ņ¦äĒ¢ēņä▒ ļ»Ėļ¦īĒśĢ ņ£äņĢöņŚÉņä£ ņłśņłĀņĀü ņ╣śļŻī ļ░Å ņĀäņŗĀĒĢŁņĢöņÜöļ▓ĢņØĆ ņĢäņ¦üĻ╣īņ¦Ć ļ»Ėļ¦īĒśĢ ņ£äņĢöņŚÉņä£ņØś ņ░©ļ│äņĀü ņĀäļץņØ┤ ņĀ£ņŗ£ļÉśĻ│Ā ņ׳ņ¦ĆļŖö ņĢŖļŗż[33]. ņĀäņŗĀĒĢŁņĢöņÜöļ▓ĢņØś Ļ▓ĮņÜ░ HER2 ļ░£ĒśäņŚÉ ļö░ļźĖ ņ╣śļŻī ņäĀĒāØņØ┤ 1ņ░© ņĀäļץņØĖļŹ░[33], ļ»Ėļ¦īĒśĢ ņ£äņĢöņØś Ļ▓ĮņÜ░ ņןĒśĢ ņ£äņĢöņŚÉ ļ╣äĒĢ┤ HER2 ļ░£Ēśäņ£©ņØ┤ ļé«ĻĖ░ ļĢīļ¼ĖņŚÉ ļ»Ėļ¦īĒśĢ ņ£äņĢö ņ╣śļŻīļź╝ ņ£äĒĢ£ ņ╣śļŻī Ēæ£ņĀü ļ░£ĻĄ┤ ļ░Å Ļ░£ļ░£ņØ┤ ĒĢäņÜöĒĢśļŗż.
ļ»Ėļ¦īĒśĢ ņ£äņĢöņØĆ ņןĒśĢ ņ£äņĢöĻ│╝ļŖö ļŗżļźĖ ņĢöĒÖö Ļ│╝ņĀĢ ļ░Å ņāØļ¼╝ĒĢÖņĀü Ē¢ēĒā£ļź╝ ļ│┤ņØĖļŗż. ņ¦äļŗ© ļ░Å ņ╣śļŻīņŚÉ ņ׳ņ¢┤ņä£ ņØ┤ļź╝ Ļ│ĀļĀżĒĢ£ ņĀæĻĘ╝ņØ┤ ņżæņÜöĒĢĀ ņłś ņ׳ņ£╝ļéś ņĢäņ¦üĻ╣īņ¦Ć ļ│æĒā£ņāØļ”¼ņŚÉ ņ׳ņ¢┤ņä£ ņל ĻĘ£ļ¬ģļÉśņ¦Ć ņĢŖņĢśļŗż. ļ»Ėļ¦īĒśĢ ņ£äņĢöņŚÉ ļīĆĒĢ£ ļ│æĒā£ ņāØļ”¼ ĻĘ£ļ¬ģ ļ░Å ņØ┤ļź╝ ĒåĄĒĢ£ ņ╣śļŻīņĀ£ ļ░£ĻĄ┤ ļō▒ņØ┤ ĒĢäņÜöĒĢśĻ▓Āļŗż.
Acknowledgements
This work was supported by the Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education, Science and Technology (2021R1A2C2011296).
Fig.┬Ā1.
Flat-type endoscopic appearance of diffuse-type early gastric cancer. Arrows indicates the lesion.
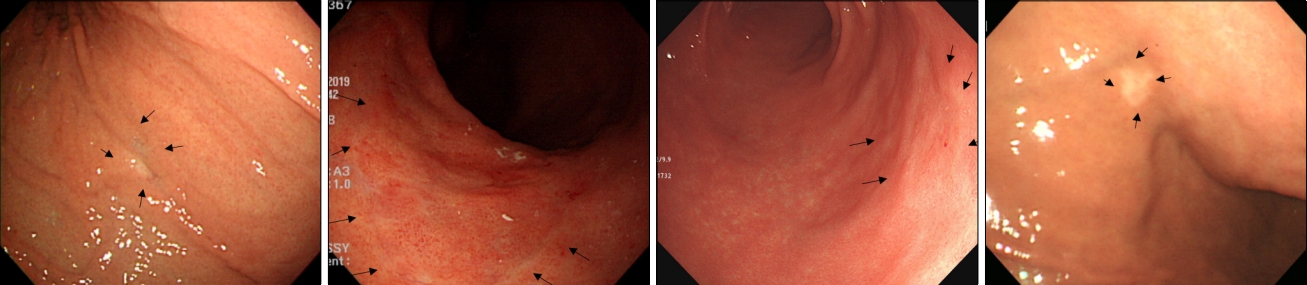
Fig.┬Ā3.
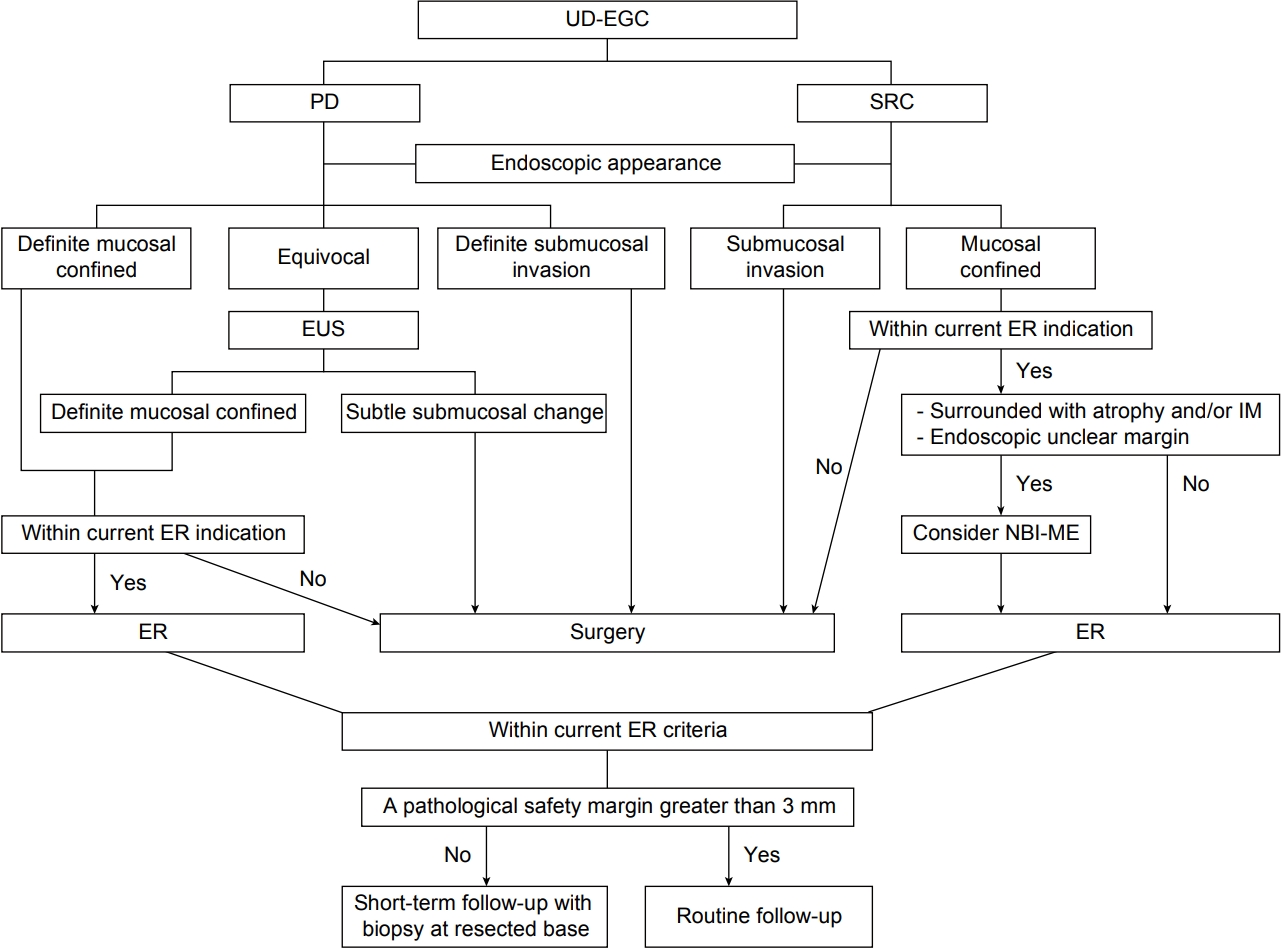
Suggested algorithm for endoscopic resection (ER) of undifferentiated-type early gastric cancer (UD-EGC). Modified from Kim [39]. PD, poorly differentiated adenocarcinoma; SRC, signet ring cell carcinoma; EUS, endoscopic ultrasonography; IM, intestinal metaplasia; NBI-ME, narrow-band imaging with magnifying endoscopy
Table┬Ā1.
Pathologic Classification Of Diffuse-type Gastric Cancer
Table┬Ā2.
Contributing Factors for Pathogenicity of Diffuse-type Gastric Cancer
REFERENCES
1. Kakiuchi M, Nishizawa T, Ueda H, et al. Recurrent gain-of-function mutations of RHOA in diffuse-type gastric carcinoma. Nat Genet 2014;46:583ŌĆō587.



2. Correa P. Human gastric carcinogenesis: a multistep and multifactorial process--first American cancer society award lecture on cancer epidemiology and prevention. Cancer Res 1992;52:6735ŌĆō6740.

3. Nardone G, Rocco A, Malfertheiner P. Review article: Helicobacter pylori and molecular events in precancerous gastric lesions. Aliment Pharmacol Ther 2004;20:261ŌĆō270.


4. Watanabe M, Kato J, Inoue I, et al. Development of gastric cancer in nonatrophic stomach with highly active inflammation identified by serum levels of pepsinogen and Helicobacter pylori antibody together with endoscopic rugal hyperplastic gastritis. Int J Cancer 2012;131:2632ŌĆō2642.


5. Kim JH. Important considerations when contemplating endoscopic resection of undifferentiated-type early gastric cancer. World J Gastroenterol 2016;22:1172ŌĆō1178.



6. Lee JY, Gong EJ, Chung EJ, et al. The characteristics and prognosis of diffuse-type early gastric cancer diagnosed during health check-ups. Gut Liver 2017;11:807ŌĆō812.




7. Perrot-Applanat M, Vacher S, Pimpie C, et al. Differential gene expression in growth factors, epithelial mesenchymal transition and chemotaxis in the diffuse type compared with the intestinal type of gastric cancer. Oncol Lett 2019;18:674ŌĆō686.



8. Kim JH, Kim YH, Jung DH, et al. Follow-up outcomes of endoscopic resection for early gastric cancer with undifferentiated histology. Surg Endosc 2014;28:2627ŌĆō2633.



9. Bang CS, Baik GH, Shin IS, et al. Endoscopic submucosal dissection for early gastric cancer with undifferentiated-type histology: a meta-analysis. World J Gastroenterol 2015;21:6032ŌĆō6043.



10. Kim YH, Kim JH, Kim H, et al. Is the recent WHO histological classification for gastric cancer helpful for application to endoscopic resection? Gastric Cancer 2016;19:869ŌĆō875.



11. Bang CS, Park JM, Baik GH, et al. Therapeutic outcomes of endoscopic resection of early gastric cancer with undifferentiated-type histology: a Korean ESD registry database analysis. Clin Endosc 2017;50:569ŌĆō577.




12. Kim H, Kim JH, Lee YC, et al. Growth patterns of signet ring cell carcinoma of the stomach for endoscopic resection. Gut Liver 2015;9:720ŌĆō726.



13. Shin SY, Kim JH, Chun J, Yoon YH, Park H. Chronic atrophic gastritis and intestinal metaplasia surrounding diffuse-type gastric cancer: are they just bystanders in the process of carcinogenesis? PLoS One 2019;14:e0226427.



14. Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature 2014;513:202ŌĆō209.




15. Sohn BH, Hwang JE, Jang HJ, et al. Clinical significance of four molecular subtypes of gastric cancer identified by the cancer genome atlas project. Clin Cancer Res 2017;23:4441ŌĆō4449.



16. Cristescu R, Lee J, Nebozhyn M, et al. Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes. Nat Med 2015;21:449ŌĆō456.



17. Ansari S, Gantuya B, Tuan VP, Yamaoka Y. Diffuse gastric cancer: a summary of analogous contributing factors for its molecular pathogenicity. Int J Mol Sci 2018;19:2424.



18. Tan P, Yeoh KG. Genetics and molecular pathogenesis of gastric adenocarcinoma. Gastroenterology 2015;149:1153ŌĆō1162.e3.


19. Cho SY, Park JW, Liu Y, et al. Sporadic early-onset diffuse gastric cancers have high frequency of somatic CDH1 alterations, but low frequency of somatic RHOA mutations compared with late-onset cancers. Gastroenterology 2017;153:536ŌĆō549.e26.


20. Carvalho S, Catarino TA, Dias AM, et al. Preventing E-cadherin aberrant N-glycosylation at Asn-554 improves its critical function in gastric cancer. Oncogene 2016;35:1619ŌĆō1631.



21. Pinho SS, Seruca R, G├żrtner F, et al. Modulation of E-cadherin function and dysfunction by N-glycosylation. Cell Mol Life Sci 2011;68:1011ŌĆō1020.



22. Nagahashi M, Ramachandran S, Kim EY, et al. Sphingosine-1-phosphate produced by sphingosine kinase 1 promotes breast cancer progression by stimulating angiogenesis and lymphangiogenesis. Cancer Res 2012;72:726ŌĆō735.



23. Ghatak S, Chakraborty P, Sarkar SR, Chowdhury B, Bhaumik A, Kumar NS. Novel APC gene mutations associated with protein alteration in diffuse type gastric cancer. BMC Med Genet 2017;18:61.




24. Turner N, Grose R. Fibroblast growth factor signalling: from development to cancer. Nat Rev Cancer 2010;10:116ŌĆō129.



25. Oliveira MJ, Costa AM, Costa AC, et al. CagA associates with c-Met, E-cadherin, and p120-catenin in a multiproteic complex that suppresses Helicobacter pylori-induced cell-invasive phenotype. J Infect Dis 2009;200:745ŌĆō755.



26. Yamamoto E, Suzuki H, Takamaru H, Yamamoto H, Toyota M, Shinomura Y. Role of DNA methylation in the development of diffuse-type gastric cancer. Digestion 2011;83:241ŌĆō249.


27. Huh CW, Jung DH, Kim JH, et al. Signet ring cell mixed histology may show more aggressive behavior than other histologies in early gastric cancer. J Surg Oncol 2013;107:124ŌĆō129.


28. Chiu CT, Kuo CJ, Yeh TS, et al. Early signet ring cell gastric cancer. Dig Dis Sci 2011;56:1749ŌĆō1756.



29. Zhang M, Zhu G, Zhang H, Gao H, Xue Y. Clinicopathologic features of gastric carcinoma with signet ring cell histology. J Gastrointest Surg 2010;14:601ŌĆō606.



30. Hyung WJ, Noh SH, Lee JH, et al. Early gastric carcinoma with signet ring cell histology. Cancer 2002;94:78ŌĆō83.


31. Jung DH, Park YM, Kim JH, et al. Clinical implication of endoscopic gross appearance in early gastric cancer: revisited. Surg Endosc 2013;27:3690ŌĆō3695.



32. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer 2021;24:1ŌĆō21.



33. Guideline Committee of the Korean Gastric Cancer Association (KGCA).; Development Working Group & Review Panel. Korean practice guideline for gastric cancer 2018: an evidence-based, multi-disciplinary approach. J Gastric Cancer 2019;19:1ŌĆō48.




34. Takizawa K, Ono H, Hasuike N, et al. A nonrandomized, single-arm confirmatory trial of expanded endoscopic submucosal dissection indication for undifferentiated early gastric cancer: Japan clinical oncology group study (JCOG1009/1010). Gastric Cancer 2021;24:479ŌĆō491.



35. Ahn JY, Park HJ, Park YS, et al. Endoscopic resection for undifferentiated-type early gastric cancer: immediate endoscopic outcomes and long-term survivals. Dig Dis Sci 2016;61:1158ŌĆō1164.



36. Park JC, Lee YK, Kim SY, et al. Long-term outcomes of endoscopic submucosal dissection in comparison to surgery in undifferentiated-type intramucosal gastric cancer using propensity score analysis. Surg Endosc 2018;32:2046ŌĆō2057.



37. Lee S, Choi KD, Han M, et al. Long-term outcomes of endoscopic submucosal dissection versus surgery in early gastric cancer meeting expanded indication including undifferentiated-type tumors: a criteria-based analysis. Gastric Cancer 2018;21:490ŌĆō499.



38. Lim JH, Kim J, Kim SG, Chung H. Long-term clinical outcomes of endoscopic vs. surgical resection for early gastric cancer with undifferentiated histology. Surg Endosc 2019;33:3589ŌĆō3599.



39. Kim JH. Strategy for curative endoscopic resection of undifferentiated-type early gastric cancer. Clin Endosc 2019;52:9ŌĆō14.




40. Lee BE, Kim GH, Park DY, et al. Acetic acid-indigo carmine chromoendoscopy for delineating early gastric cancers: its usefulness according to histological type. BMC Gastroenterol 2010;10:97.




41. Nagahama T, Yao K, Maki S, et al. Usefulness of magnifying endoscopy with narrow-band imaging for determining the horizontal extent of early gastric cancer when there is an unclear margin by chromoendoscopy (with video). Gastrointest Endosc 2011;74:1259ŌĆō1267.


42. Yao K, Nagahama T, Matsui T, Iwashita A. Detection and characterization of early gastric cancer for curative endoscopic submucosal dissection. Dig Endosc 2013;25(Suppl 1): 44ŌĆō54.


43. Okada K, Fujisaki J, Kasuga A, et al. Diagnosis of undifferentiated type early gastric cancers by magnification endoscopy with narrow-band imaging. J Gastroenterol Hepatol 2011;26:1262ŌĆō1269.


44. Horiuchi Y, Fujisaki J, Yamamoto N, et al. Accuracy of diagnostic demarcation of undifferentiated-type early gastric cancers for magnifying endoscopy with narrow-band imaging: endoscopic submucosal dissection cases. Gastric Cancer 2016;19:515ŌĆō523.



45. Horiuchi Y, Fujisaki J, Yamamoto N, et al. Accuracy of diagnostic demarcation of undifferentiated-type early gastric cancer for magnifying endoscopy with narrow-band imaging: surgical cases. Surg Endosc 2017;31:1906ŌĆō1913.



46. Yun GW, Kim JH, Lee YC, et al. What are the risk factors for residual tumor cells after endoscopic complete resection in gastric epithelial neoplasia? Surg Endosc 2015;29:487ŌĆō492.



-
METRICS

-
- 0 Crossref
- 4,487 View
- 142 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Histopathology of Gastric Cancer2023 June;23(2)
Subepithelial Tumor-like Gastric Cancer2021 June;21(2)
Helicobacter pylori-negative Gastric Cancer2021 March;21(1)
Kyoto Classification of Gastritis and Gastric Cancer2019 June;19(2)