|
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 23(1); 2023 > Article |
|
Abstract
Gastric subepithelial lesions (SELs) are often detected incidentally during upper gastrointestinal endoscopy. Although most SELs are benign, endoscopic differentiation between malignant and benign lesions is important. Endoscopy is useful to determine the location, color, consistency, mobility, surface characteristics, and approximate size of gastric SELs. EUS can distinguish between intraluminal lesions and extraluminal compression and confirm the exact size, layer of origin, echogenicity, and homogeneity of SELs. Accurate understanding of the endoscopic and EUS features of gastric SELs is useful to effectively design an appropriate management plan and thereby minimize the rate of unnecessary surveillance or overtreatment.
상부위장관 내시경 검사에서 정상 점막으로 덮여 있는 내강으로 돌출된 융기 병변이 우연히 발견되는 경우가 많다. 이전에는 점막하 종양(submucosal tumor)으로 불렸지만, 이러한 소견은 점막하층뿐만 아니라, 근육층 또는 외부 장기에 의한 압박으로도 관찰될 수 있는 병변으로 최근에는 상피하 병변(subepithelial lesion)이라고 지칭하고 있다. 국내에서 8만여 명의 건강검진 내시경 환자들을 대상으로 조사하였을 때 위 상피하 병변의 유병률은 0.74~1.99%, 평균 크기는 8.7~13.2 mm, 내시경 초음파(EUS)를 시행한 빈도는 27.4%로 보고되었다[1,2]. 대부분 크기가 작고 증상이 없어 건강검진 내시경에서 우연히 발견되는 경우가 많고, 정상 점막 아래에 존재하기 때문에 조직 검사를 하더라도 진단 정확도가 낮다. 특히 크기가 작은 경우 자연 경과 역시 명확하게 알려져 있지 않기 때문에 추가적인 검사 또는 치료의 필요성이나 추적 관찰에 대한 정확한 지침이 없는 실정이다. 본고에서는 크기가 작은 2 cm 미만의 위 상피하 병변에 대한 접근으로 진단법과 추적 관찰에 대하여 기술하고자 한다.
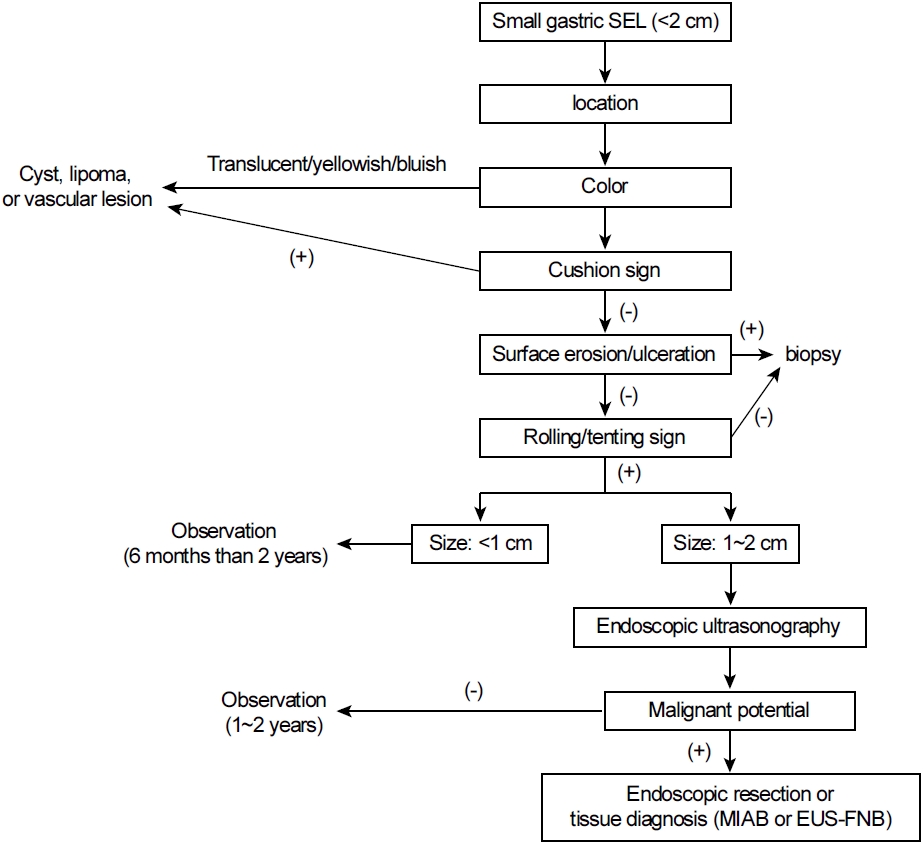
위 상피하 병변은 백색광 내시경, 내시경 초음파, 조직학적 검사 등을 통하여 진단할 수 있으며, 이를 바탕으로 추적 관찰할 수 있다.
위 상피하 병변을 발견하였을 때, 병변의 위치, 색조, 표면 변화, 경도, 이동성, 크기를 확인하여 병변을 면밀하게 관찰하는 것은 향후 추적 관찰이나 치료 계획을 결정하는 데 중요하다. 외부 압박에 의한 병변의 경우에는 공기를 흡인하거나 송기하면서 병변의 위치나 크기가 변화하는 양상을 확인하는 것이 감별진단에 도움이 된다.
상피하 병변은 종류에 따라 호발 부위가 다르다. 위장관간질종양(gastrointestinal stromal tumor, GIST)은 위저부와 체부, 평활근종(leiomyoma)은 위저부와 분문부, 신경초종(schwannoma)은 체부에 호발하며, 신경내분비종양(neuroendocrine tumor)도 체부와 위저부에서 주로 관찰된다. 전정부에는 이소성 췌장(ectopic panacreas), 지방종(lipoma), 염증성 섬유양 용종(inflammatory fibrinoid polyp), 사구종양(glomus tumor)이 흔하게 관찰된다. 외부 압박의 경우 주변 장기의 위치에 따라 추정할 수 있으며, 간에 의한 압박은 상체부 전벽과 소만으로, 비장 압박은 위저부 대만, 췌장 압박은 체부 후벽과 대만에서 관찰된다.
대부분의 상피하 병변은 주변 정상 점막과 유사한 색조를 보인다. 특히 고유근층에서 기원하는 종양은 정상 점막의 색조를 띄는데, 사구종양과 같은 과혈관성 종괴는 다소 푸른빛을 보이기도 한다. 점막근층이나 점막하층과 같이 위벽의 표층에 위치한 병변들은 특징적인 색조를 보여 감별진단에 도움이 된다. 지방종은 황색조를 띄며, 단순낭종(cyst), 림프관종(lymphangioma), 심재성 낭종성 위염(gastritis cystica profunda)과 같은 낭성 병변들은 투명하게 보인다. 혈관종(hemangioma)이나 정맥류(varix)와 같은 혈관성 병변은 푸른색으로 관찰된다.
상피하 병변은 대부분 매끈한 정상 점막으로 덮여 있다. 하지만 일부에서는 개구부(opening), 함몰(dimpling), 미란(erosion), 궤양(ulcer)과 같은 표면 변화가 동반되기도 한다. 이소성 췌장은 표면에 개구부, 함몰이 동반된 경우가 많으며, 심재성 낭종성 위염에서도 크기가 작은 개구부를 확인할 수 있다. 표면에 미란이나 궤양이 있을 경우 악성 가능성을 고려해야 한다. 특히 표면 구조와 미세 혈관의 형태 변화가 동반되었다면 신경내분비종양, 상피하종양 형태의 위암(subepithelial tumor-like carcinoma), 림프종(lymphoma), 전이암(metastatic cancer), 위장관간질종양의 감별을 위한 내시경 조직 검사가 필요하다.
생검 겸자를 이용하여 상피하 병변을 눌러서 단단한 정도를 평가할 수 있다. 병변의 중심부를 눌렀을 때 부드럽게 들어가며 모양이 변하는 경우(cushion sign 또는 pillow sign)에는 액체나 지방과 같은 부드러운 물질로 이루어져 있다고 판단할 수 있으며, 지방종, 단순낭종, 심재성 낭종성 위염, 림프관종과 같은 양성 병변을 시사한다. 하지만 병변이 푸른색을 띄면서 정맥류나 혈관종이 의심된다면 출혈 위험성을 고려하여 겸자로 누르는 것은 피해야 한다.
생검 겸자를 이용하여 병변의 변연부를 밀어서 움직이는 소견(rolling sign)을 확인하여 이동성 평가가 가능하다. 부드럽게 밀린다면 병변이 점막근층이나 그 아래에서 기원하는 상피하종양임을 의미하지만 종양이 고유근층에 넓게 부착된 경우에는 음성 소견을 보인다. 또한 병변이 상피에 가까운 점막고유층에서 기원하여 상피하 병변의 형태를 띄는 신경내분비종양, 상피하종양 형태의 위암, 림프종, 염증성 섬유양 용종에서는 이러한 소견이 관찰되지 않는다. 생검 겸자로 상피 부분을 잡아 올렸을 때, 상피와 종양이 분리되는 소견(tenting sign)도 병변이 점막근층이나 그 아래에 있음을 의미한다. 하지만 병변이 궤양 또는 섬유화를 동반하거나 점막고유층까지 침범한 경우에는 이러한 소견이 관찰되지 않는다.
내시경 초음파 검사는 벽외 압박과 벽내 병변을 구분할 수 있으며, 벽내 상피하 병변의 기원층(originating layer), 에코의 균질성(homogeneity), 에코의 반향 정도(echogenicity), 크기, 모양, 경계 등을 확인하여 상피하 병변을 진단하는 최적의 도구이다. 내시경 초음파의 진단 정확도는 비교적 특징적인 소견을 보이는 지방종이나 정맥류에서 43~67%, 신경내분비 종양에서 50~100%, 이소성 췌장에서 57~61% 가량으로 알려져 있다[3-5]. 고유근층에 위치하는 저에코성 병변은 내시경 초음파를 이용한 감별진단이 어렵다. 고유근층의 대표적인 저에코 종양에는 평활근종, 신경초종, 위장관간질종양이 있는데 이 중 악성인 위장관간질종양을 감별하는 것이 중요하다. 평활근종은 고유근층과 같은 에코 반향 정도를 가지고 자연스럽게 연결되며, 에코는 균질하고 일부는 내부에 석회화(calcification)를 동반한다. 또한 타원형이거나 길쭉한 소엽 모양(lobulated contour)이라면 평활근종의 가능성이 매우 높다. 신경초종은 고유근층보다는 다소 저에코를 보이며, 변연부에 가느다란 저에코 테두리가 강조되는 소견(marginal halo)이 보인다. 위장관간질종양은 고유근층보다 고에코로 관찰되고 내부의 에코가 불균질하며, 악성도가 높아질수록 병변 내부에 무에코 영역(anechoic area)이나 고에코 점(hyperechoic foci)이 관찰될 수 있다(Table 1) [6]. 이렇듯 내시경 초음파는 위 상피하 병변을 감별진단하는 데 유용하게 쓰일 수 있지만 검사자의 숙련도에 따라 진단 정확도에 차이가 크며, 특히 크기가 작은 상피하 병변에서는 내시경 초음파의 진단 정확도가 45.5~48%로 낮게 보고되었다[7]. 따라서 크기가 작은 경우 백색광 내시경에서 양성 소견을 보이거나 악성화를 시사하는 표면의 점막 변화가 없다면 내시경 초음파를 이용한 감별진단이 반드시 필요하지는 않다.
위 상피하 병변은 상피 아래에 있기 때문에 조직 생검 겸자를 이용하여 진단을 하기가 쉽지 않다. 일반적으로 작은 상피하 병변의 경우 대부분이 양성 병변이기 때문에 악성화를 의심하게 하는 표면 구조의 변화나 미란 또는 궤양이 동반되지 않았다면 조직학적 진단이 꼭 필요하지는 않다. 하지만 백색광 내시경이나 내시경 초음파에서 악성 병변이 의심되거나 또는 양성 병변과의 감별이 어렵다면 조직학적 진단을 고려해야한다. 일반 조직 생검 겸자 대신 큰 생검 겸자를 이용하여 같은 부위에 반복 생검하는 bite-on-bite 방법이 있으나, 정확도가 17~40%로 낮으며 출혈의 위험성이 높다. 이러한 단점을 극복하기 위해 점막절개 보조생검, 내시경 초음파 유도하 세침 조직 검사, 또는 내시경 절제술을 시행할 수 있다.
내시경 초음파 유도 하에 병변에 시침을 삽입하여 조직 절편검체(core tissue specimen)를 얻는 방법이다. 최근 보고된 메타분석에서는 59.9%의 진단 정확도를 보였으나, 시술자의 숙련도에 따라 38~87% 가량 차이를 보이고 있으며, 출혈이나 천공과 같은 합병증은 잦은 편으로 보고되었다[10]. 길고 굵은 바늘을 사용하기 때문에 2 cm 미만의 크기가 작은 병변, 특히 rolling sign이 있는 단단한 병변에서는 정확한 targeting 및 충분한 조직 채취가 어려우며, 또한 내시경이 꺾이는 부위에서는 검사가 용이하지 않다.
무증상의 크기가 작은 양성 위 상피하 병변에서 절제가 필요한 경우는 드물다. 대부분의 가이드라인에서는 2 cm 이상의 경우, 2 cm 미만에서는 악성화 위험도가 높을 때 절제를 권고하고 있다[11-13]. 따라서 내시경 절제술은 병변의 크기, 크기 증가 여부, 표면 구조의 변화, 초음파 내시경 소견, 악성화 위험도, 절제 위험도, 내시경 의사의 숙련도에 따라 사례별로 접근하는 것이 바람직하다. 고유근층에서 기원한 위상피하 병변 중 GIST가 의심될 경우 진단 및 치료 목적으로 내시경 절제술을 시행할 수 있으며, 종양 전체를 제거하게 되어 진단율을 높일 수 있고, 명확한 진단으로 환자의 불안감을 낮출 수 있다는 장점이 있다. 상피하 병변의 내시경 점막하 박리술(endoscopic submucosal dissection, ESD)의 완전 절제 빈도는 73~94%로 범위가 넓고, 천공과 같은 합병증의 빈도도 6~19.7%로 비교적 높은 것으로 알려져 있다[14-16]. 따라서 이러한 단점을 극복하기 위해 점막하 터널 내시경 절제술(submucosal tunneling endoscopic resection, STER)과 내시경 전층 절제술(endoscopic full-thickness rescection, EFTR)이 적용되고 있다. STER는 경구내시경 근육절개술(peroral endoscopic myotomy)의 원리와 마찬가지로 병변에서 3~5 cm 근위부에 점막을 절개한 후 점막하층 터널을 통하여 병변에 접근하고, 병변이 노출되면 고유근층을 포함하여 이를 완전 절제, 수거한 후 점막판은 클립을 이용하여 봉합하는 방법이다. 위식도 접합부와 식도의 상피하 병변 치료에 대한 후향적 연구에서, STER은 수술과 비교하였을 때 완전 절제율은 비슷하며, 시술시간 및 입원 기간이 짧음을 확인하였다[17,18]. EFTR은 병변 주위에 원형으로 점막을 절개한 후 고유근층과 장막층까지 추가로 박리 및 절개를 하여 병변을 제거하게 된다. 장막층 절개로 인한 천공은 클립이나 박리성 올가미(detachable snare)를 이용하여 완전 봉합한다. 내시경 시술로 인해 발생하는 천공이나 출혈, 복강내 감염과 같은 합병증은 보존적 치료로 대부분 호전되는 것으로 보고되었다. STER이나 EFTR를 이용한 위장관간질종양의 절제술에서, 시술 후 내시경상 완전 절제율은 95~100%, 조직병리 검사상 완전 절제율은 93.3~100%로 ESD와 비교 시 우수한 결과를 확인할 수 있었다[19-21]. 하지만 다양한 합병증과 응급상황이 발생할 수 있으므로 고도로 숙련된 소화기 내시경 의사가 선택적으로 시술을 해야 하는 것이 중요하다.
크기가 2 cm 미만의 위 상피하 병변에서 악성을 시사하는 소견이 없다면 대부분은 추적 관찰을 하게 된다. 추적 관찰 중 내시경을 통한 크기나 표면 변화를 유심히 관찰하는 것이 악성 종양과 같은 치료가 필요한 병변의 감별에 중요하다. 954개의 상부소화관 점막하 병변을 추적 관찰한 연구에서 47.3개월 동안 3.6%의 병변이 25% 가량의 크기 증가를 보였다고 보고하였다[2]. 또 다른 연구에서는 989개의 위 상피하 병변에 대하여 평균 24개월간 추적 관찰하였을 때, 병변의 크기가 1 cm 미만에서 6.4%, 1~2 cm에서 10.4%, 2 cm 이상에서 9.8%에서 크기 증가 소견이 있었다. 크기에 따른 크기 증가 속도는 1년에 1 cm 미만에서 1 mm, 1~2 cm에서 2 mm, 2 cm 이상에서 3 mm 가량으로 확인되었다[22]. 이러한 연구를 바탕으로 크기가 작은 위 상피하 병변의 추적 관찰 시기는 1~2년 간격을 고려할 수 있다. 최근 유럽내시경학회 가이드라인에서는 명확하게 진단되지 않은 상피하 병변에 대하여 3~6개월 후 추적 검사 내시경을 시행 후, 1 cm 미만에서는 2~3년 간격, 1~2 cm에서는 1~2년 간격으로 권고하고 있다. 내시경 초음파의 경우 2 cm 이상의 병변에 대하여 시행하도록 권고하고 있으며[23], 내시경 추적 관찰 중 크기나 모양에 변화가 있는 경우 고려할 수 있다. 이러한 추적 검사는 악성화 가능성을 고려한 검사이기 때문에, 백색광 내시경 또는 초음파 내시경을 통하여 평활근종, 지방종, 이소성 췌장과 같이 명백하게 양성 병변이라고 판단된 병변에 대해서는 국가 암 검진 프로그램을 통한 내시경 추적 검사를 하는 것을 고려할 수 있다.
위 상피하 병변은 상부위장관 내시경 검사에서 흔하게 발견된다. 대부분의 병변은 크기가 작고 양성 병변으로, 내시경 의사들은 이에 대하여 지나치게 걱정할 필요는 없다. 병변의 위치, 색조, 크기, 이동성, 경도, 표면 변화와 같은 특징을 면밀하게 관찰하고, 크기가 2 cm 미만이면서 악성을 시사하는 소견이 없다면 내시경 추적 검사를 고려한다. 표면 점막 구조의 변화가 있거나 악성 병변의 가능성을 배제해야 한다면 내시경 초음파 검사를 고려한다. 내시경 초음파에서의 개별적인 특징을 바탕으로 악성 또는 악성화 여부를 판단하고, 이를 바탕으로 하여 추가적인 조직 진단 및 치료 여부를 결정하게 된다. 크기가 2 cm 미만의 작은 위 상피하 병변의 특징적인 내시경 소견(Fig. 1)과 전체적인 접근법(Fig. 2)에 대하여 Fig. 1, 2에 정리하였다. 추적 관찰을 하게 되는 경우라도 병변의 크기 변화와 표면 구조의 변화에 대한 면밀한 관찰을 통해 악성화 위험성이 있는 위 상피하 병변을 놓치지 않고 적절히 치료하려는 노력이 필요하다.
Acknowledgements
This work was supported by clinical research grant from Pusan National University Hospital in 2022.
Fig. 1.
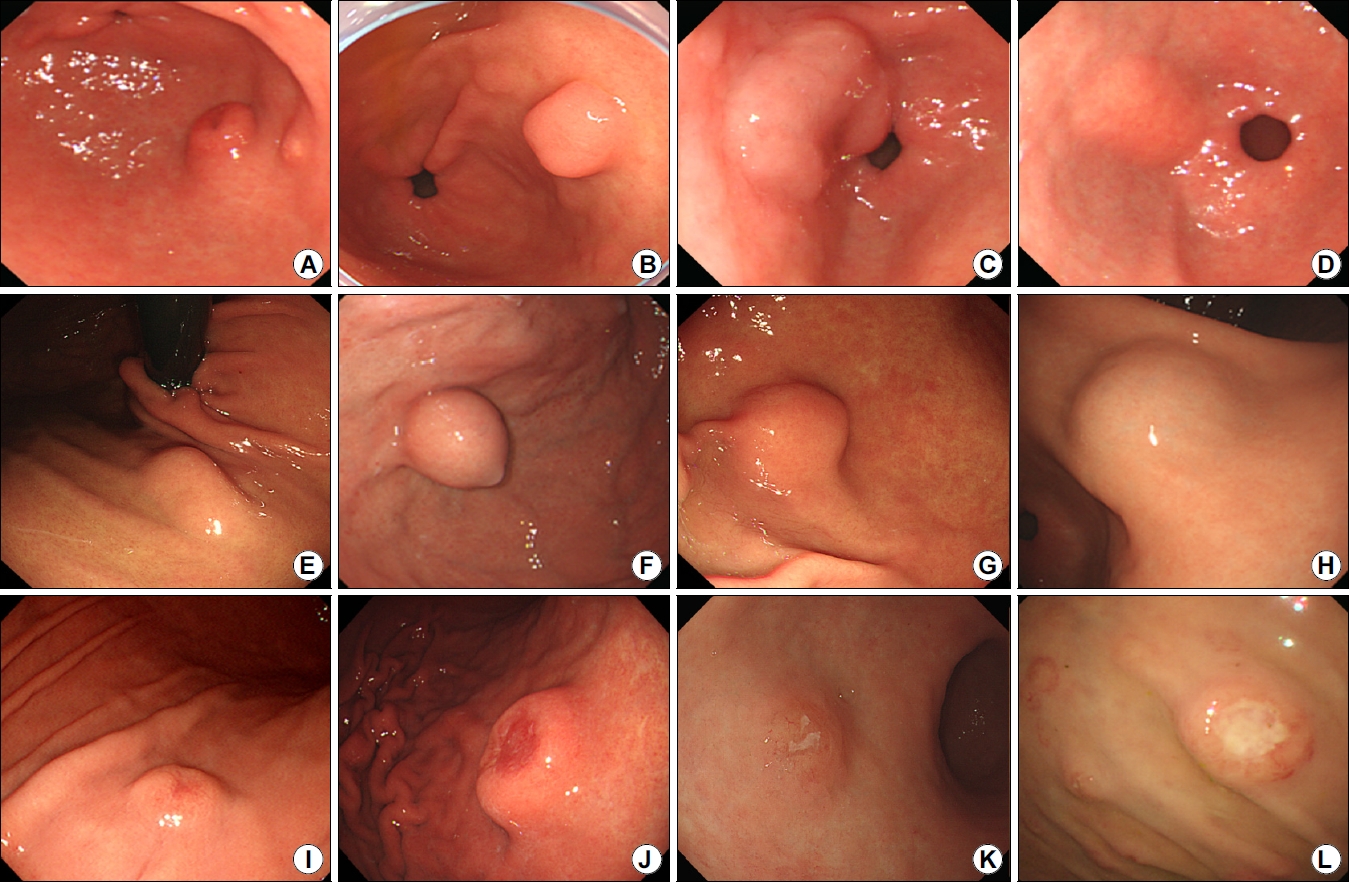
Endoscopic features of small gastric subepithelial lesions (<2 cm). (A) Images showing ectopic pancreas compressing the antrum, (B) inflammatory fibrinoid polyp, (C) cyst, (D) lipoma, (E) leiomyoma, (F) gastrointestinal stromal tumor, (G) schwannoma, (H) glomus tumor, (I) neuroendocrine tumor, (J) subepithelial tumor-like carcinoma, (K) mucosa-associated lymphoid tissue lymphoma, and (L) metastatic carcinoma.
REFERENCES
1. Lee JH, Lee HL, Ahn YW, et al. Prevalence of gastric subepithelial tumors in Korea: a single center experience. Korean J Gastroenterol 2015;66:274–276.


2. Song JH, Kim SG, Chung SJ, Kang HY, Yang SY, Kim YS. Risk of progression for incidental small subepithelial tumors in the upper gastrointestinal tract. Endoscopy 2015;47:675–679.


3. Chen HT, Xu GQ, Teng XD, Chen YP, Chen LH, Li YM. Diagnostic accuracy of endoscopic ultrasonography for rectal neuroendocrine neoplasms. World J Gastroenterol 2014;20:10470–10477.



4. He G, Wang J, Chen B, et al. Feasibility of endoscopic submucosal dissection for upper gastrointestinal submucosal tumors treatment and value of endoscopic ultrasonography in pre-operation assess and post-operation follow-up: a prospective study of 224 cases in a single medical center. Surg Endosc 2016;30:4206–4213.



5. Kim SY, Shim KN, Lee JH, et al. Comparison of the diagnostic ability of endoscopic ultrasonography and abdominopelvic computed tomography in the diagnosis of gastric subepithelial tumors. Clin Endosc 2019;52:565–573.




6. Kim GH, Park DY, Kim S, et al. Is it possible to differentiate gastric GISTs from gastric leiomyomas by EUS? World J Gastroenterol 2009;15:3376–3381.



7. Karaca C, Turner BG, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial lesions. Gastrointest Endosc 2010;71:722–727.


8. Goto O, Kaise M, Iwakiri K. Advancements in the diagnosis of gastric subepithelial tumors. Gut Liver 2022;16:321–330.


9. Giri S, Afzalpurkar S, Angadi S, Sundaram S. Mucosal incision-assisted biopsy versus endoscopic ultrasound-assisted tissue acquisition for subepithelial lesions: a systematic review and meta-analysis. Clin Endosc 2022;55:615–625.




10. Zhang XC, Li QL, Yu YF, et al. Diagnostic efficacy of endoscopic ultrasound-guided needle sampling for upper gastrointestinal subepithelial lesions: a meta-analysis. Surg Endosc 2016;30:2431–2441.



11. Network NCC. NCCN Clinical Practice Guideline in Oncology. Gastrointestinal Stromal Tumors (GISTs) version 1 [Internet]. Plymouth Meeting (PA): NCCN; 2021 [cited 2020 Oct 30]. Available from: http://www.nccn.ir/Guidelines/Summary/gist.html.
12. Casali PG, Abecassis N, Aro HT, et al. Gastrointestinal stromal tumours: ESMO-EURACAN clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018;29(Suppl 4):iv68–iv78.
13. Standards of Practice Committee, Faulx AL, Kothari S, et al. The role of endoscopy in subepithelial lesions of the GI tract. Gastrointest Endosc 2017;85:1117–1132.


14. Chun SY, Kim KO, Park DS, et al. Endoscopic submucosal dissection as a treatment for gastric subepithelial tumors that originate from the muscularis propria layer: a preliminary analysis of appropriate indications. Surg Endosc 2013;27:3271–3279.




15. Zhang S, Chao GQ, Li M, Ni GB, Lv B. Endoscopic submucosal dissection for treatment of gastric submucosal tumors originating from the muscularis propria layer. Dig Dis Sci 2013;58:1710–1716.



16. He Z, Sun C, Wang J, et al. Efficacy and safety of endoscopic submucosal dissection in treating gastric subepithelial tumors originating in the muscularis propria layer: a single-center study of 144 cases. Scand J Gastroenterol 2013;48:1466–1473.


17. Li QY, Meng Y, Xu YY, et al. Comparison of endoscopic submucosal tunneling dissection and thoracoscopic enucleation for the treatment of esophageal submucosal tumors. Gastrointest Endosc 2017;86:485–491.


18. Chen T, Lin ZW, Zhang YQ, et al. Submucosal tunneling endoscopic resection vs thoracoscopic enucleation for large submucosal tumors in the esophagus and the esophagogastric junction. J Am Coll Surg 2017;225:806–816.


19. Chen T, Zhang C, Yao LQ, et al. Management of the complications of submucosal tunneling endoscopic resection for upper gastrointestinal submucosal tumors. Endoscopy 2016;48:149–155.


20. Tan Y, Tang X, Guo T, et al. Comparison between submucosal tunneling endoscopic resection and endoscopic full-thickness resection for gastric stromal tumors originating from the muscularis propria layer. Surg Endosc 2017;31:3376–3382.



21. Pang T, Zhao Y, Fan T, et al. Comparison of safety and outcomes between endoscopic and surgical resections of small (≤5 cm) primary gastric gastrointestinal stromal tumors. J Cancer 2019;10:4132–4141.



-
METRICS

-
- 1 Crossref
- 1,986 View
- 88 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Homogenous Subepithelial Esophageal Lesion2023 March;23(1)
Common Gastric Subepithelial Tumors in Koreans2022 March;22(1)
A Gastric Subepithelial Tumor with a Positive Pillow Sign2021 March;21(1)
Natural Course of Gastric Subepithelial Tumor2015 March;15(1)
Endoscopic Treatment of Gastric Subepithelial Tumor2015 March;15(1)