 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 21(3); 2021 > Article |
|
Abstract
Treatments aimed at eradicating Helicobacter pylori (H. pylori) infections in children and adolescents should be clearly beneficial. According to the updated guidelines, a 14-day triple therapy or bismuth-based triple therapy is the first choice for treatment of children based on the results of antimicrobial sensitivity testing. Though culturing H. pylori using biopsy specimens is not always feasible, it should be performed for establishing empirical rescue therapy for patients not responding to first-line eradication therapy. The European and North American therapeutic strategies for children and adolescents with H. pylori infections may not be appropriate for treating children and adolescents in other countries owing to regional differences in epidemiological characteristics of H. pylori. The existence of clarithromycin-resistant H. pylori is an important factor involved in eradication failure. The development of new treatment-related allergies, treatment failure, side effects, and alteration of the gut microbiome have been highlighted as factors potentially outweighing the possible benefit of preventing future peptic ulcers or gastric cancer. Drug compliance can be improved by providing a detailed explanation of the reason for therapy, duration, and routes of drug administration. Physicians should understand the mechanisms underlying eradication treatment and explain drug prescriptions in detail to both parents and children to increase compliance. Herein, we reviewed the indications for and various modalities of eradication treatment in children with H. pylori infections in accordance with a review of recently published articles.
ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼(Helicobacter pylori, H. pylori) Ļ░ÉņŚ╝ņØĆ ņÜ░ļ”¼ļéśļØ╝ļź╝ ĒżĒĢ©ĒĢśņŚ¼ ņäĖĻ│äņĀüņ£╝ļĪ£ Ļ░ÉņåīĒĢśĻ│Ā ņ׳ļŖö ņČöņäĖņØ┤ļ®░[1-3], H. pylori Ļ░ÉņŚ╝ņØś ĒĢ©ļ│æņ”ØņØĖ ņåīĒÖöņä▒ ĻČżņ¢æ, ņןņāüĒö╝ĒÖöņāØ, ņ£äņĢö ļ░£ņāØ ļō▒ņØ┤ ņä▒ņØĖņŚÉ ļ╣äĒĢ┤ ņĀüņ¢┤ ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ļŖö H. pylori Ļ░ÉņŚ╝ņØ┤ ĒÖĢņØĖļÉśļŹöļØ╝ļÅä ļæÉ Ļ░Ćņ¦Ć ņØ┤ņāüņØś ĒĢŁņāØņĀ£ļĪ£ ĻĄ¼ņä▒ļÉ£ ņĀ£ĻĘĀ ņ╣śļŻīļŖö ĒĢŁņāØņĀ£ ļé┤ņä▒ļźĀ ņ”ØĻ░ĆņÖĆ ņ×¼Ļ░ÉņŚ╝ņØä Ļ│ĀļĀżĒĢśņŚ¼ ļ¬ģĒÖĢĒĢ£ ņØ┤ļōØņØ┤ ņ׳ļŗżĻ│Ā ĒīÉļŗ©ļÉĀ ļĢī ņŗ£Ē¢ēĒĢśļÅäļĪØ ĻČīņןĒĢ£ļŗż[4]. ĻĘĖļ¤╝ņŚÉļÅä H. pylori Ļ░ÉņŚ╝Ļ│╝ Ļ┤ĆļĀ©ļÉ£ ņ£äņĢö ļ░£ņāØņØ┤ ļåÆņØĆ ņÜ░ļ”¼ļéśļØ╝ņÖĆ ņØ╝ļ│ĖņŚÉņä£ļŖö ņ”ØņāüņØ┤ ņ׳ļŖö ņåīņĢäņ▓ŁņåīļģäņŚÉĻ▓īņä£ H. pylori Ļ░ÉņŚ╝ņØ┤ ĒÖĢņØĖļÉśļ®┤ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ņĀüņÜ®ĒĢśĻĖ░ļÅä ĒĢ£ļŗż[5,6].
ņÜ░ļ”¼ļéśļØ╝ ņä▒ņØĖ H. pylori Ļ░ÉņŚ╝ņŚÉ ļīĆĒĢ£ ņĀ£ĻĘĀ ņ╣śļŻī ņ×äņāüņ¦Ćņ╣©ņØĆ 2019ļģäņŚÉ ŌĆśĒĢ£ĻĄŁņØĖ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ Ļ░ÉņŚ╝ņØś ņ¦äļŗ©Ļ│╝ ņ╣śļŻī ņ×äņāüņ¦äļŻīņ¦Ćņ╣©ŌĆÖņØ┤ Ļ░£ņĀĢļÉśņ¢┤ ņĀüņÜ® ņżæņØ┤ļŗż[7]. ņØ┤ ņ×äņāüņ¦Ćņ╣©ņØĆ 2018ļģä ņÜ░ļ”¼ļéśļØ╝ ņä▒ņØĖņŚÉņä£ clarithromycin ĒĢŁņāØņĀ£ ļé┤ņä▒ĻĘĀņØ┤ 29%ļĪ£ Ļ░ÉņåīĒĢśĻ│Ā, ņÜ®ļ¤ēņØä ņś¼ļ”░ Ēæ£ņżĆ 3ņĀ£ņÜöļ▓ĢĻ│╝ Ēæ£ņżĆ 3ņĀ£ņÜöļ▓Ģ 14ņØ╝ ņĀ£ĻĘĀ ņ╣śļŻīĻ░Ć ĒĢŁņāØņĀ£ ļé┤ņä▒ĻĘĀņØ┤ ĒÖĢņØĖļÉ£ Ļ▓ĮņÜ░ņŚÉļÅä ņĀ£ĻĘĀņ£©ņØ┤ ņ”ØĻ░ĆĒĢ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ļ░śņśüĒĢśņŚ¼[8] Ļ░£ņĀĢļÉśņŚłņ£╝ļ®░, 1ņ░© ņĀ£ĻĘĀņÜöļ▓Ģņ£╝ļĪ£ Ēæ£ņżĆ 3ņĀ£ņÜöļ▓Ģ(ņ¢æņä▒ņ×ÉĒÄīĒöäņ¢ĄņĀ£ņĀ£[proton pump inhibitors, PPIs]+amoxicillin+clarithromycin) 14ņØ╝, ņł£ņ░©ņĀü ņÜöļ▓Ģ, ļÅÖņŗ£ ņ╣śļŻīņÜöļ▓Ģ, bismuth 4ņĀ£ņÜöļ▓ĢņØä ņĀ£ņŗ£ĒĢśņśĆļŗż[8].
ņÜ░ļ”¼ļéśļØ╝ ņåīņĢäņ▓Łņåīļģä H. pylori Ļ░ÉņŚ╝ņŚÉ ļīĆĒĢ£ ņ¦äļŗ©Ļ│╝ ņ╣śļŻī Ļ┤ĆļĀ© ņ×äņāüņ¦Ćņ╣©ņØĆ ĻĄŁļé┤ņŚÉņä£ ļ¦īļōżņ¢┤ņ¦ä Ļ▓āņØĆ ņŚåĻ│Ā, ņ£Āļ¤ĮĻ│╝ ļ»ĖĻĄŁ ņåīņĢäņåīĒÖöĻĖ░ ņśüņ¢æĒĢÖĒÜī(The European Society for Pediatric Gastroenterology Hepatology and Nutrition/North American Society for Pediatric Gastroenterology, Hepatology and Nutrition, ESPGHAN/NASPGHAN)ņŚÉņä£ ļ¦īļōĀ ņ×äņāüņ¦Ćņ╣©ņØä ļö░ļźĖļŗż[4]. ņØ┤ļŖö 2017ļģäņŚÉ ļīĆĒĢ£ņåīņĢäņåīĒÖöĻĖ░ņśüņ¢æĒĢÖĒÜī ĒÜīņøÉņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņäżļ¼ĖņĪ░ņé¼ņŚÉņä£ ESPGHAN/NASPGHAN ņ×äņāüņ¦Ćņ╣©ņŚÉņä£ ĻČīņןĒĢśļŖö Ēæ£ņżĆ 3ņĀ£ņÜöļ▓ĢņØä 71.4%, bismuth 4ņĀ£ņÜöļ▓ĢņØä 25.0%ņŚÉņä£ 1ņ░© ņĀ£ĻĘĀ ņ╣śļŻīļ▓Ģņ£╝ļĪ£ ņäĀĒāØĒĢ£ Ļ▓░Ļ│╝ļĪ£ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż[5]. ņØ╝ļ│Ė ņåīņĢäņåīĒÖöĻĖ░ņśüņ¢æĒĢÖĒÜī(Japanese Society for Pediatric Gastroenterology, Hepatology and Nutrition, JSPGHAN)ņŚÉņä£ļŖö Ļ│Āļō▒ĒĢÖņāØņØä ļīĆņāüņ£╝ļĪ£ ļ╣äņ╣©ņŖĄ Ļ▓Ćņé¼ļĪ£ ņäĀļ│ä Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ H. pylori Ļ░ÉņŚ╝ņØä ņ¦äļŗ©ĒĢśĻ│Ā ņ╣śļŻīĒĢśļŖö ŌĆśtest-and-treatŌĆÖ ņ×äņāü ņŚ░ĻĄ¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā[6], ņØ┤ Ļ▓░Ļ│╝ļź╝ ĻĘ╝Ļ▒░ļĪ£ ļ¼┤ņ”Øņāü ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ļŖö ļ╣äņ╣©ņŖĄņĀü Ļ▓Ćņé¼ļĪ£ H. pylori Ļ░ÉņŚ╝ņØ┤ ņ¦äļŗ©ļÉśļŹöļØ╝ļÅä ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ĻČīņןĒĢśņ¦Ć ņĢŖļŖöļŗżĻ│Ā 2018ļģäņŚÉ Ļ░£ņĀĢĒĢśņśĆļŗż[9].
ņÜ░ļ”¼ļéśļØ╝ ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ H. pyloriĻĘĀ Ļ░ÉņŚ╝ņØś Ēśłņ▓ŁĒĢÖņĀü ņ£Āļ│æļźĀņØĆ Ļ░ÉņåīĒĢśĻ│Ā ņ׳ņ£╝ļéś[10] ļ│ĄĒåĄņØ┤ļéś ņ£äņןĻ┤Ć ņČ£Ēśł ļō▒ņ£╝ļĪ£ ļ│æņøÉņŚÉ ņśżļŖö ņåīņĢäņ▓ŁņåīļģäņŚÉĻ▓ī ļé┤ņŗ£Ļ▓ĮņØä ņŗ£Ē¢ēĒĢśļ®┤ H. pylori Ļ░ÉņŚ╝ņØ┤ ĒÖĢņØĖļÉśļŖö Ļ▓ĮņÜ░ļź╝ ņ×äņāüņŚÉņä£ ĒØöĒ׳ ļ¦īļéśĻ▓ī ļÉ£ļŗż. ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ H. pylori Ļ░ÉņŚ╝ņØ┤ ĒÖĢņØĖļÉśļ®┤ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ĒĢ┤ņĢ╝ ĒĢśļŖöņ¦Ć, ĒĢ£ļŗżļ®┤ ņ¢┤ļ¢ż ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ĒĢ┤ņĢ╝ ĒĢĀņ¦Ć ņØśņé¼ļĪ£ņä£ Ļ│Āļ»╝ņØä ĒĢĀ ņłś ņ׳ļŗż. ņŚ¼ĻĖ░ņä£ļŖö 2017~2021ļģä ņé¼ņØ┤ņŚÉ ļ░£Ēæ£ļÉ£ ņåīņĢäņ▓Łņåīļģä H. pylori Ļ░ÉņŚ╝ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ĻĄŁļé┤ņÖĖ ļ¼ĖĒŚīņØä Ļ│Āņ░░ĒĢśņŚ¼ ņÜ░ļ”¼ļéśļØ╝ ņåīņĢäņ▓Łņåīļģä H. pylori Ļ░ÉņŚ╝ņØś ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņĀæĻĘ╝ņØä ņĀĢļ”¼ĒĢśņŚ¼ ņ¦äļŻīņŚÉ ļÅäņøĆņØ┤ ļÉśĻ│Āņ×É ĒĢ£ļŗż.
ESPGHAN/NASPGHAN ņ×äņāüņ¦Ćņ╣©ņŚÉņä£ ņĀ£ņŗ£ĒĢ£ ņåīņĢäņ▓Łņåīļģä H. pylori Ļ░ÉņŚ╝ņØś ņĀ£ĻĘĀ ņ╣śļŻī ņĀüņØæņ”ØņØĆ ņåīĒÖöņä▒ ĻČżņ¢æ(peptic ulcer)ņØ┤ļ®░ ņåīĒÖöņä▒ ĻČżņ¢æņØ┤ ņ׳ļŖö ņåīņĢäņ▓Łņåīļģä ĒÖśņ×ÉņØś 35%Ļ░Ć H. pylori Ļ░ÉņŚ╝ņØ┤ ņ׳ņ£╝ļ»ĆļĪ£, H. pylori Ļ░ÉņŚ╝ņØ┤ ĒÖĢņØĖļÉśņ¦Ć ņĢŖļŹöļØ╝ļÅä ņåīĒÖöņä▒ ĻČżņ¢æņØ┤ ņ׳ļŖö Ļ▓āļ¦īņ£╝ļĪ£ļÅä ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśļØ╝Ļ│Ā ĻČīņןĒĢ£ļŗż[4]. ĻĘĖ ļ░¢ņØś ņĀ£ĻĘĀ ņ╣śļŻī ņĀüņØæņ”ØņŚÉļŖö ļ¦īņä▒ ĒŖ╣ļ░£ĒśłņåīĒīÉĻ░Éņåīņ×Éļ░śļ│æ(idiopathic thrombocytopenic purpura), ņ▓ĀĻ▓░ĒĢŹļ╣łĒśł(iron deficiency anemia), ņ£äņĢöņØś Ļ░ĆņĪ▒ļĀźņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ļō▒ņØ┤ļŗż[4].
ņÜ░ļ”¼ļéśļØ╝ ņåīņĢäņ▓ŁņåīļģäņŚÉĻ▓ī ņāüļČĆņ£äņןĻ┤Ć ļé┤ņŗ£Ļ▓ĮņØä ņŗ£Ē¢ēĒĢśņŚ¼ H. pylori Ļ░ÉņŚ╝ņØä ņ¦äļŗ©ĒĢśĻ│Ā ņ╣śļŻīĒĢ£ Ļ▓ĮĒŚśņØ┤ ņ׳ļŖö ļīĆĒĢ£ņåīņĢäņåīĒÖöĻĖ░ņśüņ¢æĒĢÖĒÜī ĒÜīņøÉ ļīĆņāü ņäżļ¼ĖņĪ░ņé¼ņŚÉņä£ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ Ē¢łļŹś ņĀüņØæņ”ØņØĆ ņåīĒÖöņä▒ ĻČżņ¢æņØ┤ 85.7%ļĪ£ Ļ░Ćņן ļ¦ÄņĢśĻ│Ā, ļŗżņØīņ£╝ļĪ£ ļ¦īņä▒ ļ│ĄĒåĄņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░(60.7%), ņ£äņĢöņØś Ļ░ĆņĪ▒ļĀźņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░(42.9%) ņł£ņä£ņśĆļŗż[5]. ĻĘĖ ņÖĖņŚÉ ļé┤ņŗ£Ļ▓Įņ£╝ļĪ£ H. pylori Ļ░ÉņŚ╝ņØ┤ ĒÖĢņØĖļÉ£ ņåīĒÖöļČłļ¤ē, ĒØæņāēļ│Ć, ļ¦īņä▒ ļæÉļō£ļ¤¼ĻĖ░Ļ░Ć ņ׳ļŖö Ļ▓ĮņÜ░ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ļ│┤ĒśĖņ×ÉņØś Ļ▒▒ņĀĢņØ┤ ņŗ¼ĒĢ£ Ļ▓ĮņÜ░ņŚÉļÅä ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż[5].
2019ļģä Ļ░£ņĀĢĒĢ£ ņØ╝ļ│Ė JSPGHAN ņ×äņāüņ¦Ćņ╣©ņŚÉņä£ ņĀ£ņŗ£ĒĢ£ ņĀ£ĻĘĀ ņ╣śļŻī ņĀüņØæņ”ØņØĆ ņåīĒÖöņä▒ ĻČżņ¢æ, ņ▓ĀļČäĻ▓░ĒĢŹļ╣łĒśł, ļ¦īņä▒ ĒŖ╣ļ░£ĒśłņåīĒīÉĻ░Éņåīņ×Éļ░śļ│æ, ņ£äņĢöņØś Ļ░ĆņĪ▒ļĀźņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņØ┤ļ®░, ĻĘĖ ļ░¢ņŚÉļÅä H. pylori Ļ░ÉņŚ╝ņØ┤ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļĪ£ ĒÖĢņØĖļÉ£ ļ│ĄļČĆ ņ”Øņāü(ļ│ĄĒåĄ, ĻĄ¼ĒåĀ, ņäżņé¼ ļō▒), ļ│æļ”¼ņĪ░ņ¦üĒĢÖņĀü Ļ▓Ćņé¼ņŚÉņä£ ļ¦īņä▒ ņ£äņŚ╝, ņ£äņČĢņä▒ ņ£äņŚ╝, ņ£ä mucosa-associated lymphoid tissue (MALT) ļ”╝Ēöäņóģ, ļŗ©ļ░▒ņåīņŗż ņ£äņןĻ┤Ćļ│æņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņØ┤ļŗż[9]. ļśÉĒĢ£, Ļ░ĆņĪ▒ ņżæņŚÉ H. pylori Ļ░ÉņŚ╝ņŚÉ ļīĆĒĢ£ ņ╣śļŻīļź╝ ļ░øņØĆ ņé¼ļ×īņØ┤ ņ׳ņ£╝ļ®┤, ļ╣äņ╣©ņŖĄņĀü ļ░®ļ▓Ģņ£╝ļĪ£ H. pylori Ļ░ÉņŚ╝ņØ┤ ņ¦äļŗ©ļÉśņ¢┤ļÅä ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ĻČīņןĒĢśņśĆļŗż[9]. ņØ╝ļ│ĖņŚÉņä£ļŖö ņ×¼Ļ░ÉņŚ╝ņØä Ļ│ĀļĀżĒĢśņŚ¼ ņ×¼Ļ░ÉņŚ╝ļźĀņØ┤ ļé«ņØĆ 5ņäĖ ņØ┤ņāüņŚÉņä£ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ĒĢśļØ╝Ļ│Ā ĻČīņןĒĢśņśĆĻ│Ā, 5ņäĖ ņØ┤ĒĢśņØś ņåīņĢäņŚÉņä£ļŖö Ēśæņ░®ņØ┤ ņ׳ļŖö ņåīĒÖöņä▒ ĻČżņ¢æ, ņ▓£Ļ│ĄņØ┤ļéś ņČ£ĒśłņØś ņ×¼ļ░£, MALT ļ”╝ĒöäņóģņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉļ¦ī ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ĒĢśņ×ÉĻ│Ā ņĀĢĒĢśņśĆļŗż[9].
ļ»ĖĻĄŁĻ│╝ ņ£Āļ¤ĮņŚÉņä£ļŖö H. pylori Ļ░ÉņŚ╝ļźĀņØ┤ ļé«Ļ│Ā, ĒĢŁņāØņĀ£ ļé┤ņä▒ņØ┤ ļåÆņĢä ņĀ£ĻĘĀ ņ╣śļŻīņØś ļé«ņØĆ ĒÜ©ņ£© ļĢīļ¼ĖņŚÉ, Ļ░ĆļŖźĒĢśļŗżļ®┤ ĒĢŁņāØņĀ£ ļé┤ņä▒ Ļ▓Ćņé¼(antimicrobial susceptibility testing) Ļ▓░Ļ│╝ņŚÉ ļö░ļØ╝ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ Ļ▓░ņĀĢĒĢśļÅäļĪØ ĻČīņןĒĢśņśĆĻ│Ā[4], ņ╣śļŻī ņŗżĒī©, ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļö░ļźĖ ļČĆņ×æņÜ®(side effects), ņןļé┤ ņäĖĻĘĀņ┤Ø(microbiome) ļ│ĆĒÖöļź╝ H. pylori Ļ░ÉņŚ╝ņŚÉ ņØśĒĢ£ ņ¦łĒÖśņØä ņśłļ░®ĒĢśļŖö Ļ▓āļ│┤ļŗż ņżæņÜöĒĢśĻ▓ī ĒīÉļŗ©ĒĢśņśĆļŗż[4]. ĒĢŁņāØņĀ£ ļé┤ņä▒ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢĀ ņłś ņŚåļŖö ņāüĒÖ®ņŚÉņä£ļŖö bismuth 4ņĀ£ņÜöļ▓Ģ 14ņØ╝ ņ╣śļŻīļź╝, bismuth ņĀ£ņĀ£Ļ░Ć ņŚåļŖö ņ¦ĆņŚŁņŚÉņä£ļŖö Ļ│ĀņÜ®ļ¤ē PPI+amoxicillin+metronidazole 14ņØ╝ ņ╣śļŻīļź╝ ĻČīĒĢśņśĆļŗż[4]. ļéśļØ╝ļ¦łļŗż H. pylori Ļ░ÉņŚ╝ ļ╣łļÅäļéś ĒĢŁņāØņĀ£ ļé┤ņä▒ņØ┤ ļŗżļź┤ļ»ĆļĪ£, Ļ░ĆļŖźĒĢśļŗżļ®┤ H. pyloriĻĘĀ ĒĢŁņāØņĀ£ ļé┤ņä▒ņØś ļ│ĆĒÖöņÖĆ Ļ░ÉņŚ╝ ļ╣łļÅäļź╝ ĒÖĢņØĖĒĢśņŚ¼ ņ╣śļŻīļź╝ Ļ▓░ņĀĢĒĢ┤ņĢ╝ ĒĢ£ļŗż[11]. ņØ╝ļ│ĖņŚÉņä£ļÅä H. pylori Ļ░ÉņŚ╝ņØä ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļĪ£ ņ¦äļŗ©ĒĢ£ 45ļ¬ģņØś ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ clarithromycin ļé┤ņä▒ļźĀņØ┤ 71.1%ļĪ£ ļåÆĻ▓ī ĒÖĢņØĖļÉśņ¢┤, clarithromycinņŚÉ ļé┤ņä▒ņØ┤ ņ׳Ļ│Ā amoxicillinņŚÉ ļé┤ņä▒ņØ┤ ņŚåņ£╝ļ®┤ PPI+amoxicillin+metronidazole ņĪ░ĒĢ®ņ£╝ļĪ£, amoxicillinņØ┤ļéś metronidazoleņŚÉļÅä ļé┤ņä▒ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉļŖö PPI+metronidazole+minomycin ņĪ░ĒĢ®ņ£╝ļĪ£ ņ╣śļŻīĒĢśņŚ¼ ņĀ£ĻĘĀņ£©ņØ┤ 97.7%ļĪ£ ļåÆņĢäņĪīņØīņØä ļ│┤Ļ│ĀĒĢśļ®┤ņä£ ĒĢŁņāØņĀ£ ļé┤ņä▒ Ļ▓Ćņé¼ņØś ņżæņÜöņä▒ņØä Ļ░ĢņĪ░ĒĢśņśĆļŗż[12].
ĒĢŁņāØņĀ£ ļé┤ņä▒ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢĀ ņłś ņŚåļŖö ņāüĒÖ®ņŚÉņä£ļŖö ņ¦ĆņŚŁņé¼ĒÜīņØś clarithromycin ĒĢŁņāØņĀ£ ļé┤ņä▒ļźĀņŚÉ ļö░ļØ╝ Ļ▓ĮĒŚśņĀü ņ╣śļŻī(empirical treatment)ļź╝ ņŗ£Ē¢ēĒĢ£ļŗż. Clarithromycin ĒĢŁņāØņĀ£ ļé┤ņä▒ļźĀņØ┤ 20% ļ»Ėļ¦īņØĖ ņ¦ĆņŚŁņŚÉņä£ļŖö 1ņ░© ņĀ£ĻĘĀņÜöļ▓Ģņ£╝ļĪ£ Ēæ£ņżĆ 3ņĀ£ņÜöļ▓Ģ 7ņØ╝ ļśÉļŖö 14ņØ╝, ņł£ņ░©ņĀü ņÜöļ▓Ģ 10ņØ╝(ņ┤łļ░ś 5ņØ╝ ļÅÖņĢł PPI+amoxicillin, Ēøäļ░ś 5ņØ╝ ļÅÖņĢł PPI+clarithromycin+metronidazole)ņØä ņäĀĒāØĒĢśĻ│Ā, clarithromycin ĒĢŁņāØņĀ£ ļé┤ņä▒ļźĀņØ┤ 20% ņØ┤ņāüņØĖ ņ¦ĆņŚŁņŚÉņä£ļŖö bismuth 4ņĀ£ņÜöļ▓Ģ(bismuth+PPI+amoxicillin+metronidazole) 14ņØ╝ņØä ņäĀĒāØĒĢ£ļŗż[4]. ņÜ░ļ”¼ļéśļØ╝ H. pyloriĻĘĀ clarithromycin ļé┤ņä▒ļźĀņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ 2005~2009ļģäņŚÉļŖö 18.2%ņśĆĻ│Ā[13], ņä▒ņØĖņŚÉņä£ļŖö 2009~2013ļģäņŚÉ 37.0% [14], 2018ļģäņŚÉ 29%ņśĆļŗż[7]. 2010ļģä ņØ┤Ēøä ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ ļČäļ”¼ļÉ£ H. pyloriĻĘĀņØś ĒĢŁņāØņĀ£ ļé┤ņä▒ ņŚ░ĻĄ¼ļŖö ņŚåņ£╝ļéś 2004~2011ļģä ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ Ēæ£ņżĆ 3ņĀ£ņÜöļ▓Ģ 14ņØ╝Ļ│╝ bismuth 4ņĀ£ņÜöļ▓Ģ 7ņØ╝ ņ╣śļŻīņØś ļ╣äĻĄÉ ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ĻĘĀņ£©ņØ┤ Ļ░üĻ░ü 67.7%ņÖĆ 83.9%ļĪ£, clarithromycinņØ┤ ĒżĒĢ©ļÉ£ Ēæ£ņżĆ 3ņĀ£ņÜöļ▓ĢņØś ņĀ£ĻĘĀņ£©ņØ┤ ļé«ņĢśĻ│Ā[15], ļīĆĒĢ£ņåīņĢäņåīĒÖöĻĖ░ņśüņ¢æĒĢÖĒÜī ĒÜīņøÉ ļīĆņāü ņäżļ¼ĖņĪ░ņé¼ņŚÉņä£ Ēæ£ņżĆ 3ņĀ£ņÜöļ▓ĢņØä 1ņ░© ņĀ£ĻĘĀ ņ╣śļŻīļĪ£ Ļ░Ćņן ļ¦ÄņØ┤ ņäĀĒāØĒĢśņśĆĻ│Ā ņ╣śļŻī ņŗżĒī© Ļ▓ĮĒŚśņØ┤ 85.7%ļĪ£ ļåÆņĢä[5] ņÜ░ļ”¼ļéśļØ╝ ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ clarithromycin ĒĢŁņāØņĀ£ ļé┤ņä▒ļźĀņØĆ 20%ļ│┤ļŗż ļåÆņØä Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. 2017ļģä ĻĄŁļé┤ ņåīņĢäņ▓Łņåīļģä H. pylori ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņóģņäżņŚÉņä£ ņÜ░ļ”¼ļéśļØ╝ ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ clarithromycin ļé┤ņä▒ļźĀņØ┤ 18.2~25.0%ļĪ£ ņ¦ĆņŚŁļ¦łļŗż ņ░©ņØ┤Ļ░Ć ņ׳ņ£╝ļ»ĆļĪ£, ĒĢŁņāØņĀ£ ļé┤ņä▒ Ļ▓░Ļ│╝ļź╝ ļ│┤Ļ│Ā ņ╣śļŻīļź╝ Ļ▓░ņĀĢĒĢ┤ņĢ╝ ĒĢ£ļŗżĻ│Ā ņĀĢļ”¼ĒĢśņśĆļŗż[16]. ņżæĻĄŁņŚÉņä£ 6~18ņäĖ ņåīņĢä 228ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ Ēæ£ņżĆ 3ņĀ£ņÜöļ▓Ģ, ņł£ņ░©ņĀü ņÜöļ▓Ģ, bismuth 4ņĀ£ņÜöļ▓Ģ, ļÅÖņŗ£ ņ╣śļŻīņÜöļ▓Ģ(concomitant therapy, PPI+amoxicillin+metronidazole+clarithromycin 14ņØ╝)ņØä ņĀäĒ¢źņĀüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝, ņĀ£ĻĘĀņ£©ņØ┤ 74.1%, 69.5%, 89.9%, 84.6%ļĪ£ bismuth 4ņĀ£ņÜöļ▓ĢņØ┤ 89.9%ļĪ£ Ļ░Ćņן ļåÆņĢśļŗż[17]. ĻĘĖļ¤¼ļ»ĆļĪ£ ņåīņĢäņ▓Łņåīļģä H. pylori Ļ░ÉņŚ╝ņŚÉ ļīĆĒĢ£ Ļ▓ĮĒŚśņĀü ņĀ£ĻĘĀ ņ╣śļŻīņŚÉņä£ bismuth 4ņĀ£ņÜöļ▓ĢņØś ņĀ£ĻĘĀņ£©ņØ┤ 80% ņØ┤ņāüņ£╝ļĪ£ ļŗżļźĖ ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļ╣äĒĢ┤ ļåÆņĢä ņÜ░ņäĀņĀüņ£╝ļĪ£ ņäĀĒāØĒĢĀ ņłś ņ׳ļŗż. ĻĘĖ ļŗżņØīņ£╝ļĪ£ Ēæ£ņżĆ 3ņĀ£ņÜöļ▓Ģ 14ņØ╝, ņł£ņ░©ņĀü ņÜöļ▓ĢņØä ņäĀĒāØĒĢĀ ņłś ņ׳ļŗż(Table 1) [18].
ņä▒ņØĖ ņ×äņāüņ¦Ćņ╣©ņŚÉņä£ ņĀ£ņŗ£ĒĢ£ bismuth 4ņĀ£ņÜöļ▓ĢņŚÉ ĒżĒĢ©ļÉ£ ĒĢŁņāØņĀ£ļŖö tetracyclineĻ│╝ metronidazoleņØ┤ļŗż[7]. TetracyclineņØĆ 8ņäĖ ļ»Ėļ¦īņØś ņåīņĢäņŚÉņä£ Ēł¼ņĢĮĒĢśļ®┤ ļ╝łņÖĆ ņ╣śņĢäņŚÉ ņśüĻĄ¼ņĀü ņāēņåī ņ╣©ņ░®, ļ▓Ģļ×æņ¦ł ĒśĢņä▒ ņØ┤ņāü, ļ╝ł ņä▒ņןļźĀ Ļ░ÉņåīņÖĆ Ļ░ÖņØĆ ņŗ¼Ļ░üĒĢ£ ļČĆņ×æņÜ®ņØ┤ ņāØĻĖ░ļ»ĆļĪ£ ņé¼ņÜ®ĒĢĀ ņłś ņŚåļŗż. ļśÉĒĢ£ ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ļŖö 12ņäĖ ņØ┤ņāüņØś ņåīņĢäņŚÉņä£ Ēł¼ņŚ¼ļź╝ ĻČīņןĒĢśļ»ĆļĪ£, 12ņäĖ ļ»Ėļ¦īņØś ņåīņĢäņŚÉņä£ļŖö tetracyclineņØ┤ ņĢäļŗī, amoxicillinņØä ņ▓śļ░®ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ĒÄśļŗłņŗżļ”░ņĀ£ņĀ£ņŚÉ ņĢīļĀłļź┤ĻĖ░Ļ░Ć ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉļŖö amoxicillinņØä Ēł¼ņŚ¼ĒĢĀ ņłś ņŚåņ£╝ļ»ĆļĪ£, metronidazoleĻ│╝ clarithromycin ņĪ░ĒĢ®ņ£╝ļĪ£ ņé¼ņÜ®ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņĀ£ĻĘĀ ņÜöļ▓ĢņØä ņäĀĒāØĒĢśņśĆļŗżļ®┤, ņåīņĢäņ▓ŁņåīļģäņØś ļéśņØ┤ņÖĆ ļ¬Ėļ¼┤Ļ▓īļź╝ Ļ│ĀļĀżĒĢśņŚ¼ ņĢĮļ¼╝ ņÜ®ļ¤ēņØä Ļ▓░ņĀĢĒĢ£ļŗż(Table 2) [18].
ņĀ£ĻĘĀ ņ╣śļŻī ĒÜ©Ļ│╝ņØś ĒīÉņĀĢņØĆ ņ╣śļŻī ņóģĻ▓░ Ēøä 8ņŻ╝ ņØ┤ĒøäņŚÉ ļ╣äņ╣©ņŖĄņĀü ļ░®ļ▓ĢņØĖ 13C-UBTļź╝ ņŻ╝ļĪ£ ņŗ£Ē¢ēĒĢśļ®░, 13C-UBT Ļ▓Ćņé¼ļź╝ ĒĢĀ ņłś ņŚåļŖö Ļ▓ĮņÜ░ņŚÉļŖö ļīĆļ│Ć H. pylori ĒĢŁņøÉ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśĻĖ░ļÅä ĒĢ£ļŗż[4]. ļīĆļ│Ć H. pylori ĒĢŁņøÉ Ļ▓Ćņé¼ļ▓ĢņØĆ ļ»╝Ļ░ÉļÅäņÖĆ ĒŖ╣ņØ┤ļÅäĻ░Ć Ēæ£ņżĆ ņ¦äļŗ© Ļ▓Ćņé¼ļ▓ĢņØĖ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ 88~97%, 93~97%ļĪ£ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśļŖö Ļ││ļ¦łļŗż ļŗżļź┤Ļ│Ā, ļ¼┤ļźĖ ļ│ĆņØ┤ļéś ņäżņé¼ļ│ĆņØĖ Ļ▓ĮņÜ░ Ļ░Ćņ¦£ ņØīņä▒ņØś Ļ░ĆļŖźņä▒ņØ┤ ļåÆņØĆ ļŗ©ņĀÉņØ┤ ņ׳ņ£╝ļéś, ļ╣äņÜ®ņØ┤ ņĀüĻ▓ī ļōżĻ│Ā ņŗ£Ē¢ēņØ┤ Ļ░äĒÄĖĒĢśļ®░ 13C-UBTļź╝ ņłśĒ¢ēĒĢĀ ņłś ņŚåļŖö 6ņäĖ ļ»Ėļ¦īņŚÉņä£ļÅä ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ļŖö ņןņĀÉņØ┤ ņ׳ļŗż[2,19]. ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ņŗżĒī©ĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ĒĢŁņāØņĀ£ ļé┤ņä▒ Ļ▓Ćņé¼ļź╝ ļ░śļō£ņŗ£ ņŗ£Ē¢ēĒĢśĻ│Ā, ĻĘĖ Ļ▓░Ļ│╝ņŚÉ ļö░ļØ╝ 2ņ░© ņĀ£ĻĘĀ ņ╣śļŻīļź╝ Ļ▓░ņĀĢĒĢ£ļŗż.
ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ļ░øņØĆ ņĀüņØ┤ ņ׳ļŖö ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ 2ņ░© ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ņ£äĒĢ£ ĒĢŁņāØņĀ£ ļé┤ņä▒ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņØ┤ņŖżļØ╝ņŚśĻ│╝ ņżæĻĄŁņŚÉņä£ ņ׳ņŚłļŗż[20,21]. ņØ┤ņŖżļØ╝ņŚś ņåīņĢäņ▓Łņåīļģä 28ļ¬ģņŚÉņä£ H. pyloriĻĘĀņØś 2ņ░© ĒĢŁņāØņĀ£ ļé┤ņä▒ļźĀņØĆ clarithromycin 29%, metronidazole 61%ļĪ£, 1ņ░© ĒĢŁņāØņĀ£ ļé┤ņä▒ļźĀņØĖ 9.5%ņÖĆ 32.6%ņŚÉ ļ╣äĒĢ┤ 2ļ░░ ņØ┤ņāü ņ”ØĻ░ĆĒĢśņśĆļŗż[20]. ņżæĻĄŁ ņåīņĢäņ▓Łņåīļģä 34ļ¬ģņŚÉņä£ ļČäļ”¼ļÉ£ H. pylori ĒĢŁņāØņĀ£ ļé┤ņä▒ Ļ▓Ćņé¼ņŚÉņä£ļÅä clarithromycin 70.6%, metronidazole 67.6%, levofloxacin 23.5%, rifampicin 23.5%ļĪ£ ļåÆņĢśņ£╝ļéś amoxicillinĻ│╝ tetracyclineņØś ĒĢŁņāØņĀ£ ļé┤ņä▒ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢä, bismuth 4ņĀ£ņÜöļ▓ĢņØä ĻČīņןĒĢśņśĆļŗż[21]. ņØ┤ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļōżņØĆ ĒĢŁņāØņĀ£ ļé┤ņä▒ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ļéś 1ņ░© ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ņŗżĒī©ĒĢ£ Ļ▓ĮņÜ░ bismuth 4ņĀ£ņÜöļ▓ĢņØä ņÜ░ņäĀņĀüņ£╝ļĪ£ Ļ│ĀļĀżĒĢĀ ņłś ņ׳ņØīņØä ļ│┤ņŚ¼ņżĆļŗż.
ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ ņĀ£ĻĘĀņÜöļ▓ĢņØä ņäĀĒāØĒĢĀ ļĢīņŚÉļŖö ĒĢŁņāØņĀ£ ļé┤ņä▒, ļéśņØ┤, ļ¬Ėļ¼┤Ļ▓ī, ņĢīļĀłļź┤ĻĖ░ ņŚ¼ļČĆļéś ĻĖ░ņĀĆ ņ¦łĒÖś ņÖĖņŚÉļÅä Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢĀ ņĀÉļōżņØ┤ ņ׳ļŗż. ņ×¼Ļ░ÉņŚ╝ļźĀ, ņĢĮļ¼╝ ļČĆņ×æņÜ®Ļ│╝ ĒÖśņ×ÉņÖĆ ļČĆļ¬©ņØś ņĢĮļ¼╝ ļ│ĄņÜ® ņł£ņØæļÅä(drug compliance or adherence)ņØ┤ļŗż. ņåīņĢäņ▓ŁņåīļģäņØĆ ļ│ĖņØĖņØ┤ ņĢĮņØä ņ▒ÖĻ▓© ļ│ĄņÜ®ĒĢśļŖö Ļ▓ĮņÜ░ļ│┤ļŗż ļČĆļ¬©Ļ░Ć ņ▒ÖĻ▓©ņä£ ļ│ĄņÜ®ĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äņ£╝ļ»ĆļĪ£ ņĢĮļ¼╝ ļ│ĄņÜ® ņł£ņØæļÅäĻ░Ć ņĀ£ĻĘĀņ£©ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņżæņÜöĒĢ£ ņØĖņ×ÉņØ┤ļŗż.
2017ļģäļČĆĒä░ 2019ļģäĻ╣īņ¦Ć 3ļģäĻ░ä ņØ╝ļ│Ė Ļ│Āļō▒ĒĢÖĻĄÉ 3ĒĢÖļģä 390ļ¬ģņŚÉĻ▓ī ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśļ®┤ņä£, ļ│ĆņØś ĒܤņłśņÖĆ ņ¢æņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢśļÅäļĪØ ĒĢśņśĆļŗż[22]. ņØ┤ ņżæ 274ļ¬ģņØ┤ ņČöņĀüņØ┤ Ļ░ĆļŖźĒĢśņśĆņ£╝ļ®░, ļ│ĄĒåĄņØ┤ 28.5%, ņäżņé¼Ļ░Ć 42.7%ņŚÉņä£ ņ׳ņŚłĻ│Ā ņĀäļ░śņĀüņØĖ ņ£äĒĢ┤ ļ░śņØæ(adverse effects)ņØĆ 2.9% (8ļ¬ģ)ļĪ£ ļé«ņĢśļŗż[22]. ļ│ĄĒåĄĻ│╝ ņäżņé¼ņØś ļ╣łļÅäļŖö 1ņ░© ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ņŗżĒī©ĒĢ£ ĒĢÖņāØņŚÉņä£ ļŹö ļ¦ÄņØ┤ ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā, ļČĆņ×æņÜ®ņØ┤ ņ׳ņ£╝ļ®┤ ņĢĮļ¼╝ ļ│ĄņÜ®ņØä ņל ĒĢśņ¦Ć ņĢŖņØä ņłś ņ׳ņØīņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż[22].
ņØ╝ļ│ĖņŚÉņä£ļŖö 2004ļģäļČĆĒä░ ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ H. pylori ņĀ£ĻĘĀņÜöļ▓ĢņŚÉ metronidazole Ēł¼ņŚ¼ļź╝ ĒŚłĻ░ĆĒĢśĻ│Ā, ņĀ£ĻĘĀņÜöļ▓ĢņŚÉ ļö░ļźĖ ļČĆņ×æņÜ®ņØä ņĪ░ņé¼ĒĢśņśĆļŗż. ĻĄ¼ĒåĀ, ņśżņŗ¼, ņäżņé¼, ļ│Ćļ╣ä, ņåŹņō░ļ”╝, ņ£äĻ▓ĮļĀ©, ņ×ģļ¦ø Ļ░Éņåī, ļæÉĒåĄ, ņ×ģļ¦łļ”ä, ĻĖłņåŹļ¦ø, ĒśĆņÖĆ ņ×ģņØś ņØ┤ņāüĻ░ÉĻ░ü, ĒśĆņØś ņ×ÉĻĘ╣ ļō▒ņØś ļČĆņ×æņÜ®ņØ┤ ņ׳ņŚłņ£╝ļéś ņØ┤ļŖö clarithromycinĻ│╝ amoxicillinņØä Ēł¼ņŚ¼ĒĢ£ ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ļÅä Ļ┤Ćņ░░ļÉśļŖö ņØ┤ņāü ļ░śņØæņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆĻ│Ā, ņä▒ņØĖņŚÉņä£ ļ│┤Ļ│ĀļÉ£ metronidazole Ļ┤ĆļĀ© ļćīņ”Ø(encephalopathy)ņØ┤ļéś ņŗĀĻ▓ĮļÅģņä▒(neurotoxicity)ņØĆ ņŚåņŚłļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[23]. ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ņ▓śļ░®ĒĢśĻĖ░ ņĀäņŚÉ ĒĢŁņāØņĀ£ļź╝ ĒżĒĢ©ĒĢśņŚ¼ PPIņÖĆ bismuth ļō▒ ņĢĮņĀ£ ļČĆņ×æņÜ®ņØä ņĀĢĒÖĢĒĢśĻ▓ī ņĢīĻ│Ā, ĒÖśņ×ÉņÖĆ ļ│┤ĒśĖņ×ÉņŚÉĻ▓ī ļČĆņ×æņÜ®Ļ│╝ ļČĆņ×æņÜ®ņŚÉ ļīĆĒĢ£ ļīĆņ▓ś ļō▒ņØä ņäżļ¬ģĒĢ£ Ēøä ņØ┤ĒĢ┤ ņĀĢļÅäļź╝ ĒīīņĢģĒĢśĻ│Ā ņĢĮņĀ£ Ēł¼ņŚ¼ļź╝ Ļ▓░ņĀĢĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ņżæĻĄŁņŚÉņä£ 63ļ¬ģ ņåīņĢäņ▓Łņåīļģä(Ēæ£ņżĆ 3ņĀ£ņÜöļ▓Ģ 16ļ¬ģ, ņł£ņ░©ņĀü ņÜöļ▓Ģ 15ļ¬ģ, bismuth 4ņĀ£ņÜöļ▓Ģ 16ļ¬ģ, ļÅÖņŗ£ ņ╣śļŻīņÜöļ▓Ģ 16ļ¬ģ)ņŚÉņä£ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśļ®┤ņä£ ļīĆļ│ĆņØä 0, 2, 6, 52ņŻ╝ņŚÉ ļ¬©ņĢäņä£ ņןļé┤ ņäĖĻĘĀņ┤ØņØś ļ│ĆĒÖöļź╝ ĒÖĢņØĖĒĢ£ Ļ▓░Ļ│╝, ņ╣śļŻī 2ņŻ╝ņ¦Ė ņĀĢņāü ņäĖĻĘĀņ┤ØņØ┤ ļ¦ÄņØ┤ Ļ░ÉņåīĒĢśĻ│Ā, 6ņŻ╝ņ¦ĖĻ╣īņ¦Ć ļ│ĆĒÖöĻ░Ć ņ¦ĆņåŹļÉśņ¦Ćļ¦ī 52ņŻ╝ņ¦Ė ļ¬©ņØĆ ļīĆļ│ĆņŚÉņä£ļŖö ņøÉļלņØś ņןļé┤ ņäĖĻĘĀņ┤Ø ņāüĒā£ļĪ£ ļÅīņĢäņÖĆņä£, ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ņØśĒĢ£ ņןļé┤ ņäĖĻĘĀņ┤Ø ļ│ĆĒÖöļŖö 1ļģäņØ┤ ņ¦Ćļéśļ®┤ ņĀĢņāüņ£╝ļĪ£ ļÅīņĢäņś©ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[24].
ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ņØśĒĢ£ ņĀĢņāü ņäĖĻĘĀņ┤Ø ļ│ĆĒÖöļź╝ Ļ░Éņåīņŗ£ĒéżĻ│Ā, ņĀ£ĻĘĀ ņ╣śļŻīņØś ĒÜ©Ļ│╝ļź╝ ņ”ØļīĆņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ ņĀĢņןņĀ£(probiotics)Ļ░Ć ĒÜ©Ļ│╝Ļ░Ć ņ׳ļŗżļŖö ņŚ░ĻĄ¼ļōżņŚÉ ļīĆĒĢ£ ļ®öĒŗ░ļČäņäØņŚÉņä£, lactobacillusĻ░Ć Ēæ£ņżĆ 3ņĀ£ņÜöļ▓ĢņØś ņĀ£ĻĘĀņ£©ņØä ļåÆņØ┤Ļ│Ā, ņĀ£ĻĘĀņÜöļ▓ĢņØś ņĢĮņĀ£ ņŚ░Ļ┤Ć ņäżņé¼ļź╝ 13%ļĪ£ Ļ░Éņåīņŗ£ņ╝░ņ£╝ļéś, Ļ│ĀņÜ®ļ¤ē(Ōēź5├Ś109 colony forming unit [CFU]/day)ņ£╝ļĪ£ 4ņŻ╝ ņØ┤ņāü Ēł¼ņŚ¼ĒĢśņśĆņØä ļĢīņŚÉļ¦ī ĒÜ©Ļ│╝Ļ░Ć ņ׳Ļ│Ā, ņĀĆņÜ®ļ¤ē(<5├Ś109 CFU/day)ņØä 2ņŻ╝ ņØ┤ļé┤ļĪ£ ļ│ĄņÜ® ņŗ£ņŚÉļŖö ĒÜ©Ļ│╝Ļ░Ć ņŚåņŚłļŗżĻ│Ā ņĀĢļ”¼ĒĢśņśĆļŗż[25]. ņĀĢņןņĀ£ļź╝ ĒĢ©Ļ╗ś Ēł¼ņŚ¼ĒĢśļŖö Ļ▓āņØ┤ ņĢĮņĀ£ Ļ┤ĆļĀ© ļČĆņ×æņÜ®ņØĖ ņןļé┤ ņäĖĻĘĀņ┤Ø ļ│ĆĒÖöņÖĆ ņäżņé¼ļź╝ Ļ░Éņåīņŗ£ĒéżĻ│Ā, ņĀ£ĻĘĀņ£©ņØä ņ”ØĻ░Ćņŗ£Ēé¼ ņłś ņ׳ļŖö ņ¦ĆņŚÉ ļīĆĒĢ┤ņä£ļŖö ļŗżņ¢æĒĢ£ ņĀĢņןņĀ£ņÖĆ ļŗżļźĖ ņÜ®ļ¤ēĻ│╝ Ēł¼ņŚ¼ ĻĖ░Ļ░äņ£╝ļĪ£ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
2018ļģäļČĆĒä░ 2019ļģäĻ╣īņ¦Ć 230ļ¬ģņØś ņżæĻĄŁ ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ ņĀ£ĻĘĀ ņ╣śļŻī Ēøä ņĀäĒ¢źņĀüņ£╝ļĪ£ ņ×¼Ļ░ÉņŚ╝ņØś ņ£äĒŚśņØĖņ×Éļź╝ ņĪ░ņé¼ĒĢ£ ņé¼ļĪĆļīĆņĪ░ ņŚ░ĻĄ¼ņŚÉņä£, 218ļ¬ģņØ┤ ņČöņĀü Ļ┤Ćņ░░ņØ┤ Ļ░ĆļŖźĒĢśņśĆĻ│Ā, ņØ┤ ņżæ 41ļ¬ģ(18.8%)ņŚÉņä£ ņ×¼Ļ░ÉņŚ╝ņØ┤ ņāØĻ▓╝ļŗż. ņ×¼Ļ░ÉņŚ╝Ļ│╝ Ļ┤ĆļĀ©ļÉ£ ņØĖņ×ÉļĪ£ļŖö ļéśņØ┤Ļ░Ć 10ņäĖ ļ»Ėļ¦ī(22.8%)ņØĖ Ļ▓ĮņÜ░ļĪ£ 10ņäĖ ņØ┤ņāü(7.1%)ņŚÉ ļ╣äĒĢ┤ ļåÆņĢśĻ│Ā, Ļ░ĆņĪ▒ļé┤ Ļ░ÉņŚ╝ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņśĆņ£╝ļ®░, ņĀ£ĻĘĀ ņ╣śļŻīņÜöļ▓ĢņØ┤ļéś ĒĢŁņāØņĀ£ ļé┤ņä▒Ļ│╝ļŖö Ļ┤ĆļĀ©ņØ┤ ņŚåņŚłļŗż[26]. ņ×¼Ļ░ÉņŚ╝ņØś ņśłļ░®ņØĖņ×ÉļĪ£ļŖö ļÅäņŗ£ņŚÉ ņé┤Ļ│Ā, Ļ▓ĮņĀ£ņĀüņ£╝ļĪ£ ņל ņé┤Ļ│Ā, ņ¦æņŚÉņä£ ņĀÉņŗ¼ņŗØņé¼ļź╝ ĒĢśļŖö Ļ▓ĮņÜ░ņśĆļŗż[26]. ņØ╝ļ│ĖņŚÉņä£ļŖö 5ņäĖ ņØ┤ņāüņŚÉņä£ H. pylori Ļ░ÉņŚ╝Ļ│╝ ĒĢ©Ļ╗ś ņĀ£ĻĘĀ ņ╣śļŻīņØś ņĀüņØæņ”ØņØ┤ ļÉśļ®┤ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ Ļ│ĀļĀżĒĢ£ļŗżļŖö ņ×äņāüņ¦Ćņ╣©ņØä ļ¦łļĀ©ĒĢśņŚ¼[9], ņżæĻĄŁņŚÉņä£ ņ×¼Ļ░ÉņŚ╝ Ļ┤ĆļĀ© ņØĖņ×ÉļĪ£ ļé┤ņäĖņÜ┤ 10ņäĖņÖĆļŖö ļéśņØ┤ ņ░©ņØ┤Ļ░Ć ņ׳ņŚłļŗż[26]. ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ļÅä ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ ņĀ£ĻĘĀ ņ╣śļŻī Ēøä ņןĻĖ░ņĀüņØĖ ņČöņĀü Ļ┤Ćņ░░ļĪ£ ļéśņØ┤ņŚÉ ļö░ļźĖ ņ×¼Ļ░ÉņŚ╝ ļ╣łļÅä, ņ×¼Ļ░ÉņŚ╝ņØś ņ£äĒŚśņØĖņ×É ļō▒Ļ│╝ ņ×¼Ļ░ÉņŚ╝ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
ņåīņĢäņ▓ŁņåīļģäņØĆ ņä▒ņØĖĻ│╝ ļŗ¼ļ”¼ ļ│ĖņØĖņØ┤ ņŖżņŖżļĪ£ ļ│ĄņÜ®ĒĢśļŖö Ļ▓ĮņÜ░ļ│┤ļŗżļŖö ļČĆļ¬©Ļ░Ć ņĢĮņØä ņ▒ÖĻ▓©ņŻ╝ļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äņ£╝ļ®░, ņåīņĢäņ▓Łņåīļģä ĒÖśņ×ÉņÖĆ ļČĆļ¬©ņŚÉĻ▓ī ņĢĮļ¼╝ ņ▓śļ░®ņØś ņØ┤ņ£Ā, ļ│ĄņÜ®ļ▓Ģ, Ēł¼ņŚ¼ ĻĖ░Ļ░ä, ņĢĮņĀ£ ļČĆņ×æņÜ® ļō▒ņŚÉ ļīĆĒĢ£ ĻĄÉņ£ĪņØä ņŗ£Ē¢ēĒĢ£ Ēøä ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśļŖö Ļ▓āņØĆ ņżæņÜöĒĢśļŗż. ļ▓©ĻĖ░ņŚÉņŚÉņä£ 2~17ņäĖ ņåīņĢäņ▓Łņåīļģä 145ļ¬ģņŚÉĻ▓ī ĒĢŁņāØņĀ£ ļé┤ņä▒ Ļ▓░Ļ│╝ņŚÉ ļ¦×ņČöņ¢┤ Ēæ£ņżĆ 3ņĀ£ņÜöļ▓Ģ, ņł£ņ░©ņĀü ņÜöļ▓Ģ ļō▒ņØä ņ▓śļ░®ĒĢśļ®┤ņä£ ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ĻĄÉņ£ĪņØä ĒĢ©Ļ╗ś ņŗ£Ē¢ēĒĢśņśĆļŗż. ņØ┤ ņżæ 130ļ¬ģņØ┤ ņČöņĀü Ļ┤Ćņ░░ Ļ░ĆļŖźĒĢśņśĆņ£╝ļ®░, ņ▓śļ░®ļÉ£ ņĢĮņØś 90% ņØ┤ņāüņØä ļ│ĄņÜ®ĒĢ£ 109ļ¬ģņØś ņĀ£ĻĘĀņ£©ņØĆ 89.9%ļĪ£ ļåÆņĢśĻ│Ā, ņĢĮņØä ņĀ£ļīĆļĪ£ ļ│ĄņÜ®ĒĢśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ ņĀ£ĻĘĀņ£©ņØ┤ 36.6%ļĪ£ ļé«ņĢśļŗż[27]. ĻĘĖļ¤¼ļ»ĆļĪ£ ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ ņĀ£ĻĘĀņÜöļ▓ĢņØä ņŗ£Ē¢ēĒĢĀ ļĢī, ĒŖ╣Ē׳ ņé¼ņČśĻĖ░ ņ▓ŁņåīļģäņŚÉņä£ļŖö ņĀ£ĻĘĀņÜöļ▓ĢņØś ņØ┤ņ£Ā, ņĢĮļ¼╝ ļ│ĄņÜ®ļ▓Ģ, Ēł¼ņŚ¼ ĻĖ░Ļ░ä, ļČĆņ×æņÜ®, ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ┤ ĒÖśņ×É ļ│ĖņØĖņŚÉĻ▓ī ņ×ÉņäĖĒĢ£ ņäżļ¬ģĻ│╝ ĻĄÉņ£ĪņØä ĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļŗż.
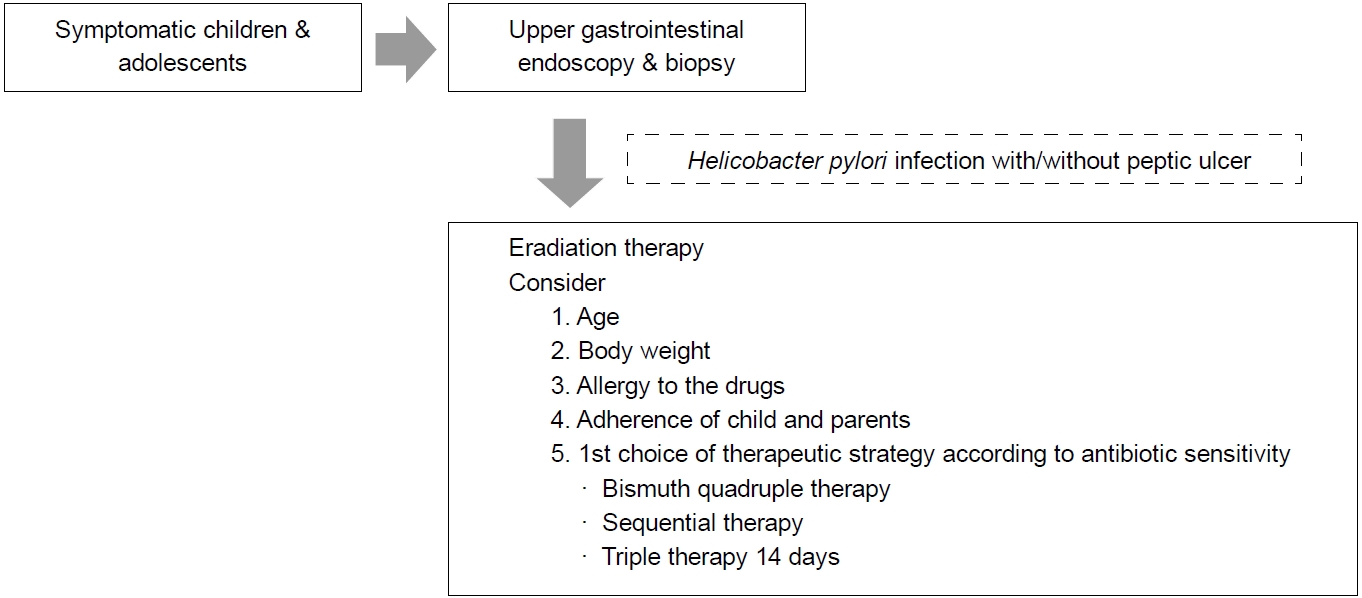
ņ”ØņāüņØ┤ ņ׳ļŖö ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ H. pylori Ļ░ÉņŚ╝ņØ┤ ļé┤ņŗ£Ļ▓ĮņĀüņ£╝ļĪ£ ņ¦äļŗ©ļÉśļ®┤, Ļ░ĆļŖźĒĢ£ ĒĢŁņāØņĀ£ ļé┤ņä▒ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśĻ│Ā Ļ▓░Ļ│╝ņŚÉ ļö░ļźĖ ņĀ£ĻĘĀņÜöļ▓ĢņØä ņäĀĒāØĒĢ┤ņĢ╝ ĒĢ£ļŗż. ClarithromycinņŚÉ ļīĆĒĢ£ ĒĢŁņāØņĀ£ ļé┤ņä▒ņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ņŚÉļ¦ī Ēæ£ņżĆ 3ņĀ£ņÜöļ▓Ģ 7ņØ╝ņØä ņäĀĒāØĒĢĀ ņłś ņ׳ņ£╝ļ®░, ĒĢŁņāØņĀ£ ļé┤ņä▒ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņ¦Ć ļ¬╗ĒĢśļŖö Ļ▓ĮņÜ░ņŚÉļŖö bismuth 4ņĀ£ņÜöļ▓Ģ(12ņäĖ ļ»Ėļ¦īņŚÉļŖö tetracycline ļīĆņŗĀ amoxicillin), ņł£ņ░©ņĀü ņÜöļ▓Ģ ļśÉļŖö Ēæ£ņżĆ 3ņĀ£ņÜöļ▓Ģ 14ņØ╝ņØä 1ņ░© ņĀ£ĻĘĀņÜöļ▓Ģņ£╝ļĪ£ ņäĀĒāØĒĢĀ ņłś ņ׳ļŗż(Fig. 1). ņåīņĢäņ▓Łņåīļģä ņĀ£ĻĘĀ ņ╣śļŻīņŚÉņä£ļŖö ĒÖśņ×É ļ│ĖņØĖĻ│╝ ļ│┤ĒśĖņ×ÉņŚÉĻ▓ī ņĀ£ĻĘĀ ņ╣śļŻīņØś ņØ┤ņ£Ā, ņĀ£ĻĘĀ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ņäżļ¬ģĒĢśĻ│Ā ņŗ£Ē¢ēĒĢśļ®┤ ņł£ņØæļÅäļź╝ ņ”ØĻ░Ćņŗ£Ēé¼ ņłś ņ׳ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ņ”ØņāüņØ┤ ņ׳ņ¢┤ ļé┤ņŗ£Ļ▓ĮņØä ņŗ£Ē¢ēĒĢ£ ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ H. pylori Ļ░ÉņŚ╝ņØ┤ ĒÖĢņØĖļÉśļ®┤ ņ╣śļŻīļź╝ Ļ│ĀļĀżĒĢĀ ņłś ņ׳ņ£╝ļ®░, 10ņäĖ ļ»Ėļ¦īņØś ņåīņĢäņ▓ŁņåīļģäņŚÉņä£ļŖö H. pylori ņĀ£ĻĘĀ ņ╣śļŻī Ēøä ņ×¼Ļ░ÉņŚ╝ņØś Ļ░ĆļŖźņä▒Ļ│╝ ĒĢŁņāØņĀ£ ļé┤ņä▒ņŚÉ ļīĆĒĢ┤ ĒÖśņ×ÉņÖĆ ļ│┤ĒśĖņ×É(ļČĆļ¬©)ņŚÉĻ▓ī ņČ®ļČäĒ׳ ņäżļ¬ģĒĢśĻ│Ā, ļģ╝ņØśĒĢ£ ĒøäņŚÉ Ļ▓░ņĀĢĒĢ┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż.
Fig.┬Ā1.
Factors to consider when deciding Helicobacter pylori eradication therapy in children and adolescents.
Table┬Ā1.
Recommended Eradication Therapy Regimens for Children with Helicobacter pylori Infection [18]
| Helicobacter pylori antimicrobial susceptibility | Known | Unknown |
|---|---|---|
| Susceptible to CLA | PPI+AMO+CLA 14 days or | PPI+ high dose AMO+MET 14 days or |
| PPI+AMO 5 days ŌåÆPPI+CLA+MET 5 daysa | BIS+PPI+AMO (TET)+MET 14 days or | |
| Resistant to CLA | BIS+PPI+AMO (TET)+MET 14 days | PPI+AMO+MET+CLA 14 daysb |
Table┬Ā2.
Recommended Dosage of Anti-Helicobacter pylori Chemotherapeutic Agents According to Body Weight or Age of Children [18]
| Body weight | 15~24 kg | 25~34 kg | 35 kg | >40 kg |
|---|---|---|---|---|
| Amoxicillin | 500 mg bid | 750 mg bid | 1,000 mg bid | |
| Clarithromycin | 250 mg bid | 500 mg bid | 500 mg bid | |
| Metronidazole | 250 mg bid | 500 mg bid | 500 mg bid | |
| Tetracyclinea | NA | NA | NA | 500 mg qid |
| Proton pump inhibitor | 20 mg bid | 30 mg bid | 40 mg bid | |
| Bismuth subsalicylate | 150 mg qidb | 150 mg qidb | 150 mg qidb | |
| 300 mg qidc |
REFERENCES
1. Miyamoto R, Okuda M, Lin Y, Murotani K, Okumura A, Kikuchi S. Rapidly decreasing prevalence of Helicobacter pylori among Japanese children and adolescents. J Infect Chemother 2019;25:526ŌĆō530.


2. Seo JH, Park JS, Rhee KH, Youn HS. Diagnosis of Helicobacter pylori infection in children and adolescents in Korea. Pediatr Gastroenterol Hepatol Nutr 2018;21:219ŌĆō233.



3. Tang MYL, Chung PHY, Chan HY, Tam PKH, Wong KK. Recent trends in the prevalence of Helicobacter pylori in symptomatic children: a 12-year retrospective study in a tertiary centre. J Pediatr Surg 2019;54:255ŌĆō257.


4. Jones NL, Koletzko S, Goodman K, et al. Joint ESPGHAN/NASPGHAN guidelines for the management of Helicobacter pylori in children and adolescents (update 2016). J Pediatr Gastroenterol Nutr 2017;64:991ŌĆō1003.


5. Youn JH, Kim SJ, Seo JH, et al. National survey assessing treatment of Helicobacter pylori infection in Korean children: a pilot study. Korean J Helicobacter Up Gastrointest Res 2017;17:195ŌĆō199.


6. Kaji E, Yoden A, Otani M, et al. Helicobacter pylori test-and-treat strategy for second-year junior high school students aimed at the prevention of gastric cancer in Takatsuki City. Helicobacter 2020;25:e12696.



7. Jung HK, Kang SJ, Lee YC, et al. Evidence-based guidelines for the treatment of Helicobacter pylori infection in Korea: 2020 revised edition. Korean J Helicobacter Up Gastrointest Res 2020;20:261ŌĆō287.


8. Lee JH, Ahn JY, Choi KD, et al. Nationwide antibiotic resistance mapping of Helicobacter pylori in Korea: a prospective multicenter study. Helicobacter 2019;24:e12592.


9. Kato S, Shimizu T, Toyoda S, et al. The updated JSPGHAN guidelines for the management of Helicobacter pylori infection in childhood. Pediatr Int 2020;62:1315ŌĆō1331.



10. Park JS, Jun JS, Ryu EY, et al. Changes in seroprevalence of Helicobacter pylori infection over 20 years in Jinju, Korea, from newborns to the elderly. J Korean Med Sci 2020;35:e259.




11. Seo JH, Bortolin K, Jones NL. Review: Helicobacter pylori infection in children. Helicobacter 2020;25(Suppl 1): e12742.



12. Miyata E, Kudo T, Ikuse T, et al. Eradication therapy for Helicobacter pylori infection based on the antimicrobial susceptibility test in children: a single-center study over 12 years. Helicobacter 2021;26:e12764.



13. Seo JH, Jun JS, Yeom JS, et al. Changing pattern of antibiotic resistance of Helicobacter pylori in children during 20 years in Jinju, South Korea. Pediatr Int 2013;55:332ŌĆō336.


14. Lee JW, Kim N, Kim JM, et al. Prevalence of primary and secondary antimicrobial resistance of Helicobacter pylori in Korea from 2003 through 2012. Helicobacter 2013;18:206ŌĆō214.


15. Hong J, Yang HR. Efficacy of proton pump inhibitor-based triple therapy and bismuth-based quadruple therapy for Helicobacter pylori eradication in Korean children. Pediatr Gastroenterol Hepatol Nutr 2012;15:237ŌĆō242.



16. Seo JH, Youn HS. Eradication therapy for pediatric Helicobacter pylori infection. Korean J Helicobacter Up Gastrointstinal Res 2017;17:16ŌĆō19.


17. Zhou Y, Ye Z, Wang Y, et al. Comparison of four different regimens against Helicobacter pylori as a first-line treatment: a prospective, cross-sectional, comparative, open trial in Chinese children. Helicobacter 2020;25:e12679.



18. Jun JS, Seo JH, Park JS, Rhee KH, Youn HS. Changes in the treatment strategies for Helicobacter pylori infection in children and adolescents in Korea. Pediatr Gastroenterol Hepatol Nutr 2019;22:417ŌĆō430.



19. Leal YA, Cedillo-Rivera R, Sim├│n JA, Vel├Īzquez JR, Flores LL, Torres J. Utility of stool sample-based tests for the diagnosis of Helicobacter pylori infection in children. J Pediatr Gastroenterol Nutr 2011;52:718ŌĆō728.


20. Kori M, Yahav J, Berdinstein R, Shmuely H. Primary and secondary antibiotic resistance of Helicobacter pylori in Israeli children and adolescents. Isr Med Assoc J 2017;19:747ŌĆō750.

21. Li J, Deng J, Wang Z, Li H, Wan C. Antibiotic resistance of Helicobacter pylori strains isolated from pediatric patients in southwest China. Front Microbiol 2021;11:621791.



22. Kakiuchi T, Matsuo M, Endo H, et al. Gastrointestinal adverse reactions reduce the success rate of Helicobacter pylori eradication therapy: a multicenter prospective cohort study. Helicobacter 2021;26:e12776.



23. Okuda M, Lin Y, Wang C, Kakiuchi T, Kikuchi S. Metronidazole for Helicobacter pylori eradication therapy among children and adolescents in Japan: overcoming controversies and concerns. Helicobacter 2019;24:e12575.


24. Zhou Y, Ye Z, Wang Y, et al. Long-term changes in the gut microbiota after triple therapy, sequential therapy, bismuth quadruple therapy and concomitant therapy for Helicobacter pylori eradication in Chinese children. Helicobacter 2021;26:e12809.



25. Fang HR, Zhang GQ, Cheng JY, Li ZY. Efficacy of Lactobacillus-supplemented triple therapy for Helicobacter pylori infection in children: a meta-analysis of randomized controlled trials. Eur J Pediatr 2019;178:7ŌĆō16.



-
METRICS

-
- 1 Crossref
- 3,656 View
- 120 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
What Is the Optimal Drug Regimen for Helicobacter pylori Eradication Therapy?2024 June;24(2)
Is Helicobacter pylori Infection Associated With Ulcerative Colitis Activity?2024 March;24(1)
Can Helicobacter pylori Infection Reduce the Efficacy of Cancer Immunotherapy?2023 December;23(4)
The Recurrence of Helicobacter pylori Infection: Recrudescence Versus Reinfection2023 December;23(4)






